Практическая химия белка - А. Дарбре 1989
Разделение смесей белков и пептидов методом высокоэффективной жидкостной хроматографии
Гель-хроматография
Определение истинных молекулярных масс
Определение М белка невозможно до тех пор, пока его молекулы не примут форму беспорядочного клубка. Для этого надо разрушить дисульфидные связи либо путем восстановления или окисления надмуравьиной кислотой, либо проведения сульфитолиза. Хроматографию можно проводить в 0,1%-ном водном растворе ДСН, но лучшие результаты получаются при использовании 6 М гидрохлорида гуанидина (Gu∙HCl). Влияние этих детергентов на разделение показано на рис. 6.6 и 6.7 [7-9]. При этом обнаруживается хорошая корреляция между значениями М и коэффициентами распределения белков КD. Детально изучались особенности работы колонок TSKSW 3000 и 4000 (фирмы Toyo Soda) в 6 М Gu∙HCl [28]. Полученные при этом данные хорошо совпадали с результатами разделения в агарозных гелях [10]. Обычно не рекомендуется использовать Gu∙HCl в хроматографах, так как хлорид-ионы вызывают коррозию нержавеющей стали. Однако если по окончании работы тщательно промывать все стальные части, бывшие в контакте с раствором Gu∙HCl, то последний можно использовать в работе на хроматографе. Вместо Gu ∙ НCl авторы использовали в качестве подвижной фазы раствор 6 М мочевины, содержащей 0,2 М муравьиную кислоту [31]. Наблюдалось хорошее соответствие между М и КD, но предел исключения колонки (в данном случае І-125) снизился до М 65 000, что обусловлено разворачиванием полипептидной цепи. Растворы мочевины полезно использовать в структурных исследованиях для подавления взаимодействия белков с носителем, а также в случае плохой растворимости белка. Мочевину удаляют, сорбируя пептиды на патроне Sep-Pak и промывая патрон 0,08%-ной трифтороуксусной кислотой (ТФУ) или 10 мМ∙ацетатом аммония. Затем элюируют пептиды 50%-ным водным ацетонитрилом, содержащим 10 мМ ацетат аммония или 0,08%-ную ТФУ. Если пептиды достаточно велики по размеру и не сорбируются на диализных трубках, то мочевину удаляют, используя трубки Spectropor. Большинство образцов хорошо очищается в трубках, задерживающих вещества с М 1000—3500.
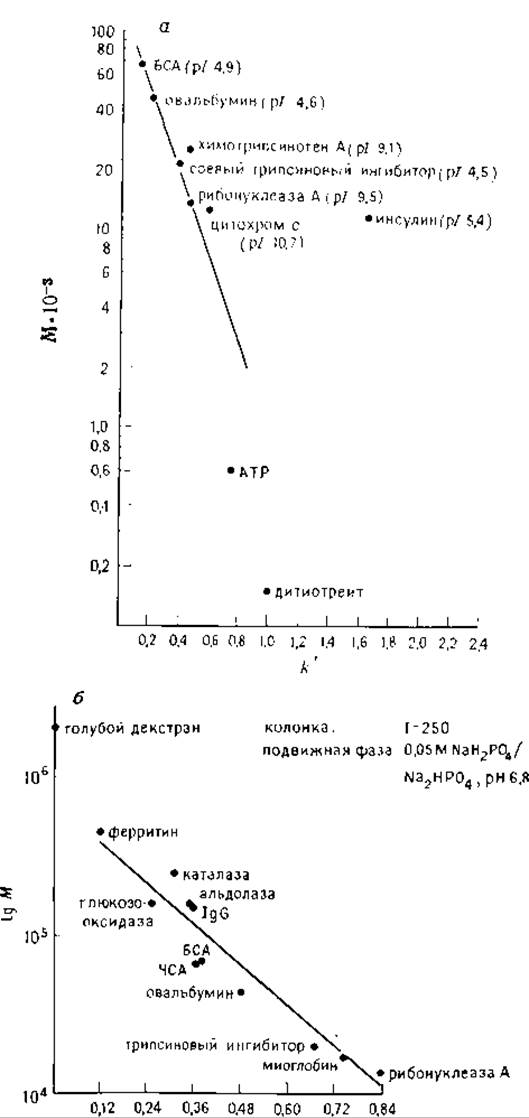
РИС. 6.4. Градуировочные графики гель-хроматографии белков на колонках Waters I-125 (а) и I-250 (б).
а — две последовательно соединенные колонки Waters 1-125; буфер 0,1 М КН2РО4, pH 7, скорость потока 2 мл/мин [6]; б—буфер — 0,05 М NаН2РО4, pH 6,8. (С разрешения фирмы Waters Accociates.)
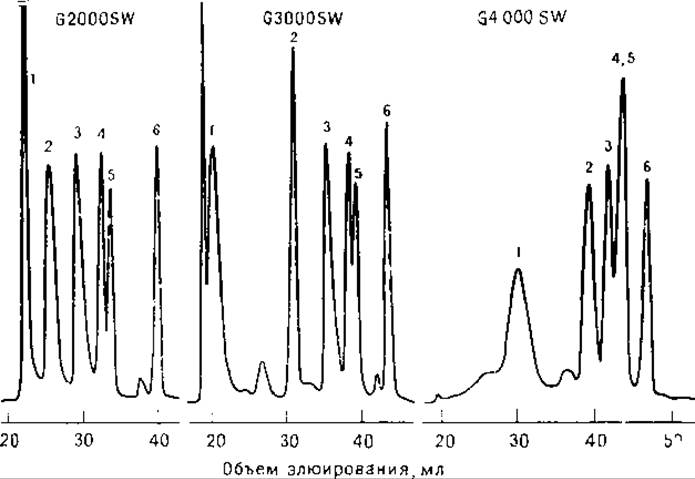
РИС. 6.5. Разделение белков гель-фильтрацией на сорбентах TSK SW с различными размерами пор. Эталонные смеси белков содержали:
1 — тиреоглобулин, 2 — БСА, 3 — ß-лактоглобулин, 4 — миоглобин, 5 — цитохром с, 6 — тетраглицин [7].
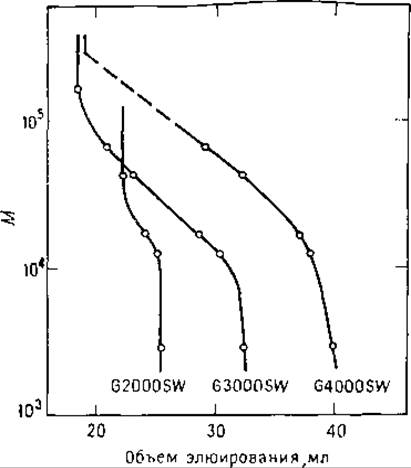
РИС. 6.6. Градуировочные графики разделения белков гель-фильтрацией в растворе ДСН на колонках TSK SW. Буфер 0,1 М NaН2PО4, pH 7 содержащий 0,1% ДСН [81.
На колонках, предназначенных для гель-фильтрации, можно работать в режиме распределительной или адсорбционной хроматографии. При этом неполнота модификации носителя используется для сорбции белка. Ниже обсуждается разделение белков рассмотренными методами.