Практическая химия белка - А. Дарбре 1989
Разделение смесей белков и пептидов методом высокоэффективной жидкостной хроматографии
Адсорбция и распределение полипептидов и белков
Обращенно-фазовая (ОФ) ВЭЖХ пептидов и белков получила широкое распространение с 1970 г. [4, 18]. Попытки перенести методологию разделения малых пептидов в хроматографию больших полипептидов до сих пор чаще всего не приносили большого успеха. При разделении смесей белков или полипептидов на обычных ОФ-сорбентах сталкиваются с проблемами, вытекающими из свойств этих сложных молекул.
Молекулы белков могут иметь на поверхности несколько участков с противоположными свойствами. Эти участки по-разному взаимодействуют с носителями; многие из этих взаимодействий вызывают потерю биологической активности, а необходимость ее сохранения резко ограничивает выбор хроматографических условий. При выделении белка следует избегать взаимодействия компонентов разделяемой смеси с носителем и органическими растворителями; опасны экстремальные pH и резкие изменения концентрации солей. Все эти ограничения не имеют большого значения в тех случаях, когда белок выделяют для изучения его аминокислотной последовательности.
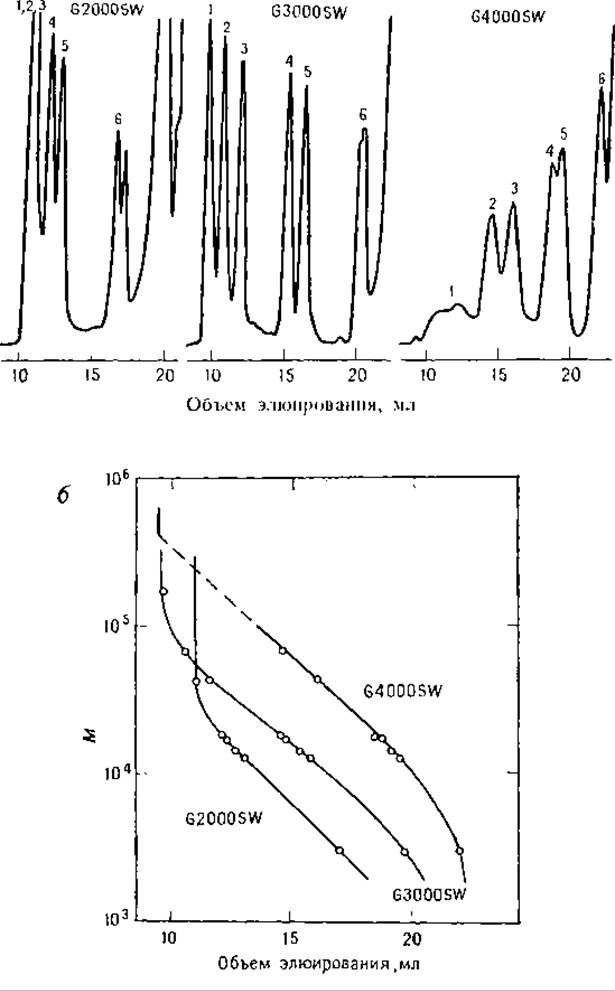
РИС. 6.7. Гель-хроматография белков на колонках TSK SW в растворах Gu*HCl. Белки восстановлены и алкилированы иодоацетамидом [9]. а—использованы три колонки TSK SW. Элюент — 6 М GinHCl, содержащий 0,1 М NaH2PО4, pH 6. Эталонные смеси белков содержали: 1 — тиреоглобулин, 2 — БСА, 3 — овальбумин, 4 — миоглобин, 5 — цитохром с, 6 — инсулин; б — градуировочные графики для белков, разделенных в 6 М GuHCl на колонках TSK SW.
Часто обнаруживается, что белок или полипептид существует в виде нескольких четко различимых форм, которые (часто но непонятным причинам) разделяются при помощи ОФ-ВЭЖХ. Такие неожиданности, конечно, осложняют фракционирование. Поскольку хроматография даже в наши дни все еще остается экспериментаторским искусством, то остается только посоветовать тщательно подбирать условия очистки образца, позволяющие получить материал в гомогенном состоянии.
Обзор текущей литературы дает ключ к выбору исходной стратегии разделения, способной принести успех. Почти всегда приходится опробовать разные режимы разделения методом проб и ошибок, и, конечно, для этой работы потребуется довольно много изучаемого материала. Во многих случаях гораздо выгоднее сначала использовать быструю жидкостную хроматографию белков, а не ОФ-ВЭЖХ. Ниже приводится краткое описание методов, которые, возможно, привлекут к себе внимание биохимиков.
Существует несколько систематических и оригинальных подходов к проблемам разделения больших полипептидов и белков. Изучалось хроматографическое поведение больших пептидов в системах, содержащих триалкиламмоний- и тетраэтиламмонийфосфаты и формиаты [21]. Докладывалось об изучении поведения 32 полипептидов [13, 15]; в ходе этой работы удалось разделить с высоким разрешением такие белки, как миоглобин, цитохром с, лизоцим, используя 0,1 М фосфат (pH 2,1, суммарное содержание электролитов 0,2 моль/л) и градиент концентрации ацетонитрила. Для оптимального разделения оказалось необходимым использовать и солевые эффекты, и низкие pH; большую роль сыграла концентрация органического растворителя. В кислых буферах (pH ~2) боковые цепи Asp и Glu остаются незаряженными, что увеличивает гидрофобность полипептида. Добавление солей приводит к подавлению ионных взаимодействий с носителем. Ацетонитрил как органический растворитель и фосфат как солевой фон использованы неслучайно; это дает возможность регистрировать в элюате пептиды по поглощению пептидной связи при 215 нм.
Недостатком такой системы является необходимость последующего обессоливания образцов, предназначенных для структурных исследований. Сообщалось об использовании кислых буферов, содержащих добавки солей, для очистки полипептидных гормонов, а также о применении мини-колонок для концентрирования образцов [14]. Большие пептиды (М≤10000) фракционировали в буфере на основе ТФУ, а при разделении бромоциановых фрагментов коллагена, (М 3000—60 800) использовали буфер, содержащий гептафторомасляную кислоту (ГФМК) [1]. Для подготовки образца к разделению его концентрируют путем адсорбции в верхней части колонки Vydac С18 [30], причем ГФМК предпочтительнее, чем ТФУ и фосфорная кислоты; показано также преимущество широкопористых носителей (поры 30 нм) перед сорбентами с малым размером пор (6—10 нм). Большой размер пор позволяет молекулам с большой молекулярной массой проникать внутрь частиц сорбента.
В качестве примера оптимизации условий ВЭЖХ больших фрагментов белков можно привести разделение бромоциановых пептидов фетального гемоглобина человека. В ходе исследования изучалось влияние формы частиц носителя, размера пор, природы неподвижной фазы на эффективность разделения [16]. Было показано, что применение буферов на основе ТФУ и н-пропанола в случае сорбентов с размерами пор 30 или 100 нм увеличивает выход пептидов в 1,7—2 раза по сравнению с выходами, полученными для сорбентов с порами 10 нм [16]. Высказано предположение, что на результаты разделения влияет и геометрическая форма частиц сорбента, так как для разных сорбентов одной фирмы (Liсhrosphere и Lichrosorb), имеющих поры одного размера (10 нм), получены разные выходы больших пептидов.
К сожалению, испытания по указанным параметрам проводили для очень узкого набора колонок, что затрудняет интерпретацию результатов исследования. Можно предположить, что увеличение размера пор облегчает доступ молекул полипептида во внутренние каналы частиц, и, по-видимому, это подтверждается в работах, посвященных данному вопросу. По мере накопления экспериментальных данных складывается впечатление, что главным фактором, влияющим на ВЭЖХ полипептидов на широкопористых носителях, является площадь доступной поверхности, а не размер пор частиц. При уменьшении размера колонки до 50 мм сохраняется ее разрешающая способность, что свидетельствует об участии адсорбции в процессе разделения полипептидов. Опубликована работа по выбору условий ОФ и нормально-фазовой (НФ) ВЭЖХ применительно к полипептидам и белкам [23]. Для очистки ß-липотропина [24], ß-эндорфина [25] использовали Lichrosorb RP-18, а для очистки лейкоцитарного интерферона — Lichrosorb RP-8 в сочетании с Lichrosorb DIOL [23]. Средний размер пор двух последних сорбентов составляет 10 нм. В качестве органического модификатора был выбран н-пропанол.
В некоторых работах (включая очистку интерферона) применяли двухстадийное фракционирование в разных буферах (pH 4 и 7,5). Ионные взаимодействия, выявленные в случае носителя RP-8, подавляли формиатом пиридиния или ацетатом аммония. Так как при использовании этих буферов невозможно регистрировать изменение поглощения элюата при 215 нм, то применяли автоматизированные послеколоночные методы флуоресцентного детектирования [2]. Результаты разделения на RP-8 приведены на рис. 6.8. Образец наносили на колонку RP-8 (4,6x250 мм, размер зерна сорбента 10 мкм) в 62,5 мл 4 М раствора мочевины, содержащего 0,1 М ацетат натрия (pH 7,5). Колонку промывали 1 М ацетатом натрия (pH 7,5). Пептиды элюировали в градиенте концентрации н-пропанола (1 ч, 0— 20%; 3 ч, 20—40%) при скорости потока 0,25 мл/мин. Элюат контролировали па присутствие интерферона, нужные фракции объединяли (рис. 6.8, а).
Таким образом, нанося па колонку образец в большом объеме буфера, содержащего мочевину и ацетат, можно значительно ускорить процесс концентрирования и разделения образцов благодаря адсорбции полипептидов на ОФ-сорбентах. Пептиды отделяют от мочевины на патронах Sep-Pak [31] или на мини- колонках [14]; Sep-Pak использовали и для концентрирования образца перед ВЭЖХ [1].
Иногда ОФ-колонки применяют для проведения нормальнофазовой (НФ) хроматографии [23]. При последующем элюировании в ОФ-режиме с колонки RP-8 выделены фракции, содержащие интерферон. К объединенным фракциям добавляли н-пропанол (до концентрации 80%), раствор наносили на колонку Lichrosorb DIOL. Понижая концентрацию н-пропанола во время разделения, получили очищенный интерферон (рис. 6.8, б). Для полной очистки образца его пропустили еще через две ОФ-колопки (рис. 6.8,б и г). НФ-хроматография особенно полезна при очистке гидрофобных белков, растворимых в системах с высоким содержанием органических растворителей. В таких системах вместе с гидрофобными белками могут соосаждаться многие другие белки, однако последние можно отделить ОФ-хроматографией, что позволяет получить гидрофобные объекты в растворенном состоянии [23]. Ранее уже обсуждалось применение сорбента Lichrosorb DIOL для гель-фильтрации полипептидов (разд. 6.2.2). Недавно фирмы LKB и Toyo Soda предложили использовать фенил-Т5К-колонку для НФ-хроматографии пептидов.
Проводились сравнительные испытания сорбента Lichrospherе (размер пор 50 нм) с носителями, покрытыми фазой C8, имеющими поры 10 нм. Сравнение показало, что в случае носителей, имеющих большие поры, емкость колонки по большим белкам (бычий сывороточный альбумин, коллаген) увеличивается, а ширина зоны элюирования уменьшается. На сорбентах с порами 10 нм можно проводить разделение белков с М 10 000—20 000.
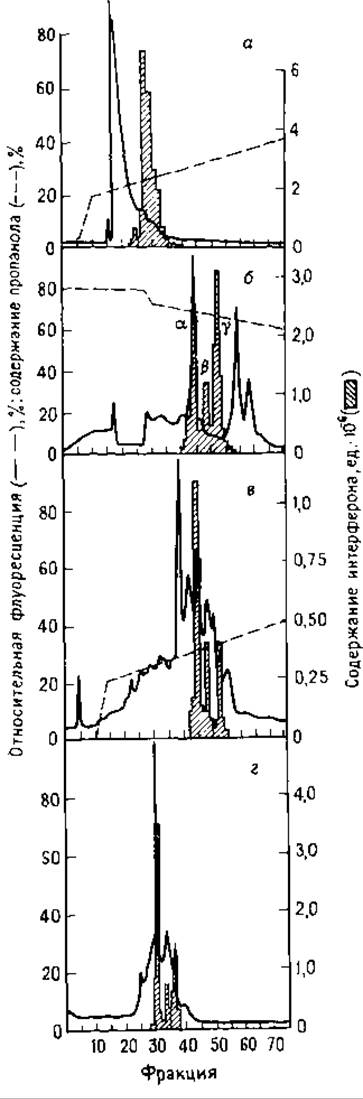
РИС. 6.8. Очистка интерферона на Lichrosorb RP-8 с использованием ОФ- и НФ-ВЭЖХ. а — на колонку нанесли 63 мл раствора интерферона в 4 М мочевина — 0,1 М ацетат натрия: колонка промыта 1 М ацетатом натрия, pH 7,5; белок элюировали в градиенте н-пропанола (см. текст); б — фракции элюата, содержащие интерферон из а, объединяли и доводили содержание «-пропанола до 80%; наносили на колонку, элюировали н 0,1 М ацетате натрия с градиентом концентрации н-пропанола (72,5 — 50%); скорость потока 0,25 мл/мин [26]; в — фракции из НФ-разделения, содержащие интерферон, объединяли и разделяли ОФ-ВЭЖХ в пиридинформиатных буферах в градиенте концентрации н-пропанола; г — хроматография продукта, полученного из разделения в. Условия разделения аналогичны в.
Замечание. Измерения флуоресценции проводили в элюате с постколоночной обработкой фракций.