Практическая химия белка - А. Дарбре 1989
Разделение смесей белков и пептидов методом высокоэффективной жидкостной хроматографии
Обращенно-фазовое разделение пептидов
Корреляция между удерживанием и структурой
Существует определенная взаимозависимость между гидрофобностью пептидов и их удерживанием на ОФ-носителе. По результатам хроматографии ряда пептидов рассчитывались их коэффициенты гидрофобности с учетом коэффициентов распределения пептидов в системе октанол — вода [15]. Обнаружена зависимость между суммой коэффициентов гидрофобностей отдельных аминокислот и временем удерживания пептидов. Однако следует отметить, что в опубликованных данных имеются значительные противоречия.
Для снижения влияния конформационных эффектов и улучшения формы пика использовали хаотропный агент (0,1 М перхлорат натрия с добавкой 5 мМ фосфата натрия или 0,1% фосфорной кислоты для получения раствора с pH 7,4 или 2,1) и градиент концентрации ацетонитрила [12]. При этом получено хорошее соответствие между изменением коэффициентов удерживания и временем элюирования выделяемых пептидов. Проводилось детальное исследование теории равновесного распределения [5, 11]; в ходе этой работы показана возможность разумного предсказания последовательности элюирования пептидов с использованием суммы коэффициентов гидрофобности боковых цепей аминокислот. Многочисленные убедительные примеры использования ОФ-ВЭЖХ для препаративного и аналитического фракционирования пептидов показали несомненную ценность, этого метода.
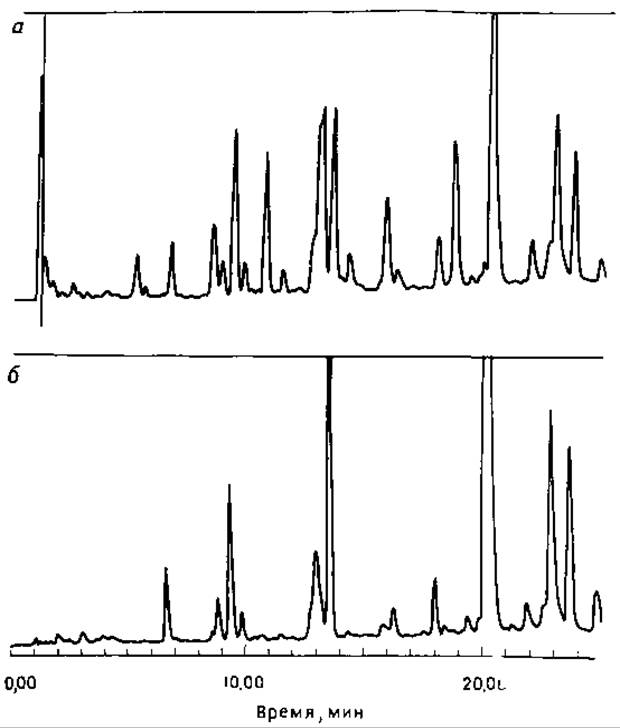
РИС. 6.10. Разделение триптических пептидов цитохрома с ОФ-ВЭЖХ. Гидролизат фракционировали на колонке Vydac RP (С 18) (4,6X75 мм) в 0,08%-ной ТФУ с градиентом концентрации ацетонитрила 1—40%. Поглощение элюата записывали при помощи детектора с диодной линейкой (Hewlett Packard 1040). а и б — определение оптического поглощения при 215 (а) 280 нм (б); в — результаты сканирования фракций, не содержащих ароматических аминокислот (1), содержащих Туr (2), Тrр (3) и гем (4). По результатам сканирования отбирали отдельные пептиды для последующего анализа.
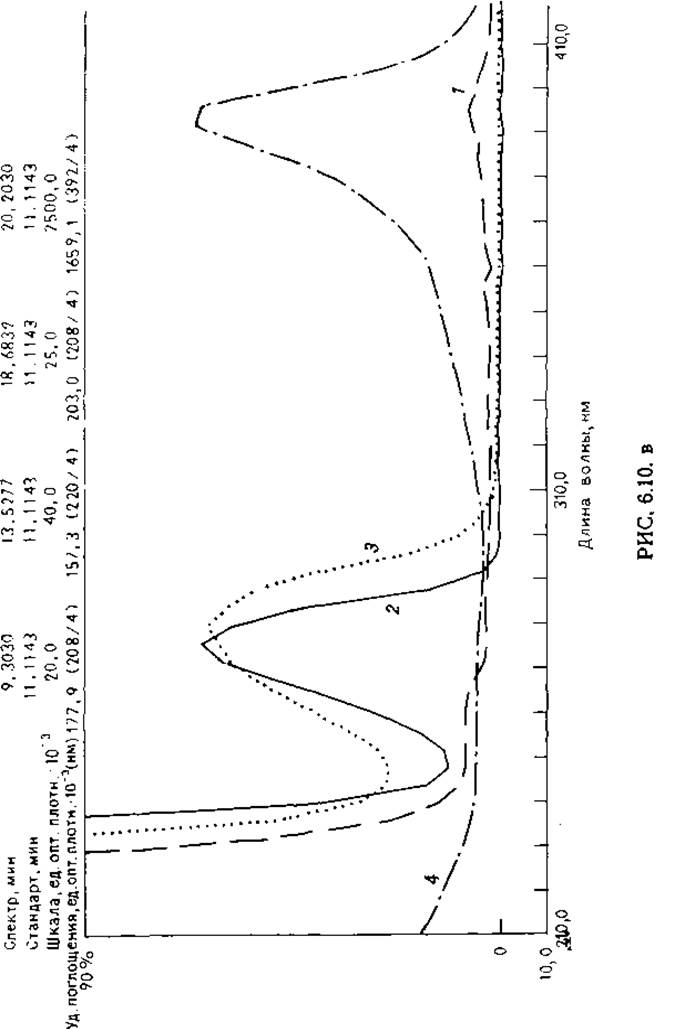
Особенно привлекательно для анализа пептидов использование многоволнового детектирования для оценки чистоты или селективного выделения отдельных пептидов. В настоящее время несколько фирм производят оптические сканнеры, снабженные компьютерами, записывающими базовую линию, наклон и уровень сигнала при сканировании пика (рис. 6.10). В некоторых случаях полезно использовать отношения поглощения на разных длинах волн.