Практическая химия белка - А. Дарбре 1989
Пептидное картирование белков
Картирование пептидов на практике
Картирование по Кливленду
Искомый белок (меченый или без метки) может быть выделен из смеси с помощью традиционных биохимических методов (осаждение сульфатом аммония, хроматография па открытых колонках) или более современных подходов (например, иммунопреципитация [13] и аффинная хроматография [18, 29]). Однако часто очистка белка до гомогенного состояния этими методами бывает затруднена и на завершающей стадии используют систему с наиболее высокой разрешающей способностью — электрофорез в ПААГ — ДСП. В первоначальном варианте методики Кливленда [12] применялось слабое окрашивание белка в геле кумасси голубым [14] и затем быстрое обесцвечивание и вырезание соответствующей полосы мокрого геля.
В случае радиоактивно меченных белков гель извлекают из прибора для электрофореза, промывают его — 20 объемами дистиллированной воды для удаления компонентов буфера и затем высушивают без предварительной фиксации (если гель фиксировался в уксусной кислоте или метаноле, то элюирование интактного белка с регидратированного геля часто бывает затруднено). Высушенный гель затем подвергают радиоавтографии и вырезают нужную полосу белка, используя рентгеновскую пленку в качестве подложки.
Второй ДСН-гель готовят с такой концентрацией акриламида, в которой подвижность исследуемого белка составляет —0,2 относительно положения фронта красителя (бромофенолового синего) (рис. 7.1). Применяются также гели, приготовленные с градиентом концентрации акриламида; они особенно полезны в тех случаях, когда трудно предсказать размер образующихся фрагментов. Концентрирующий гель должен иметь сравнительно низкое содержание акриламида, чтобы не ограничивалась подвижность интактного белка или протеолитического фермента (если он используется), и достаточную длину для того, чтобы образец образовал компактную полосу до достижения разрешающего геля. Ячейки должны быть настолько широкими и глубокими, чтобы вместить куски регидратированного геля с белком и раствор фермента и обеспечить их свободный контакт.
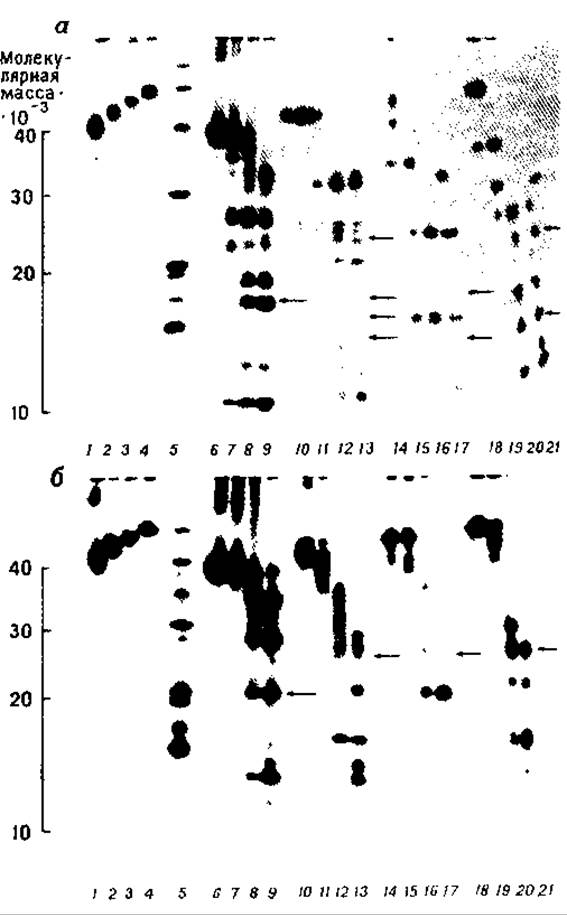
РИС. 7.1. Картирование на ПААГ в присутствии ДСН субъединиц ацетилхолинового рецептора, а — гидролиз протеазой V8; 1—4— 5 мкг a-, ß-, 7- и 6-субъединиц, 5—белки-маркеры; 6—9-а, 10—13 — ß, 14—17 — 7 и 18—21—6-субъединицы, гидролизованные протеазой V8 в количестве 0,0005, 0,005, 0,05 и 0,25 мкг соответственно; б — гидролиз папаином: 1—4—5 мкг a-, ß-, и δ-субъединиц, 5 — белки-маркеры, 6—9 — а-, 10—13 — ß-, 14—17 — у- и 18—21—б-субъединицы, гидролизованные папаином в количестве 0,0001 0.001, 0,01 и 0,1 мкг соответственно. Стрелки указывают на полосы, обработанные реагентом Шиффа для обнаружения углеводов [32]. (С разрешения American Chemical Society.)
Выбор способа расщепления зависит от природы белка-субстрата и осуществляется экспериментатором па основании своего опыта. Широко применяются протеолитические ферменты и среди них можно отметить протеазу V8, выделенную из фильтрата культуры Staphylococcus aureus [15]. Этот фермент расщепляет пептидную цепь по С-концу остатков глутаминовой и аспарагиновой кислот, по в соответствующем буфере гидролиз протекает только по остаткам глутаминовой кислоты [34]. В обычных буферных растворах ступенчатого гель-электрофореза по Леммли [40] протеаза V8 расщепляет связи, образованные обеими дикарбоновым и аминокислотами. Поскольку гидролиз осуществляется в концентрирующем геле, соответствующий фермент должен сохранять активность в 0,1%-ном (масс./об) растворе ДСП, а желательно и при более высокой концентрации детергента. В этих условиях активны и могут быть использованы протеаза V8 [4, 30], папайи [32], эластаза, а-химотрипсин [29], трипсин [4].
Если белок-субстрат находится в растворенном состоянии, то фермент добавляют к нему непосредственно и инкубируют смесь в течение определенного времени до нужной степени расщепления. Затем гидролизат переносят в гель и разделяют обычным путем [30, 31]. При этом пет необходимости инактивировать протеазу, поскольку она будет отделена от субстрата в разделяющем геле. Обычно после завершения гидролиза добавляют восстанавливающий агент и образец нагревают в течение 2—5 мин при 100 °С. Эта процедура способствует образованию более четких полос при электрофорезе и одновременно инактивирует фермент.
Чаще белок гидролизуют в зоне полиакриламида: раствор фермента (оптимально —10 мкл) помещают в соответствующую лупку, которая уже содержит электродный буфер. Раствор фермента по составу должен быть аналогичным тому, в котором находится концентрирующий гель, но иметь несколько большую плотность, для чего добавляют 10—20% глицерина или сахарозы. Кусочек геля, содержащий белок-субстрат, осторожно опускают в лупку над раствором протеазы так, чтобы не нарушить компактность слоя. Полезно для приготовления второго геля использовать более широкие спенсеры, чем для первого, но обычно несложно поместить кусочки геля в лунку пластины геля того же размера, при этом желательно достичь плотного прилегания, чтобы избежать возможности падения кусочка геля в раствор фермента и его разбрызгивания. Расположение геля с субстратом, как на «подушке» более плотного раствора фермента, способствует более эффективному гидролизу, поскольку при этом достигается равномерное распределение протеазы по всей поверхности трека.
При подаче напряжения белок-субстрат из геля и протеаза концентрируются, образуя узкие, прилегающие друг к другу зоны; после этого ток выключают (обычно на 30—60 мин) для прохождения ферментативного гидролиза. Активная нативная протеаза расщепляет некоторые из наиболее «чувствительных» связей денатурированного развернутого субстрата. Затем вновь подают напряжение и образовавшиеся фрагменты разделяются в разрешающем геле.
Для обнаружения пептидов па электрофореграмме в ПААГ — ДСН применяют несколько методов. В белок может быть предварительно введена радиоактивная метка (с использованием клеточного метаболизма или in vitro), в этом случае разделенные фрагменты детектируют методом авторадиографии или флуорографии [2]. Специфическая идентификация достигается при использовании аффинной метки (такой, как природный лиганд и его синтетические аналоги) [29] или с помощью ферментов, в частности киназ, способных вводить радиоактивные группы (при условии, что они играют роль субстратов). В более общем случае включение метки осуществляется иодированием доступных остатков тирозина [11, 53, 54, 45] и метаболически в культуре ткани [13] или органа [59] в среде, содержащей одну или несколько меченных аминокислот. При специфическом мечении радиоактивность вводится только в некоторые пептидные фрагменты; метод может быть очень информативным при исследовании локальной гомологии, такой, как, например, окружение лигандсвязывающего центра [29] или участков фосфорилирования.
Для окрашивания гелей применяют также реагенты общего типа — кумасси голубой [14], комплексы серебра [47, 48, 52] или более специфичные, например для идентификации гликопептидов [17, 28, 69] — реагент Шиффа [32], модифицированный вариант окрашивания комплексами серебра [16], лектины, содержащие радиоактивную [39] или флуоресцентную метку [23] (см. также гл. 8).
Полипептиды могут быть перенесены с геля на нитроцеллюлозные пластинки [7, 25, 67], положительно заряженные мембраны [24], диазотированную бумагу [10, 56] и обнаружены по специфическому связыванию с меченными антителами [29] или лектинами [27, 33], С помощью антисыворотки можно идентифицировать все фрагменты белка, а моноклональные антитела или лектины специфически связываются с одним или некоторым ограниченным числом фрагментов. Поскольку посредством антител можно обнаружить индивидуальный белок в смеси, эта методика позволяет провести сравнение двух белков, один из которых не был ранее выделен в очищенном состоянии. По Кливленду картируют обычно пептиды относительно больших размеров, и применение иммунных методов для их обнаружения целесообразно, поскольку высока вероятность содержания в них нерасщепленных линейных антигенных детерминант.
Для получения оптимального набора фрагментов белка с помощью протеолиза (по величине составляющих компонентов) испытывают различные нагрузки фермента при фиксированном количестве субстрата [12] (рис. 7. 1). При отсутствии данных о чувствительности к протеолизу исследуемого белка (она может варьировать в широких пределах) начинают с нагрузки фермента 1 мкг на лунку геля. Затем уменьшают или соответственно увеличивают ее в 10 раз, если позволяет имеющееся в распоряжении количества белка. На основании полученных результатов выбирают оптимальные условия эксперимента.
Могут быть использованы также химические методы расщепления полипептидной цепи: обработка бромоцианом (по остаткам метионина) [9, 43, 50], муравьиной кислотой (по связям аспарагиновая кислота — пролин) [41, 58] или N-хлоросукцинимидом (по остаткам триптофана) [42]. В этих случаях кусочек геля с белком обрабатывается в пробирке реагентом, а затем образовавшаяся смесь фрагментов наносится для разделения на второй гель. Преимущество химических методов очевидно, когда исследуется небольшое количество немеченного белка и необходимо для проявления применять высокочувствительное окрашивание серебром, которому не мешает присутствие протеаз.
Опубликовано множество вариантов картирования пептидов в гелях. С помощью электрофореза в первичном геле можно разделить несколько белков, после чего из геля вырезают полоску, накладывают ее на другой гель, проводят ферментативный гидролиз, как описано выше, и вторично разделяют электрофоретически образовавшиеся фрагменты.
Таким образом, с небольшой затратой усилий могут быть получены пептидные карты нескольких белков, находящихся в смеси (при условии, что они обладают разными относительными подвижностями в первичном геле) [4, 41, 65]. Осложнения, возникающие при использовании этой методики, связаны с тем, что концентрация компонентов в исходной смеси может быть различной, а гидролиз проводится с одной нагрузкой фермента. Это может привести к неодинаковой степени расщепления белков и ошибочным выводам при анализе электрофореграммы.
В случае если белок доступен лишь в очень малых количествах, его фрагменты могут быть перенесены с геля электрофоретически на диазотированную бумагу, с которой они связываются ковалентно, или на нитроцеллюлозу, где осуществляется нековалентное взаимодействие. При наличии соответствующей антисыворотки или моноклональных антител фрагменты белка могут быть обнаружены на реплике с высокой степенью чувствительности. Так, смесь гидролизатов субъединиц ацетилхолинового рецептора из трех различных видов животных удалось разделить с помощью одномерного электрофореза [29] и затем полипептиды перенести па бумагу, содержащую диазофенилтиоэфирные группировки [56, 63]. Для обнаружения фрагментов конкретной субъединицы в смеси были использованы антисыворотки и моноклональные антитела, полученные к каждой индивидуальной субъединице рецептора, что значительно упростило их сравнительный анализ (рис. 7.2, а—ж). Пептидные карты оказались различными, но на карте ж с помощью моноклональных антител был обнаружен фрагмент с одинаковой подвижностью в каждом из трех треков — 4, 5 и 6. Это свидетельствовало о том, что рецепторы каждого вида обладают некоторой степенью гомологии, проявившейся в образовании фрагмента одного размера с идентичной линейной антигенной детерминантой во всех трех случаях.
Нет сомнения в том, что картирование по Кливленду в дальнейшем будет развиваться и совершенствоваться. Уже сейчас, например, становятся общедоступными эксперименты, в которых на основе содержащихся в клетке в очень малом количестве мРНК получают кДНК, клонируют ее и определяют нуклеотидную последовательность. Поли- и моноклональные антитела к синтетическим пептидам из выведенной последовательности используют для идентификации соответствующих белков на электрофореграммах.