Практическая химия белка - А. Дарбре 1989
Пептидное картирование белков
Картирование пептидов на практике
Пептидное картирование с помощью высокоэффективной жидкостной хроматографии
Известно три варианта аналитического картирования пептидов методом высокоэффективной жидкостной хроматографии (ВЭЖХ): обращенно-фазовая (ОФ-ВЭЖХ), ионообменная и гель-проникающая хроматография.
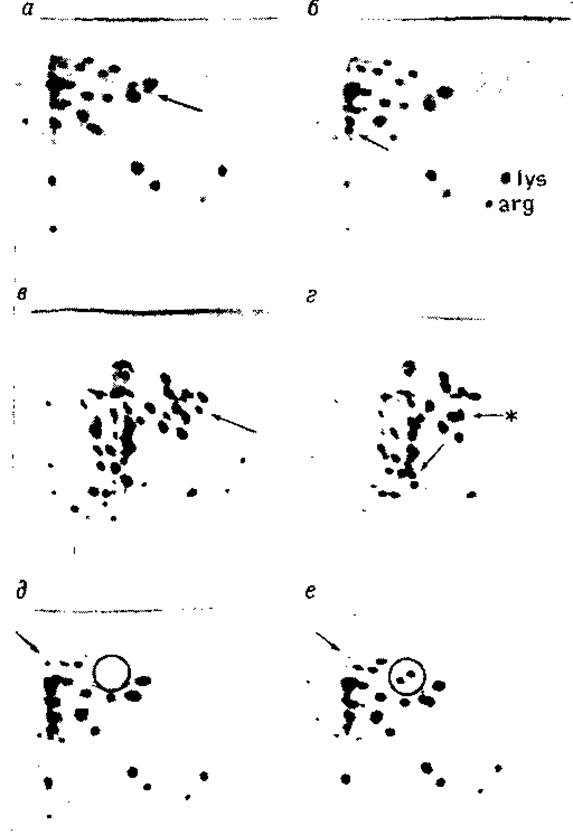
РИС. 7.3. Разделение триптических пептидов актинов моллюска и кролика на пластинках с тонким слоем силикагеля G. Триптические пептиды актинов моллюска (а) и кролика (б); стрелками отмечены уникальные пептиды; электрофорез, pH 3,5; хроматография: хлороформ — метанол — аммиак (2:2:1); в и г — триптические пептиды актинов моллюска (в) и кролика (г); стрелками отмечены уникальные пептиды, стрелкой со звездочкой — различие в положении пятен; электрофорез, pH 6,5; хроматография: пропанол — аммиак (7:3). д — гидролизат актина кролика, протеолиз и картирование в присутствии ДСН; е — тот же гидролизат в обычных условиях; некоторые пятна (обведены кружком) менее интенсивны в присутствии ДСН, в то же время другие (стрелки) более отчетливы; электрофорез, pH 3,5; хроматография: пропанол — аммиак (7:3). Все образцы нанесены в количестве 1 нмоль в 2,5 мкл (табл. 7.1) [60]. (С разрешения Academic Press.)
7.3.3.1. ВЭЖХ на обращенной фазе (ОФ-ВЭЖХ) с использованием градиентного элюирования [22, 57]. В настоящее время это наиболее широко используемый и наиболее эффективный метод разделения пептидов. Он основан на применении колонок, упакованных небольшими (3—10 мкм) пористыми частицами, поверхность которых покрыта алифатическими или фенильными группами, играющими роль неполярной стационарной фазы. Смесь небольших пептидов, полученных в результате ферментативного [8, 22, 49] или химического [68] расщепления белка, наносится на колонку в растворителе, выбранном таким образом, чтобы все или по крайней мере большинство компонентов гидрофобно связались с поверхностью упаковки. Затем через колонку пропускают подвижную фазу — водный раствор какого-нибудь органического растворителя с повышающимся градиентом концентрации (по объему). Пептиды элюируются в чрезвычайно узких зонах, первыми сходят гидрофильные, наиболее слабо взаимодействующие с гидрофобной стационарной фазой пептиды. Метод особенно эффективен в применении к пептидам, содержащим до —50 аминокислот, и менее пригоден для разделения более крупных фрагментов.
Перед анализом ВЭЖХ па обращенной фазе белок гидролизуют трипсином или другим ферментом обычно в аммонийбикарбонатном буфере. Затем смесь пептидов может быть обработана специальными реагентами для повышения чувствительности обнаружения после фракционирования [8]. Недостатком предколоночной модификации является то, что вводимые флуоресцентные или поглощающие при определенной длине волны группы нивелируют структурные различия пептидов и таким образом снижают эффективность разделения.
В качестве стационарной фазы наиболее часто используют носители с углеводородными цепями С8 и С18, по коммерчески доступны и другие носители [57].
Решающее значение для процесса разделения имеет выбор подвижной фазы; предложено множество различных смесей растворителей и условий хроматографии для решения конкретных задач (более подробное обсуждение см. в работе [57]). Описаны попытки с помощью расчетных методов предсказывать времена удерживания пептидов для данной системы растворителей и упаковки колонки [5, 46, 71], по, как правило, в общем случае для установления степени сходства исследуемых образцов бывает достаточно качественного сравнения кривых элюирования.
В практике очень широко используют несколько систем растворителей. Так для уравновешивания колонки служит 0,1%-ный (об./об.) (0,013 М) водный раствор трифтороуксусной кислоты (ТФУ) [44]. После введения пептидной смеси для контроля связывания всех или большинства компонентов смеси пропускают несколько объемов колонки 0,1%-ной ТФУ. Затем для элюирования индивидуальных пептидов на колонку подается линейный градиент концентрации ацетонитрила в 0,1%-ной ТФУ. Почти все пептиды, исследованные в этой системе, сходят с колонки ко времени повышения концентрации ацетонитрила до 60%. Для того чтобы избежать, возможного изменения коэффициента преломления из-за неполного смешения растворов в качестве второго растворителя применяют водный ацетонитрил (60% ацетонитрила + 40% воды), содержащий 0,1 ТФУ. Все используемые растворители должны быть высокой степени чистоты, поскольку даже незначительные примеси могут сконцентрироваться на колонке и затем элюироваться соответствующей концентрацией ацетонитрила. Оптимальная скорость потока 1 мл/мин, более медленное элюирование не улучшает разрешения. По окончании градиентного режима колонку вновь уравновешивают стартовым буфером, чтобы она была готова для нанесения следующего образца. Могут быть использованы другие буферные системы, такие, как ацетат аммония или фосфат натрия, при нейтральном pH, дающие другие результаты разделения.
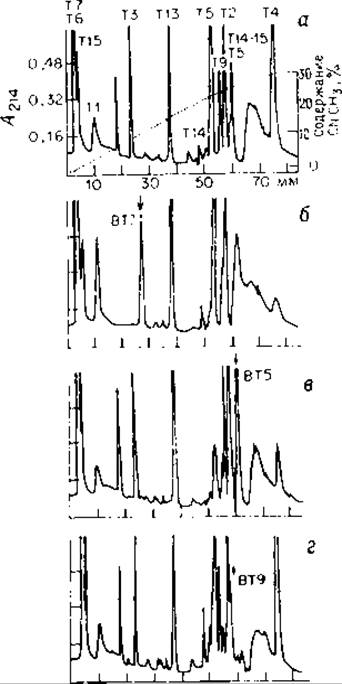
РИС. 7.4. Разделение пептидов триптических гидролизатов (0,8 мг) ß-цeпей гемоглобинов человека методом ВЭЖХ на обращенной фазе: а — нормальный гемоглобин; б — гемоглобин Cocody (рІ - 7,205); в — гемоглобин Avicenna (рІ 7,225); г — гемоглобин Korle Bu (рІ 7,210) [1]. (С разрешения Elsevier/North Holland, Biomedical Press.)
В качестве практически осуществленного примера применения ОФ-ВЭЖХ для картирования пептидов можно привести сравнительный анализ молекул нормального и мутантных гемоглобинов [1, 62]. При исследовании ß-цепей нескольких гемоглобинов человека их триптические гидролизаты были разделены на колонке С18, уравновешенной аммонийацетатным буфером в градиенте ацетонитрила [1]. В каждой хроматограмме пик одного пептида был смещен относительно положения пиков фрагментов нормального гемоглобина (рис. 7.4). Фракции пептидов с необычными временами удерживания были собраны и проанализированы их аминокислотные составы и последовательности. В каждом случае был найден единственный аминокислотный остаток, отличающийся от соответствующей аминокислоты нормального гемоглобина. Время разделения составило всего 80 мин.
7.3.3.2. Ионообменная ВЭЖХ. Второй метод, весьма часто применяемый в аналитических целях — ионообменная ВЭЖХ (ИО-ВЭЖХ), где связывание пептидов с ионогенными группами носителя происходит в результате взаимодействия зарядов. Элюирование осуществляется путем повышения ионной силы или изменения pH подвижной фазы, иногда одновременно с увеличением содержания органических растворителей [38, 64]. Эта методика дает наилучшие результаты в случае относительно небольших молекул, хотя определенные возможности имеются и для разделения белков [57]. Ионообменная ВЭЖХ основана на ионных взаимодействиях, которые «работают» и в «открытых» колонках классической ионнообменной хроматографии. Образец наносится па колонку в растворе с низкой ионной силой и pH, при котором стационарная фаза и образец ионизованы, по обладают различными зарядами. Для элюирования пептидов через колонку пропускается раствор с повышающимся градиентом ионной силы или изменяющимся pH. Преимущество метода ИО-ВЭЖХ по сравнению с обычной ионообменной хроматографией заключаются в минимальном разбавлении образца во время разделения и очень чувствительных методах обнаружения. Как и в ВЭЖХ па обращенной фазе, па ионообменную колонку образец в случае необходимости может быть нанесен в большом объеме, поскольку пептиды должны связаться с носителем до начала градиентного элюирования.
7.3.3.3. Гель-проникающая ВЭЖХ. Третий метод — гель-проникающая ВЭЖХ — реже используется для аналитического картирования пептидов [66] главным образом из-за отсутствия колонок этого типа, пригодных для разделения сложных смесей небольших пептидов (М<5000). Однако имеются колонки, на которых можно фракционировать пептиды большего размера и белки; они применяются па стадиях очистки или обессоливания белков.
7.3.3.4. Методы обнаружения. Измерение оптической плотности флуоресцентного излучения и радиоактивности — эти методы применяются во всех видах ВЭЖХ при картировании пептидов; значительно реже используют измерение коэффициента преломления и электрохимические методы [57].
Измерение оптической плотности при определенной длине волны до настоящего времени остается наиболее распространенным методом обнаружения пептидов в ВЭЖХ. Единственное условие его успешного применения — отсутствие поглощения в выбранной области у растворителя (особенно для второго, создающего градиент компонента). Система ТФУ — градиент концентрации ацетонитрила особенно удобна в этом отношении, поскольку делает возможным проведение измерения поглощения вплоть до 210 им [44J. Определение можно осуществлять одновременно при нескольких длинах воли, что позволяет селективно идентифицировать пептиды, содержащие определенные аминокислотные остатки (тирозин, триптофан). В настоящее время фирмы предлагают детекторы, с помощью которых можно получать точные профили индивидуальных пиков хроматограммы, что облегчает оценку степени гомогенности и идентичности соединений.
При наличии очень небольших количеств пептидных фрагментов проводят их модификацию о-фталевым альдегидом или флуорескамином для последующего измерения флуоресценции 135]. Методика основана па том, что сфокусированное УФ-излучение определенной длины волны возбуждает флуорогенный реагент в проточной ячейке, а испускаемая при этом флуоресценция концентрируется линзой, расположенной под углом 90° к источнику света. Чувствительность обнаружения в этом случае повышается по сравнению с измерением поглощения на два порядка, но для модификации компонентов смеси после выхода с колонки требуется установка дополнительного насоса (разд. 8.16.3.1).
Радиоактивные пептиды идентифицируют с помощью проточных счетчиков или чаще измерением радиоактивности во фракциях с помощью подходящих гамма- или жидких сцинциляционных счетчиков.