Практическая химия белка - А. Дарбре 1989
Аналитические методы
Исчерпывающий гидролиз белков для аминокислотного анализа
Методики кислотного гидролиза
Гидролиз белков кислотой или щелочью приводит к потере некоторых аминокислот и их производных. В общепринятых условиях исчерпывающего гидролиза (6 М НСl, 18—24 ч, 110 °С [266]) полностью разрушаются триптофан, аспарагин, глутамин, гликозиды, эфиры, образованные карбоксильными сульфо- и фосфорными группами, частично теряются серин, треонин и тирозин. Цистин и метионин частично разрушаются или окисляются до цистеиновой кислоты и метионинсульфона соответственно. Пептидные связи, включающие остатки валина, изолейцина и лейцина, гидролизуются трудно, и продолжительность гидролиза образцов, содержащих эти аминокислоты, увеличивают до 48, 72, 96 и даже 120 ч. Скорость высвобождения и деструкции индивидуальных аминокислот зависит в основном от природы белка и присутствия в нем солей и металлов (в металлопротеинах). Обычно кинетические кривые высвобождения серина, треонина и других лабильных остатков экстраполируют к нулевому времени гидролиза, а аминокислот с разветвленной боковой цепью — к бесконечному времени [372]. Однако может быть принято допущение, что за 24 ч теряется 10% серина и 5% треонина. Окисление во время гидролиза метионина и частичное превращение тирозина в 3-хлоропроизводное может быть предотвращено добавлением к 6 М НСl соответственно меркаптоэтанола и фенола. Гидролиз белков для аминокислотного анализа подробно обсуждается в ряде обзоров [27, 106, 220, 266, 293, 317, 327].
8.6.1.1. Соляная кислота. Для гидролиза используют кипящую при постоянной температуре соляную кислоту (разд. 8.4) или продажную 6 М НСl высшего качества с добавкой 0,02% меркаптозтанола и 0,25% (масс./об.) фенола. Для удаления следов кислорода пропускают через кислоту в течение 5 мин поток азота.
Приготовление образцов для гидролиза. Пробирки или ампулы, которые могут быть изготовлены путем запаивания коротких трубочек из стекла пирекс, в целях очистки следует обработать, как описано в разд. 8.2. Берут навеску (1—5 мг) высушенного на воздухе или лиофилизованного белка (взвешивают прямо в ампуле); можно использовать и раствор белка, при этом лиофилизацию аликвотной части раствора проводят также в ампуле. Анализируемый образец не должен содержать солей, поэтому используют летучие буферные растворы.
Добавляют к осадку 6 М HCl (1 мл на 5 мг белка или при меньших количествах 10—200 мкл). Вращением ампулы в пламени кислородно-газовой горелки под углом 45° разогревают стекло в верхней части и оттягивают его так, чтобы образовался «перешеек» с диаметром ~1 мм. Чтобы не обжечь руки, можно припаять к ампуле небольшую стеклянную трубку. Замораживают содержимое ампулы в бане (ацетон с твердой углекислотой), присоединяют ее к вакуумной линии с помощью короткой резиновой или тайгоновой трубки и откачивают воздух на масляном насосе ниже остаточного давления 5∙10-2 мм рт. ст. При работе одновременно с несколькими образцами удобно использовать стальную или стеклянную систему (рис. 8.1). Ампулы одеваются на боковые отростки на пробках. Трехходовой кран в положении 1 позволяет включать и отключать вакуум.
В процессе вакуумирования (обычно 3—5 мин бывает достаточно) образец должен находиться под наблюдением. Если масса в ампуле начинает подниматься или «вскипать», то на короткое время к верхней ее части подводят тепло. Если эта процедура не помогает, на мгновение открывают кран 1 и тут же его закрывают. При необходимости повторяют эту процедуру несколько раз. Второй трехходовой кран в положении 2 присоединен к баллону с азотом, что делает возможным проводить попеременно удаление воздуха из системы и наполнение ее азотом до полного исключения кислорода. В процессе вакуумирования рекомендуется осторожно разморозить содержимое ампулы для удаления растворенного кислорода.
По завершении вакуумирования при работающем насосе с помощью узкого пламени кислородной горелки отпаивают ампулы по перешейку.
Описана методика, позволяющая подготовить для проведения кислотного или щелочного гидролиза за 1 ч 12 образцов в вакуумном эксикаторе [302].
Условия гидролиза. Ампулу помещают в термостат с циркулирующим воздухом, прогретым до 110 °С; точный температурный контроль процесса очень важен [266]. Удобно использовать для этих целей термостат газожидкостного хроматографа.
По окончании гидролиза (т. е. через 24, 48 или 72 ч) ампулу осторожно центрифугируют. Затем с помощью напильника (или стеклореза) на верхней части ампулы делают насечку и прикосновением раскаленной стеклянной трубки к смоченной водой насечке отламывают верхний конец и оплавляют острый край. Невскрытые ампулы хранят при —20 °С.
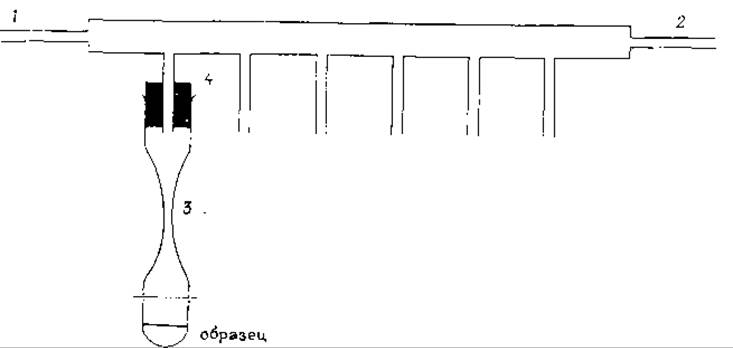
РИС. 8.1. Приспособление для вакуумирования ампул для гидролиза белков. Стальной трубопровод (наружный диаметр 20 мм) имеет шесть боковых отростков с отверстиями (длина 65 мм и наружный диаметр 6 мм). 1 и 2 — места трехходовых кранов. Ампулы для гидролиза имеют узкую шейку 3 и присоединяются с помощью пробки из силиконовой резины 4.
Для быстрого удаления соляной кислоты используют поток азота, роторный испаритель или скоростной вакуумный концентратор. Если гидролизу подвергалось много образцов, то можно их лиофилизовать. Для этого закрывают ампулы пленкой типа парафильм, делают в ней небольшие отверстия, замораживают в бане (ацетон — твердая углекислота) и помещают в вакуумный эксикатор над твердым NaOH или КОН (КОН в форме чешуек). Лиофилизуют на масляном насосе, снабженном ловушкой со щелочью, обычно в течение ночи. В условиях такого достаточно медленного удаления HCl, хотя этот способ общепринят, происходит дальнейшее разрушение остатков серина и треонина, что приводит к артефактным пикам на хроматограммах аминокислот [266].
Описана методика быстрого удаления соляной кислоты из большого числа гидролизатов белков без вспенивания, основанная на использовании центрифуги [195]. (См. разд. 8.5).
Перед нанесением аликвоты раствора на колонку анализатора рекомендуется профильтровать гидролизат через мембрану Millipore (0,45 мкм).
8.6.1.2. Методика быстрого гидролиза. Быстрый гидролиз свободных и присоединенных к носителям пептидов проводится в следующих условиях [397]: смесь пропионовая кислота — 12 М HCl (1 : 1), вакуум, 160 °С, 15 мин. Для количественного определения серина в образце температуру гидролиза снимают на 10 °С.
8.6.1.3. Гидролиз в незапаянных ампулах. В некоторых случаях, если в лаборатории нет кислородных горелок, гидролиз белка проводят в сосудах, снабженных краном для вакуумирования [89]. Реакционные пробирки этого типа выпускаются фирмой Pierce.
Гидролиз может быть проведен в атмосфере азота. Взвешивают белок или упаривают раствор непосредственно в небольшом сосуде с завинчивающейся крышкой с тефлоновым вкладышем. Добавляют 100—150 мкл 6 М НСl, продувают азотом и немедленно закрывают сосуд, обработка ультразвуком на этой стадии способствует удалению растворенного воздуха [193]. Гидролиз, проводят в алюминиевом блоке при 155 °С в течение 20 мин. Этого времени обычно бывает достаточно для достижения результатов, аналогичных полученным в классических условиях (110 °С, 22 ч), но гидролиз может быть и более продолжительным [142].
Результаты аминокислотного анализ рибонуклеазы после быстрого (145±2°С, 4 ч) и обычного (110°±1 °С, 24 ч) гидролизов были идентичными. Авторы подчеркивают, однако, что для получения достоверных данных предварительно должны быть построены графики зависимости выходов аминокислот от времени гидролиза [193, 317].