Практическая химия белка - А. Дарбре 1989
Традиционная стратегия определения структуры белков
Введение
Г. УИНТЕР (G. WINTER, MRC Laboratory of Molecular Biology, Hill Road, Cambridge, CB2 2QH, U.K.)
В основе всех современных методов определения аминокислотной последовательности пептидов лежит реакция Эдмана [19, 21].
На первой стадии этой реакции происходит присоединение фенилизотиоцианата (ФИТЦ) к а-аминогруппе пептида, затем от фенилтиокарбамилыюго (ФТК) производного под действием безводной кислоты отщепляется N-концевой остаток в виде 5'-гиазолинона и образуется укороченный пептид, содержащий в качестве Х-концевой последующую аминокислоту (рис. 10.1). Избыток реагентов и побочных продуктов на промежуточных стадиях удаляется экстракцией органическими растворителями. Повторение этого процесса с одновременной идентификацией образующегося из тиазолинона фенилтиогидантоина (ФТГ) отщепляемой аминокислоты или Х-концевого остатка укороченного пептида позволяет устанавливать аминокислотную последовательность исходного соединения.
Длина определяемой таким образом последовательности ограничена по причине постепенного уменьшения выходов продуктов на стадиях присоединения, расщепления и экстракции, возможного блокирования вновь образованного N-концевого остатка, протекания побочных реакций расщепления по остаткам аргинина и гистидина [58, 61] или по другим аминокислотным остаткам полипептидной цепи [39], а также по ряду других причин. Так, ФТК-производные пептидов в присутствии следов кислорода в реакционной среде десульфируются [33] и не расщепляются далее при обработке кислотой. Пептиды с N-концевыми остатками глутамина [4], триптофана [75] и различных производных цистеина [53, 68, 76] могут образовывать циклические продукты, что, как и возможная перегруппировка в случае последовательности Asn-Gly [20, 35, 72], а также О→N- ацильная миграция у остатков ацилсерина и ацилтреонина [20, 34, 69], приводит к блокированию процесса расщепления. Дополнительные осложнения возникают в случае трудно растворимых гидрофобных пептидов, которые не полностью вступают в реакцию конденсации и способны переходить в органическую фазу при экстракциях.
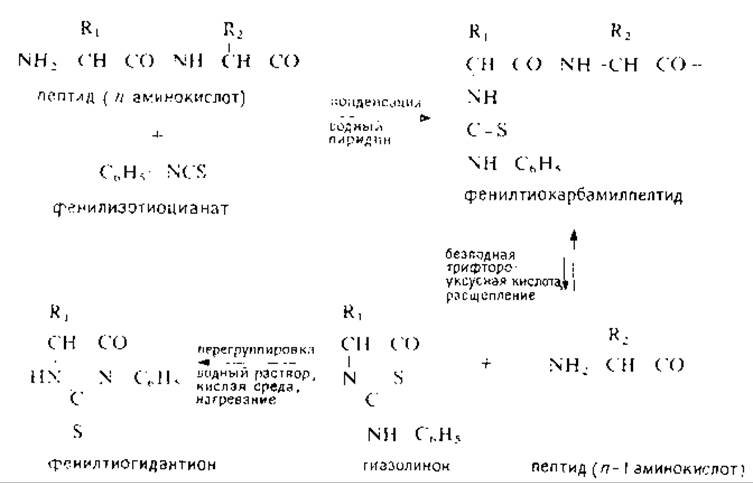
РИС. 10.1. Схема 1.
Выходы на стадиях классического («ручного») метода Эдмана обычно ниже, чем при использовании автоматических приборов, главным образом вследствие невозможности полного исключения кислорода из реакционной среды и менее эффективных промывок водной фазы. Поскольку реакция расщепления трифтороуксусной кислотой обратима [21] (рис. 10.1), присутствие тиазолиионов, неполностью экстрагированных па предыдущих стадиях, ингибирует процесс расщепления ФТК-пептида. В методике Хартли [26] в отличие от собственно метода Эдмана и его варианта с ДАБИТЦ- и ФИТЦ-реагентами [9] (гл. 14) часть пептида отбирается для дансилирования и последующей идентификации N-концевой аминокислоты (гл. 11), что ведет к дополнительному снижению постадийных выходов. По мере увеличения числа отщепленных аминокислот возрастает уровень фоновых «шумов», что затрудняет достоверное определение аминокислоты. Обычно этими методами удается устанавливать относительно короткие последовательности, содержащие до 15 остатков. Таким образом, совершенно очевидно, что расщепление па короткие пептиды — необходимая ступень структурного анализа белка при классическом подходе; оно осуществляется обычно с помощью ферментов и химических реагентов (в последнем случае образуются более крупные фрагменты).