Практическая химия белка - А. Дарбре 1989
Традиционная стратегия определения структуры белков
Выбор стратегии исследования
На рис. 10.2 представлена стратегическая схема анализа структуры белка в одно- и двухстадийном вариантах. Исходный образец белка должен быть очищен до гомогенного состояния (не менее 95% степени чистоты); липиды, углеводы и кофакторы должны быть удалены.
Выбор протеолитических ферментов для первоначальной фрагментации (в одностадийном варианте) определяется молекулярной массой и аминокислотным составом белка, поскольку эти данные позволяют предсказать среднестатистический размер пептидов, образующихся при гидролизе (например, трипсином по остаткам лизина и аргинина). Обычно используют наиболее специфичные ферменты — трипсин, химотрипсин, стафилококковую протеазу, протеазу из A. mellea (табл. ГОЛ). Для того чтобы избежать трудностей, связанных с разделением гидролизата крупного белка, содержащего значительное число (>40) пептидов, применяют блокирование некоторых потенциальных точек расщепления полипептидной цепи или используют двухстадийную схему анализа. Так, расщепление трипсином по остаткам лизина может быть предотвращено путем модификации последних малеиновым ангидридом [8]. После проведения триптического гидролиза модифицированные фрагменты перед их разделением (ионообменной хроматографией или электрофорезом) деблокируют обработкой кислотой. Соответственно пептидные связи, образованные остатками аргинина, могут быть защищены от действия трипсина предварительной обработкой белка циклогександионом в присутствии бората [48]. Необходимым условием успешного применения этого подхода является достижение полноты модификации и последующего удаления защитных групп. Техника блокирования в соединении с методами диагонального электрофореза [8, 48, 49] используется для селективного выделения триптических пептидов, содержащих внутренние остатки лизина или аргинина. Альтернативным вариантом для первичной фрагментации полипептидной цепи только по остаткам аргинина или лизина служит применение специфических ферментов — клострипаина [43] и протеазы из A. mellea [65] соответственно.
В двухстадийной схеме анализа для получения крупных фрагментов белка используют либо химические методы расщепления (табл. 10.2) по таким сравнительно редко встречающимся в полипептидной цепи аминокислотам, как триптофан, метионин, цистеин, либо ограниченный протеолиз нативного белка [36, 40, 51, 52]. Повторная фрагментация каждого из образовавшихся крупных пептидов приводит к образованию значительно меньшего числа компонентов, чем в случае целой молекулы белка, что значительно упрощает дальнейшее фракционирование. Однако достижение полного и специфического расщепления белка химическим реагентом, успешное осуществление разделения крупных фрагментов и, наконец, нахождение порядка их расположения в цепи в свою очередь может вызывать заметные затруднения. Например, бромоциан расщепляет пептидную цепь по остаткам метионина с превращением их в остатки гомосерина, при этом окисленная форма метионина — метионинсульфоксид устойчива к действию реагента, а связи Met-Ser и Mel-Thr расщепляются лишь частично. В условиях кислотного гидролиза лабильных связей Asp-Pro триптофан подвергается окислительной деструкции и частично разрушаются амиды дикарбоновых аминокислот. Получаемые химическими методами крупные денатурированные полипептиды часто плохо растворимы и не элюируются с ионообменных колонок. Многообразие заряженных форм каждого пептида, возникающее в результате частичного деамидирования или образования смесей пептидов с С-концевыми остатками гомосерина и гомосеринлактона, усложняет их разделение по зарядам. Для реконструкции полипептидной цепи из бромоциановых фрагментов необходимо выделение всех метионинсодержащих пептидов из другого гидролизата исходного белка.
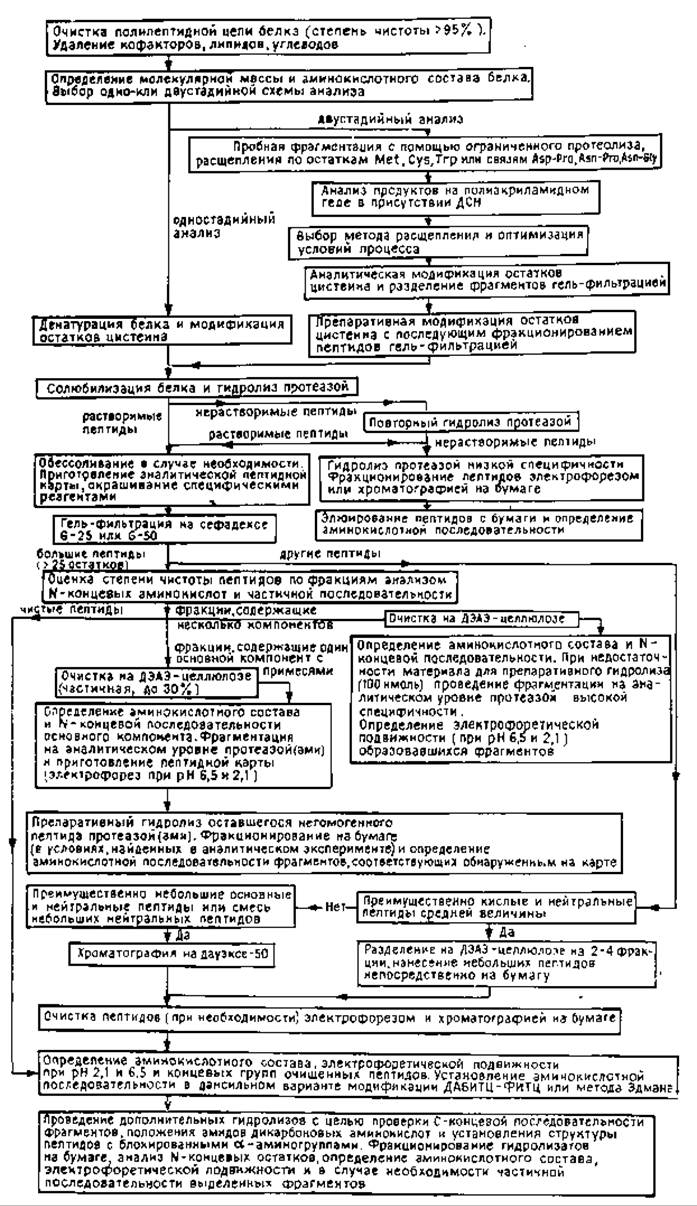
РИС. 10.2. Стратегия определения аминокислотной последовательности (неавтоматическими методами).
Таблица 10.1. Специфичность действия протеаз
|
Фермент |
Остатки X, по которым в основном проявляется действие протеазы |
Примечания |
|
Трипсин |
Остатки основных аминокислот: по С-концу Lys, Arg и аминоэтил-Cys [67] |
Гидролиз не проходит по связям Х-Pro; менее эффективен, если перед или после X находится кислый остаток; более селективен к Arg в щелочной области pH [22]; протекает в 2 М мочевине |
|
Химотрипсин |
Остатки ароматических аминокислот: по С-концу Trp, Tyr, Phe, Leu [67] |
Гидролиз не проходит по связям Х-Pro и окисленному Тrр; менее эффективен, если перед пли после X находится кислый остаток; протекает в 2 М мочевине |
|
Эластаза |
Остатки алифатических аминокислот: Ala, Val, Glу, Ser [27] |
При условии частичного расщепления точки гидролиза непредсказуемы; гидролиз проходит в 2 М мочевине |
|
Стафилококковая протеаза |
Остатки кислых аминокислот: по С-концу Glu и Asp [15, 16, 32] |
Могут быть подобраны условия гидролиза только по Glu или по Glu и Asp; гидролиз проходит также по карбоксиметил-Cys; менее эффективен, если за X стоит остаток с разветвленной боковой цепью пли если X находится в окружении кислых аминокислот; протекает в 4 М мочевине [15] |
|
Термолизин |
N-конец Ile, Leu, Val, Phe [29, 41, 42] |
Гидролиз не проходит по связям Х-Рrо; протекает при 60—80 С, что может способствовать растворению пептида |
|
Пепсин |
Остатки ароматических аминокислот: по N-концу Trp, Tyr, Phе, Leu [67] |
Расщепляет также мной te другие связи; кислые условия гидролиза могут способствовать растворению пептида |
|
Протеаза из Аrmiliaria mellea |
По N-концу Lys и аминоэтил-Cys [65] |
Гидролизует также по другим остаткам, например N-концу Arg, Phe, Trp (G. Winter, неопубликованные данные) и С-концу Arg [13] |
Таблица 10.2. Химические методы расщепления, применяемые в двустадийной схеме анализа
|
Реагент |
Основная специфичность |
Частичное расщепление |
Побочные расщепления |
|
Бромоциан [23] |
По Met с образованием С-концевых остатков гомосерина и гомосеринлактова; последний устойчив к действию карбоксипептидаз |
Не расщепляется связь Met-оксид; частично расщепляются связи Met-Ser, Mеt-Thr [62], Met-(Cys-Cys) [14] и Met-Glu [10] |
Кислотное расщепление по связям Asp-Pro и Asn-Pro [50] и окислительное расщепление по Тrр [3] |
|
2-Нитро-5-тиоцианобензойная кислота с последующим щелочным расщеплением [11] |
По Cys с образованием N-концевого 4-карбоксиминотиазолидина, блокирующего реакцию Эдмана и действие аминопептидаз; возможно деблокирование каталитическим восстановлением [57] |
Образование смешанных дисульфидов [54] и ß-элиминирование S-цианопроизводного [70] |
Связи Phe-Thr и Phe-Ser при использовании каталитического восстановления для деблокирования N-концевого остатка [57] |
|
Гидробромид диметилсульфоксида [56] или N-хлорсукцинимид [64] |
По Тrр с образованием С-концевого лактона; Cys и Met окисляются |
||
|
BrCN в муравьиной и гептафторомасляной кислоте [47] |
По Тrр при условии предварительного фотокисления Met |
||
|
Гидроксиламин [5] |
По Asn-Gly |
Степень расщепления зависит от предварительного пребывания пептида в кислых или щелочных условиях [38] |
Связи Asn-Lcu [6] и Asn-Ala [71] |
|
Разбавленная кислота [50] |
По Asp-Pro и Asn-Pro |
Многих из затруднений можно предусмотрительно избежать. Так, до проведения гидролиза остатки метионинсульфоксида могут быть восстановлены до метионина обработкой белка 2-меркаптоэтанолом или дитиотреитом в денатурирующих условиях. Следует иметь в виду, что метионинсульфоксид не обнаруживается в белке аминокислотным анализом, поскольку в условиях кислотного гидролиза восстанавливается до метионина, однако он может быть определен непрямыми методами [63]. Смесь пептидов с С-концевыми остатками гомосерина и гомосеринлактона может быть превращена в любую из этих форм [2, 45].
Для растворения и разделения крупных пептидов могут быть использованы 8 М мочевина с последующей ионообменной хроматографией в этом же растворе [25] или 100%-ная муравьиная кислота с гель-фильтрацией на биогелях в 20—70%-ной муравьиной кислоте [1]. Солюбилизация достигается также модификацией остатков лизина в пептидах цитраконовым ангидридом; фракционирование проводится па колонках с биогелем или сефадексом при нейтральных pH.
На заключительных стадиях анализа может быть осуществлен целенаправленный поиск пептидов, необходимых для соединения крупных фрагментов, так называемых «перекрывающих» пептидов. Например, метионинсодержащие пептиды могут быть селективно выделены с помощью диагонального электрофореза [73]. Наилучший способ идентификации цистеинсодержащих пептидов заключается в предварительном мечении остатков цистеина [14С] иодоуксусной кислотой с последующим целенаправленным выделением радиоактивных фрагментов [78, 79]. Пептиды, содержащие триптофан, обнаруживают в пиках хроматограмм по наибольшему поглощению при A280 и по присущей ему флуоресценции или специфическому окрашиванию при хроматографии на бумаге.
Поскольку гель-фильтрация дает безусловно лучшие выходы при разделении крупных пептидов, чем ионообменная хроматография, оптимальный метод расщепления белка в двухстадийном анализе (рис. 10.2) удобно выбирать па основе результатов аналитического электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДНС). При четком разделении полос в геле целесообразно для препаративного фракционирования пептидов применять гель-фильтрацию. Электрофорез в ПААГ в присутствии ДСН используется также для контроля полноты процесса расщепления белка химическими реагентами.