Практическая химия белка - А. Дарбре 1989
Методы твердофазного анализа аминокислотной последовательности
Синтез смол
Носители на основе стекла
Пористые стеклянные шарики были предложены в качестве носителей для твердофазного анализа в 1973 г. [42, 61, 62].
12.3.2.1. Свойства стекла с контролируемым размером пор (фирма Corning). Стекла марки CPG содержат 96% кремнезема, 3—4% В2O3, 0,5—1% Na2О и следовые количества оксидов некоторых металлов. Выпускаются в виде пористых шариков, как необработанных, так и модифицированных разными химическими методами, что делает стекла пригодными для многих целей.
Скорость разрушения стекла CPG. Шарики очень устойчивы к механическим повреждениям; скорость разрушения этих носителей зависит от температуры, времени, pH, состава и объема раствора, площади поверхности частиц (чем меньше размер пор, тем больше площадь поверхности). Устойчивость стекла заметно снижается во времени в присутствии ТФУ; эти носители чувствительны к фтороводороду.
Преимущества использования пористых стекол для анализа аминокислотной последовательности. Шарики CPG сохраняют постоянный объем в ходе всего цикла отщепления, не подвержены набуханию — сжатию, поэтому в отличие от носителей на основе органических полимеров ими можно заполнять колонки без разбавления другими материалами. Стекла нечувствительны к давлению в колонке, поэтому жидкости можно прокачивать через колонку с высокой скоростью. Они химически устойчивы во всех средах, за исключением сильных оснований, особенно при высоких температурах, поэтому присоединение пептидов к носителям следует проводить при рН<10.
Современная методика использования стекол CPG описана в работе [32]. Белок присоединяют за N-концевую аминокислоту к носителю, частично расщепляют бромоцианом. Смесь пептидов смывают со стекла и анализируют их структуру дансильным методом с двойной радиоактивной меткой. Можно использовать и другие методы расщепления белка.
12.3.2.2. Получение носителей, содержащих аминогруппы. Для получения аминопропилстекла (АПС) и ß-N-аминоэтил-(3-амнопропил) стекла (ß-АПС) пористые шарики (CPG, 10/75, 200—400 меш) обрабатывают 3-аминопропилтриэтоксисиланом (АПТЭС) и ß-аминоэтил-(3-амипопропил)триметоксисиланом (АЭАПТМС) [6, 17, 51, 61]. Такая модификация шариков с поминальным диаметром пор 75 А позволяет получить носители с емкостью связывания пептидов 150—170 нмоль/мг стекла [61]. Схема синтеза приведена на рис. 12.2.
Методика. 4 г шариков (CPG, 10/75, 200—400 меш, фирма Serva) деаэрируют 2 ч при 180 °С в вакууме (водоструйный насос). Добавляют 30 мл сухого толуола и 3 мл АПТЭС (или АЭАПТМС). Деаэрируют и нагревают в закрытой колбе при 75 °С в течение 24 ч с легким перемешиванием (предпочтительно подаютом). Носитель отделяют от раствора на стеклянном фильтре, промывают последовательно толуолом, ацетоном, метанолом (каждым растворителем 2 раза по 50 мл). Сушат в вакууме над Р2О5 при комнатной температуре. Хранят под азотом при 4 °С.
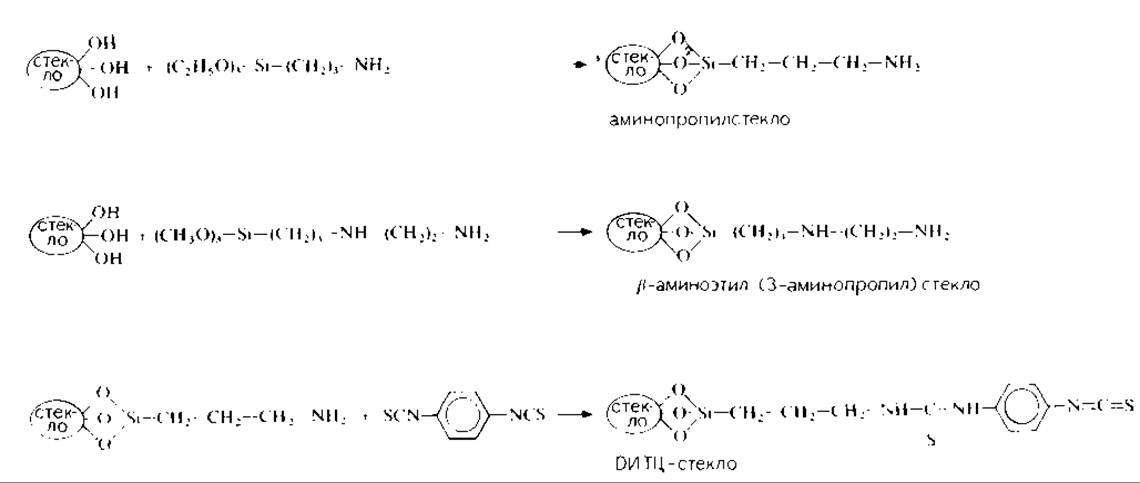
РИС. 12.2. Получение аминопропилстекла (АПС), β-N-аминоэтил-(3-аминопропил)стекла (ß-АПС) и изотиоцианатстекла (ДИТЦ-стекло).
12.3.2.3. Получение изотиоцианатного стекла. Для синтеза изотиоцианатаминопропильного носителя (ИТЦ-АПС), к которому можно присоединять пептиды, содержащие остатки лизина и аминоэтилцистеина, аминогруппы аминопропильного стекла активируют n-фенилендиизотиоцианатом (ДИТЦ) (рис. 12.2)
[43, 61].
Методика. Для проведения реакции рекомендуется использовать 25 моль ДИТЦ на каждую аминогруппу носителя и 2—3 объема ДМФА на объем стекла. 1 г ДИТЦ растворяют в 13 мл ДМФА. При легком перемешивании порциями в течение 1 ч добавляют 2 г аминопропилстекла. Смесь выдерживают при комнатной температуре 2 ч. Шарики промывают на стеклянном фильтре ацетоном и ДМФА (2 раза по 50 мл), метанолом (2 раза по 10 мл). Носитель сушат в вакууме.
Хранят, как АПС.