Практическая химия белка - А. Дарбре 1989
Определение С-концевой последовательности аминокислот
Определение С-концевой последовательности
Расщепление при помощи тиоцианата
Пока не существует методов определения протяженных последовательностей С-концевых аминокислот. Применяемые химические и ферментативные подходы позволяют определить последовательность лишь нескольких остатков. В большинстве случаев для получения информации в основном используются карбоксипептидазы, несмотря на присущие этому методу недостатки: разные скорости отщепления различных аминокислот и трудности соблюдения тщательно контролируемых условий последовательного отщепления. Вопросы, связанные с использованием карбоксипептидаз, обсуждаются в разд. 18.4.4.
Среди всех химических подходов этот метод является наиболее исследованным [83]. Позднее он был модифицирован с целью улучшения условий проведения реакций в растворе [18, 48, 84, 97] и на твердой фазе [71, 94]. Однако каждый из предложенных вариантов позволял определять последовательность лишь нескольких С-концевых аминокислот.
Пептид (белок) выдерживают с тиоацетатом аммония в растворе уксусной кислоты и уксусного ангидрида для образования пептидилизотиоцианата, который спонтанно перегруппировывается в пептидилтиогидантоин (рис. 18.9). Последний избирательно расщепляют кислотой или щелочью; при этом получаются тиогидантоин С-концевой аминокислоты и укороченный пептид (белок) с новым С-концевым остатком.
В основу этого метода определения С-концевой последовательности положены результаты работы [41] по превращению ациламинокислот в тиогидантоины при помощи тиоцианата аммония и уксусного ангидрида. Позднее [76] к этой реакции добавилась стадия отщепления (1 М едкий натр, 3 ч, комнатная температура), что позволило перейти к повторяющемуся образованию и отщеплению тиогидантоинов аминокислот, т. е. к анализу С-концевой последовательности полипептидов. Последняя методика с ограниченным успехом применялась для определения концевых групп ряда пептидов и белков [29]. Пересмотр условий образования и отщепления тиогидантоинов привел к появлению методики определения аминокислотной последовательности пептидов в более мягких условиях [83]. По такой же схеме можно определять и С-концевую последовательность белков [18]. Однако при указанных условиях не отщепляются Asp и Pro (Asp образует циклический ангидрид, не реагирующий с тиоцианатом аммония); это ограничение можно обойти, модифицируя обе карбоксильные группы Asp карбодиимидом [35] и снимая ферментативно защитную группу с а-карбоксила [44]).
Другие модификации включают использование ТФУ и ацетилхлорида вместо уксусного ангидрида [48], для того чтобы реакция проходила главным образом через образование смешанного ангидрида, а не оксазолинона [98]. Кроме того, предполагалось использовать в реакции не тиоцианаты, а саму тиоциановую кислоту [48]. В этих условиях удалось провести успешное определение аминокислотной последовательности пептидов, в том числе имевших С-концевой Pro. Проведение реакции с добавлением трифтороуксусного ангидрида [96] позволило определить 14 аминокислот папаина и 10 аминокислот рибонуклеази [97].
При проведении процесса в растворе для отделения избытка реагентов от пептидилтиогидантоина и тиогидантоина от укороченного пептида обычно используют хроматографию на сефадексе. Эти разделения и лиофилизация фракций с колонки отнимают много времени. Твердофазный анализ исключает многие из этих проблем, но неудачный выбор (или предварительный синтез) активированного носителя и сложности присоединения пептида к носителю резко снижают шансы на успех определения. Ниже приводится детальное описание методик.
18.4.1.1. Расщепление пептидов тиоцианатом. Образование пептидилтиогидантоинов. Методика 1 [83]. Растворяют пептид в 0,5 мл 50%-ной уксусной кислоты. К раствору пептида при перемешивании медленно добавляют свежий раствор тиоцианата аммония (100 мг), уксусного ангидрида (4,0 мл) и ледяной уксусной кислоты (1,0 мл). Нагревают при 50°С в течение 6 ч, добавляют при перемешивании еще 100 мг тиоцианата аммония, нагревают реакционную массу при 50 °С еще 18 ч. Затем добавляют воду (3,0 мл) оставляют раствор стоять в течение нескольких минут для гидролиза избытка уксусного ангидрида.
Методика 2 [87]. Пептид обрабатывают 1,0 мл ацетилирующей смеси: уксусная кислота — уксусный ангидрид — пиридин (2-10:1) при 50 °С в течение 30 мин, затем добавляют 1,0 мл раствора тиоцианата аммония
в уксусной кислоте (20 мг/мл), нагревают реакционную массу при 50 °С при интенсивном перемешивании в течение 30 мин.
Методика 3 [48]. Растворяют пептид в смеси ТФУ (10 мкл) и ацетилхлорида (200 мкл), инкубируют реакционную смесь при 30 °С в течение 15 мин. Добавляют раствор 3%-ной роданистоводородной кислоты в диоксине (200 мкл) и выдерживают реакционную смесь при 30 °С еще 60 мин. После образования пептидилтиогидантоина растворитель можно удалить в вакууме.
Выделение пептидилтиогидантоина.
Методика 1 [831. Пептидилтиогидантоин отделяют от избытка реагентов обессоливанием на колонке с сефадексом G-25 (20X500 мм) в 50%-ной уксусной кислоте. Собирают фракции по 5 мл, детектируя пептидилтиогидантоин по УФ-поглощению; нужные фракции объединяют.
Методика 2 [87]. Выделение проводят без хроматографического разделения. Отщепление проводят прямо в реакционной смеси после упаривания ее досуха.
Расщепление пептидилтиогидантоинов.
Методика 1 [83]. Объединяют фракции, содержащие пептидилтиогидантоин; растворитель упаривают в вакууме. Сухой остаток растворяют в 0,5 мл 0,1 М ацетогидроксамовой кислоты в 50%-ном пиридине. Нагревают раствор при 50 °С в течение 2 ч, упаривают досуха. Сухой остаток растворяют в 3 мл 50%-ной уксусной кислоты, отщепленный тиогидантоин С-концевой аминокислоты отделяют от укороченного пептида хроматографией на колонке с сефадексом G-25 (20x500 мм).
Методика 2 [87]. Раствор без разделения упаривают досуха. Остаток растворяют в воде (3 мл), отщепляют тиогидантоин, для чего в реакционную смесь добавляют 2 г катионита (дауэкс 50 WX8) и перемешивают при 50 °С в течение 30 мин.
Методика 3 [48]. Отщепляют тиогидантоин 0,5 М триэтиламином.
18.4.1.2. Расщепление белков при помощи тиоцианата. Поскольку белки плохо растворимы в смеси уксусная кислота — уксусный ангидрид, было предложено использовать тригидрат гексафтороацетона [18] и трифтороуксусный ангидрид [96].
Образование тиогидантоина белка.
Методика 1 [18]. Белок (0,015—1,0 мкм) растворяют в смеси тригидрата гексафтороацетона (1,0 мл) и воды (0,35 мл). По каплям при перемешивании добавляют свежеприготовленный прозрачный раствор тиоцианата аммония (100 мг) в смеси тригидрата гексафтороацетона (1,0 мл) и уксусного ангидрида (4,5 мл).
Смесь нагревают при 50 °С в течение 2 ч, затем добавляют еще 100 мг тиоцианата аммония и нагревают еще 18 ч. Для разрушения избытка уксусного ангидрида добавляют воду (3,0 мл). Тиогидантоин белка отделяют от побочных продуктов на сефадeксе G-25.
Расщепление тиогидантоина белка.
Методика 1 [181. Объединяют фракции элюата, содержащие тиогидантоин белка; растворитель удаляют в вакууме. Остаток растворяют в 1,0 мл 12 М НСl и оставляют при комнатной температуре на 30, мин. Соляную кислоту удаляют путем быстрого упаривания в вакууме. Остаток растворяют в 50%-ной уксусной кислоте, отщепленный тиогидантоин отделяют от укороченного белка гель-фильтрацией, как описано выше. Растворитель немедленно упаривают, добавляют небольшой объем метанола и без промедления (так как тиогидантоины неустойчивы на свету и на воздухе) идентифицируют тиогидантоин методом ТСХ.
18.4.1.3. Идентификация тиогидантоинов. После отщепления тиогидантоинов от небольших пептидов можно проводить аминокислотный анализ укороченного пептида и определять С-концевую аминокислоту по разности аминокислотного состава пептидов до и после отщепления. Для белков следует проводить прямую идентификацию отщепленных тиогидантоинов, например при помощи ТСХ на силикагельных пластинках, пропитанных флуоресцирующим индикатором. Хроматографию проводят либо в системе гептан-н-бутанол" 99%-ная муравьиная кислота (95:65:30), либо в системе хлороформ — 95%-ный этанол — ледяная уксусная кислота (100:50:15) [18, 83, 84].
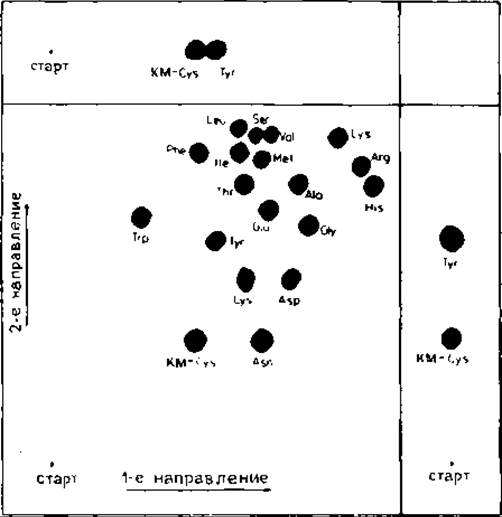
РИС. 18.10. Двумерная ТСХ тиогидантоинов аминокислот на полиамиде (пластинки 100Х100 мм). Хроматография в первом направлении: ледяная уксусная кислота — вода (7:13); во втором направлении: смесь хлороформ — 95%-ный этанол — ледяная уксусная кислота (20:20:3), содержащая флуоресцентный индикатор 2,5-бис(5-трет-бутил-бензоксазолил-2)тиофeн (0,025%). При УФ-освещении (254 нм) тиогидантоины проявляются в виде темных пятен на флуоресцирующем бледно-голубом фоне ("70].
Более эффективна двумерная ТСХ на полиамидных пластинках (100Х100 мм) в среде уксусная кислота — вода (7:13) в первом направлении и хлороформ - 95%-ный этанол — ледяная уксусная кислота (20:10:3), содержащая 0,025% 2,5-бис (5-трет-бутилбензоксазолил-2)тиофен, во втором направлении [70]. При УФ-облучении (254 нм) тиогидантоины аминокислот проявляются в виде темных пятен на бледно-голубом флуоресцирующем фоне (рис. 18.10).
Тиогидантоины аминокислот можно идентифицировать методом ГЖХ после их триметилсилилирования [23, 72], методом масс-спектрометрии [19, 72, 86, 87], а также после гидролиза тиогидантоинов до свободных аминокислот методами ионообменной хроматографии [84] и ГЖХ [70].