Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку триптофана
Другие реагенты
Расщепление по триптофану можно проводить с помощью окислительного галогенирования «активным иодом», который генерируется в системе пероксид водорода — соли иодоводородной кислоты — лактопероксидаза (или пероксидаза хрена). Простые пептиды, содержащие остаток триптофана, расщепляются при pH 5 в течение 10 мин с выходом 30—40%. Для проведения реакции необходимо присутствие всех компонентов указанной системы. С аналогичным выходом идет расщепление по триптофану с помощью других иодирующих агентов, таких, как І2, І3-, ІСl и хлороамин Т/Kl [1]. Вопрос о возможности применения галогенирования в присутствии пeроксидазы с целью расщепления белков остается открытым, однако метод заслуживает внимания.
2.5.6.1. Расщепление по триптофану под действием N-хлоросукцинимида. Пептидные связи по карбоксильной группе триптофана избирательно расщепляются в кислой среде под действием N-хлоросукцинимида; остальные пептидные связи при этом не затрагиваются. Опыты на модельных соединениях показали, что как выход, так и скорость реакции здесь несколько меньше, чем в случае N-бромосукцинимида. Однако реакция идет очень избирательно и никаких признаков расщепления по тирозину и гистидину не наблюдается. Пептидные связи триптофана в селактальбумине, ингибиторе трипсина (ингибитор Куница), миоглобине и глюкагоне расщепляются под действием N-хлоросукцинимида в водной уксусной кислоте с выходом 19—58% [172]. В некоторых работах [115] рекомендуют вводить в состав реакционной смеси мочевину (далее приводится именно эта методика).
Методика. Концентрация белка в реакционной смеси составляет 0,286 ммоль/л, молярное отношение белок: N-хлоросукцинимид варьирует в зависимости от объекта исследования. Рабочий буфер содержит 27,5%-ную уксусную кислоту и 4,68 М мочевину. Реакцию проводят при 20 °С в течение 30 мин и прерывают путем добавления N-ацетил-L-метионина [172]. Согласно типовой методике, образец белка растворяют в дистиллированной воде (1 нмоль/мл) и смешивают (в объемном соотношении 4:10) с раствором N-хлоросукцинимида в буфере (1 мл ледяной уксусной кислоты + 1 г мочевины + 1 мл воды).
В образцах цитохрома с из различных источников расщепление по триптофану проходит с выходом ~50%.
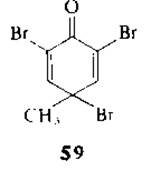
2.5.6.2. Расщепление с помощью трибромокрезола [137]. Избирательное расщепление белков и пептидов по пептидным связям триптофана проводят с помощью 2,4,6-трибромо-4-метилциклогексадиенона (трибромокрезола)
(59). Пептидные связи тирозина и гистидина, которые обычно расщепляются под действием бромирующих реагентов, таких, как N-бромосукцинимид, в этих условиях не затрагиваются. Однако тирозин превращается в 3,5-дибромопроизводное, цистеин окисляется в цистеиновую кислоту, метионин — в метиопин-S-оксид, идет модификация остатка гистидина. Оптимальными условиями расщепления по триптофану являются следующие: 3 экв. трибромокрезола, pH 3, 20°С, 5—15 мин. В случае лизоцима селективное расщепление идет с выходом 5—60%. Принято считать, что реакция идет по механизму окислительного галогенирования, как и в случае N-бромосукцинимида.
Методика. К раствору глюкагона (0,5 мкмоль) в 2 мл 70%-ной уксусной кислоты прибавляют 25 мкмоль трибромокрезола в 50 мкл диоксана. Инкубируют при перемешивании в течение 15 мин, а затем хроматографируют в 0,1 М уксусной кислоте на колонке с сефадексом G-25.