Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку триптофана
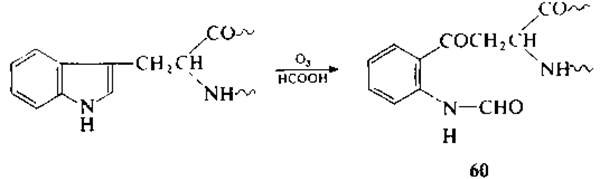
Озонирование
При озонировании пептидов в безводной муравьиной кислоте остаток триптофана превращается в N-формилкинуренин (60) [125, 141, 142, 195, 196]. При последующей кислотной обработке в мягких условиях идет отщепление N-формильной группы. При непродолжительном (до 4 ч) нагревании пептидов с модифицированным остатком триптофана (в виде кинуренина или N-формилкинуренина) в бикарбонатном буфере с выходом 49—59 % идет избирательный гидролиз пептидной связи. Принято считать, что активация пептидной связи обусловлена внутримолекулярным каталитическим эффектом у-кетогруппы N-формилкинуренина [143].
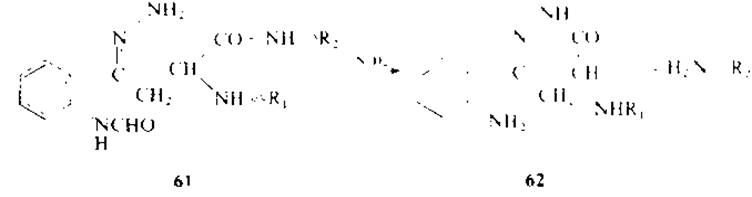
При инкубации пептидов, содержащих N-формилкинурепин, в 0,2 М гидразин-ацетатном буфере (pH 3,6) при 100 °С в течение 2 ч образуются гидразоны (61), которые затем циклизуются в тетрагидропиридазоны (62) с одновременным расщеплением пептидной связи. Выход составляет 35—68%, однако при действии гидразина наблюдается неспецифическое расщепление [125—127]. При восстановлении кинуренинпептидов с помощью NaBH4 [144] или электролитическим способом [63] кинуренин превращается в у-(о-аминофенил) гомосерин (63) с последующим расщеплением С- и N-пептидных связей остатков триптофана с выходом 20—40%.
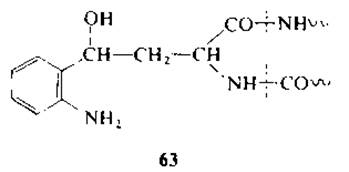
Расщепление С-пептидной связи триптофана путем озонолиза не применяется в химии белка из-за низкого выхода, окисления цистеина (в цистеиновую кислоту), метионина (в метионин-S,S-диоксид) и отчасти тирозина.