Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Введение
Р. К. МАРШЕЛЛ, А. С. ИНГЛИС (R. С. MARSHALL, A. S. INGLIS, Division of Protein Chemistry, CSIRO, 343 Royal Parade, Parkville, 3052 Victoria, Australia)
В настоящей главе главным образом обсуждаются применяемые на практике методы определения состава белковых олигомеров, способы идентификации и разделения мономеров, а также методы выделения отдельных полипептидных цепей. Как известно, молекула олигомерного белка построена из нековалентно связанных мономеров (субъединиц), которые в свою очередь могут включать несколько полипептидных цепей, соединенных дисульфидными мостиками (или другим типом ковалентной связи). Например, тетрамер, составленный из двух пар различных мономеров, один из которых содержит две полипептидные цепи, можно схематически представить следующим образом:
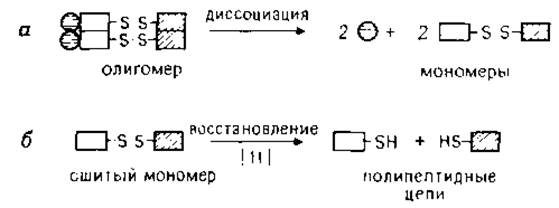
Описанные в главе методы могут быть использованы для оценки стехиометрического состава олигомеров. В свою очередь данные об относительном количестве мономеров в олигомере, их молекулярной массе и свойствах дают полезную предварительную информацию о третичной и четвертичной структурах олигомера. Однако рассмотрение закономерностей (и симметрии) структурной организации сложных олигомеров не входит в задачу данной главы [131]. Дополнительную информацию читатель может найти в специальных обзорах, посвященных четвертичной структуре белков [93], белок-белковым взаимодействиям [62], методам определения субъединичной структуры [173].
Поскольку методы идентификации мономеров и отдельных фрагментов олигомеров входят как составная часть в структурный анализ олигомеров, вполне возможно, что излагаемый здесь материал может частично дублироваться в других главах. Описанные в главе методы эксперимента рекомендованы читателю на основании личного опыта авторов и их коллег с учетом того, что для их осуществления требуются небольшие материальные затраты, а также того, что методики хорошо воспроизводятся. Сложным в техническом отношении методам, таким, например, как масс-спектрометрия, ультрацентрифугирование и рентгеноструктурный анализ, посвящены гл. 19 и 20. Дополнительную информацию можно найти также в специальных обзорах [4, 88, 93, 177].
Методы выделения и идентификации мономеров дают информацию о молекулярной массе олигомера и его субъединиц, их количестве и свойствах, позволяют получать препараты для определения первичной структуры. Если удается получить белок в виде кристаллов, изучение первичной структуры удобно вести параллельно с помощью секвенирования и физических методов (например, рентгеноструктурного анализа), поскольку сопоставление получаемой информации существенно ускоряет ход анализа [158]. Однако такая возможность представляется редко. Часто именно получение достаточно чистых препаратов белка или субъединиц, пригодных для проведения аминокислотного анализа, и составляет одну из главных проблем, поскольку исследуемый белок может присутствовать лишь в незначительных количествах в сложной смеси сопутствующих белков и продуктов их деградации или же исходная смесь может содержать белки с очень близкими свойствами. Если белок плохо растворим и требует более жестких условий для солюбилизации, гетерогенные препараты могут быть получены уже па начальном этапе выделения. Причиной появления гетерогенности может быть, по-видимому, изменение суммарного заряда из-за дезамидирования амидных групп аспарагина и глутамина, карбамилирование ε-аминогрупп некоторых остатков лизина ионом цианата, присутствующим в растворах мочевины [38], неспецифическая модификация остатков метионина и гистидина при алкилировании цистеина.
Причиной гетерогенности по молекулярной массе может быть расщепление лабильных пептидных связей, например неустойчивой в кислой среде, в частности в 80%-ной муравьиной кислоте, связи Asp-Pro [100]. Признаком такого гидролиза может послужить обнаружение N-концевого остатка пролина. Важным условием получения гомогенного белка является отсутствие в препарате примесей протеаз, поскольку в следовых количествах они вызывают ограниченный протеолиз по отдельным пептидным связям [91].
Относительно легко может осуществляться блокирование а-аминогруппы N-концевого аминокислотного остатка, что делает невозможным секвенирование. Наиболее частыми причинами такой блокировки являются циклизация N-концевого остатка глутамина, карбамилирование а-аминогрупп в растворах мочевины, а также присутствие в реагентах следов альдегидов [54].
Указанных осложнений можно избежать, если тщательно соблюдать условия проведения реакций и придерживаться рекомендованных методик проведения экспериментов.