Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Методы идентификации олигомеров
Электрофорез в градиенте ПААГ
Молекулярную массу интактного олигомера определяют в неденатурирующих условиях с помощью методов ультрацентрифугирования, гель-фильтрации и электрофореза в градиенте полиакриламидного геля (ПААГ). Устойчивость и растворимость большинства олигомерных белков зависит от ионной силы и pH буферного раствора. В отличие от электрофореза в ПААГ, где на состав буферных растворов накладываются определенные ограничения, в частности ионная сила не должна превышать 0,1, гель-фильтрацию можно вести в буферных растворах, cтабилизирующих олигомер (например, в присутствии ионов металлов или кофакторов). Для определения молекулярной массы белков применяют классический вариант гель-фильтрации на сшитых декстранах, полиакриламиде или агарозе. В последнее время получены гели нового типа, позволяющие вести процесс при повышенном давлении, благодаря чему время анализа сокращается с 1—2 сут до 30 мин (гл. 6).
Сущность метода состоит в том, что под действием электрического поля белковые зоны мигрируют в полиакриламидном геле с уменьшающимися размерами пор до некоторого конечного положения, обусловленного сопротивлением среды. Таким образом, расстояние, пройденное зоной белка, связано с молекулярной массой, которую можно определить путем сравнения с поведением белков-маркеров.
Хотя белки с небольшим суммарным зарядом имеют низкую электрофоретическую подвижность, конечное положение зон практически не зависит от величины заряда при условии, что все исследуемые белки имеют заряд одного знака, а pH буфера заметно отличается от их изоэлектрических точек.
1.2.1.1. Описание метода. Известно множество вариантов прибора для электрофореза в вертикальных или горизонтальных пластинах (блоках) полиакриламидного геля [24, 73, 142, 170]. Источник питания должен обеспечивать стабилизацию по напряжению и по току, наличие термостата в таких приборах необязательно.
В качестве пористой среды используются в основном полиакриламидные гели, полностью заменившие ранее применявшийся крахмал. Гель различной пористости (градиентный гель) готовят, варьируя соотношение и концентрацию мономеров — акриламида CH2=CHCONH2 и бифункционального N,N'-метиленбисакриламида CH2=CHCONHCH2NHCOCH = CH2, выполняющего функцию сшивающего агента (разд. 1.3.1.1). Следует помнить, что акриламид — нейротоксичный яд. Некоторые исследователи полагают, что наилучшие результаты можно получить только при использовании мономеров, дополнительно очищенных путем перекристаллизации [35]. Однако вполне удовлетворительные результаты получаются при применении обычных коммерческих реактивов. Остальные реагенты должны иметь квалификацию «ч. д. а.».
Линейный градиент концентрации создают с помощью двух сообщающихся сосудов цилиндрической формы и перистальтического насоса или же с помощью градиентного смесителя иного, более сложного типа [113]. При недостатке опыта готовить градиентные гели высокого качества и с хорошей воспроизводимостью бывает затруднительно, в таких случаях можно воспользоваться готовыми пластинами (фирмы Gradipore, LKB, Pharmacia).
Белки с молярной массой 13 000—100 000 фракционируют в гелях с градиентом концентрации 4—30%, для белков с молярной массой 200 000—1 000 000 используют гель с градиентом 4—- 16%. Гель вначале уравновешивают рабочим буферным раствором. Для этого проводят предварительный электрофорез при 150 В в течение 1 ч.
Проведение электрофореза. Для приготовления запасного электродного буфера (трис — ЭДТА — борная кислота) растворяют в дистиллированной воде 121 г триса, 15,6 г ЭДТА (динатриевой соли) и 9,2 г борной кислоты, объем раствора доводят до 1 л. Перед употреблением запасной раствор разбавляют дистиллированной водой (1:10).
Образец белка растворяют или диализируют против разбавленного электродного буфера, содержащего бромофеноловый синий (0,1% масс./об.) и глицерин (10% масс./об.). В лунки с помощью микропипетки или микрошприца вносят 2—5 мкл раствора образца (с концентрацией 0,5 мкг/мкл). Электрофорез проводят при 150 В в течение 7—16 ч. Гель калибруют с помощью белков-маркеров [93]. Наборы стандартных белков, поставляемых фирмой Pharmacia, представляют собой лиофильно высушенную смесь тироглобулина (М 669 000), ферритина (М 440 000), каталазы (М 232 000), лактатдегидрогеназы (М 140 000) и альбумина (М 67000).
Окрашивание красителем кумасси ярко-голубой. По завершении электрофореза белковые зоны локализуют путем окрашивания красителем кумасси ярко-голубой, обозначаемый в литературе как CBB G 250. Для окрашивания гелей используют 0,15%-ный (масс./об.) раствор СВВ G 250 в смеси метанол.— ледяная уксусная кислота — вода (50:10:40). Для приготовления раствора красителя его вначале растворяют в метаноле, затем добавляют уксусную кислоту и воду, после чего раствор фильтруют. Для обесцвечивания геля, пластину выдерживают в течение 12 ч в смеси метанол — ледяная уксусная кислота — вода (5:7,5:87,5).
Обработку геля ведут в фотографической кювете, накрытой крышкой с целью уменьшить испарение метанола. Время от времени (примерно каждый час) кювету покачивают. Раствор красителя (его можно использовать до 20 раз) сливают в склянку с притертой пробкой и в кювету заливают раствор для обесцвечивания. Если раствор для отмывки не содержит поглощающих краситель материалов (отрезок шерстяной ткани размером 100x100 мм, губчатая резина, гранулы ионита), то раствор заменяют на свежий 2—3 раза в течение 24 ч. Хранят гель в 10%-ной уксусной кислоте. Разработан электрофоретический способ отмывки красителя, однако иногда такая отмывка сопровождается обесцвечиванием белковых зон.
Окрашивание растворами солей серебра. Наиболее чувствительный метод обнаружения белковых зон заключается в пропитывании геля раствором нитрата серебра; затем гель обрабатывают восстановителем и раствором соды. При этом комплексы полипептид — серебро обнаруживаются в виде черных полос. Проявления солями серебра можно проводить после окрашивания красителем кумасси, который предварительно отмывают смесью метанол — уксусная кислота [138]. Наборы реактивов для окрашивания гелей солями серебра выпускаются компаниями Upjohn (гелькод) и Bio-Rad. Оба набора повышают чувствительность обнаружения с помощью кумаси в 250 и 50 раз соответственно. Гелькод позволяет обнаруживать белки при содержании 5—10 нг [154]. Как оттенок, так и интенсивность окрашивания солями серебра зависят от свойства анализируемого белка. Это свойство можно использовать для контроля за выделением исследуемого белка из сложной смеси. (Относительно методов обнаружения в геле см. разд. 8.19.) Поскольку метод обладает высокой чувствительностью, необходимо очень тщательно отмывать стеклянные пластинки (разд. 8.2). Если гель неплотно прилегает к стеклу (из-за жировых пятен), возможно затекание образца в образующийся зазор.
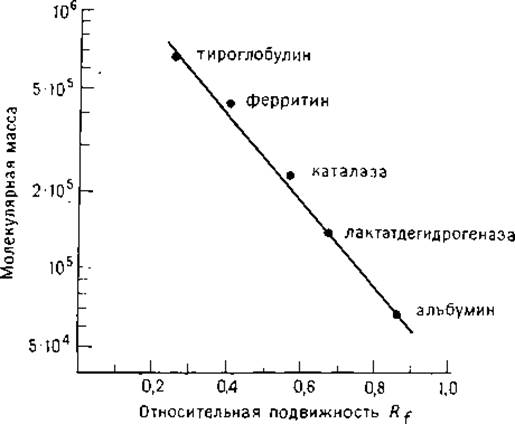
РИС. 1.1. Градуировочный график для градиентного (4—30%) ПААГ, построенный с использованием в качестве белков-маркеров тироглобулина, ферритина, каталазы, лактатдегидрогеназы и бычьего сывороточного альбумина [101].
Фотографирование полученных электрофореграмм. После прокрашивания готовые электрофореграммы фотографируют на цветную или высококонтрастную черно-белую негативную или позитивную пленку (Agfa Copek или Kodak Recordak). Обычно съемку ведут с желтым фильтром № 16, зоны слабой интенсивности снимают с оранжевым фильтром № 2, интенсивные зоны можно снимать без фильтра, экспозиция составляет 1—6 с. Пленку проявляют соответствующим проявителем, например Agfa Rodinal (при разведении 1:25, 20°С, 3,5 мин). Свойства фотобумаги для получения отпечатков зависят от качества электрофореграммы и полученного негатива.
1.2.1.2. Анализ полученных результатов. При построении градуировочного графика на оси абсцисс откладывают длину пробега (в миллиметрах) или относительную подвижность Rf белковых зон, а на оси ординат — молекулярную массу белков-маркеров (рис. 1.1). Относительная подвижность Rf определяется к пробегу красителя или белка-маркера. Молекулярную массу исследуемого белка находят по градуировочному графику, используя экспериментальные значения Rf. Во избежание ошибок из-за вариабельности свойств геля рекомендуется проводить электрофорез исследуемого белка и стандартной смеси на одной пластине. Ошибка определения молекулярной массы по градуировочному графику достигает 25% [98]. Большие отклонения наблюдаются в том случае, если олигомер в процессе электрофореза распадается на мономеры или если белок не обладает глобулярной структурой, как, например, фибриноген — фибриллярный белок, имеющий больший по сравнению с глобулярными белками равной молекулярной массы гидродинамический объем.