Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Методы идентификации олигомеров
Гель-фильтрация
При гель-фильтрации разделение белков происходит главным образом по размерам белковой глобулы [6, 59]. В настоящей главе рассматривается хроматография на открытых колонках, хотя сегодня в связи с созданием новых колонок, приборов, методов набивки более важным методом является высокоэффективная жидкостная хроматография (ВЭЖХ; см. гл. 6). Вместе с тем принципы разделения на открытых и закрытых колонках полностью идентичны.
Гель-фильтрацию проводят на колонках, заполненных частицами набухшего геля, имеющими поры определенного диаметра. Общий объем столбика геля обозначают Vt. Общий объем можно найти расчетным путем по форме колонки или же экспериментально по объему заполняющей ее воды. В процессе элюирования крупные молекулы, не проникающие в гранулы геля, перемещаются с высокой скоростью вместе с растворителем, находящимся между гранулами, и элюируются в виде узкой зоны. Объем элюента, соответствующий появлению этой зоны, обозначают v0 (свободный объем). Менее крупные молекулы проходят через колонку не так быстро, так как они проникают в гранулы геля и их выход с колонки занимает продолжительное время. Поскольку степень диффузии в гранулы геля зависит от размеров молекул, вещества элюируются с колонки в порядке уменьшения их молекулярной массы. Молекулярная масса М исследуемого белка определяется путем сравнения объема элюирования Ve с аналогичным параметром для белков-маркеров. Этому вопросу посвящены исчерпывающие обзоры [1, 59] и проспекты фирмы Pharmacia [134].
1.2.2.1. Методики. Для получения удовлетворительных результатов необходимо использовать хроматографические колонки соответствующих размеров и подходящей конструкции. Такие колонки выпускаются фирмой Pharmacia (Швеция). Аналитические эксперименты проводят в колонках диаметром —15 мм, препаративные — в колонках диаметром 25—50 мм. Длина колонок составляет 500—1000 мм; если позволяет жесткость гранул геля используются колонки и большей длины. Кроме того, необходимы также фракционный коллектор, перистальтический насос и проточный денситометр.
Для хроматографических экспериментов подбирают гель с такими свойствами, чтобы зона исследуемого белка приходилась на середину профиля элюирования. Пористый носитель готовят на основе декстрана, акриламида и/или агарозы (с различной степенью сшивки), позволяющих разделять вещества с разными молекулярными массами. Агарозные гели (сефароза, биогель А) используют для фракционирования крупных белков с молекулярной массой вплоть до нескольких миллионов. Пулем соответствующей обработки агарозы получают сефарозу Cl (поперечно-сшитую), которая обладает достаточной жесткостью и допускает высокие скорости элюирования. Белки с молекулярной массой <1 000 000 фракционируют на сефадексе, биогеле Р или ультрагеле (фирма LKB). Снижение степени сшивки уменьшает жесткость геля и допустимую скорость элюирования, но увеличивает предел исключения по молекулярной массе. Более прочный гель (сефакрил), позволяющий проводить элюирование при более высоких скоростях (5—10-кратных), получают сшивкой аллилдекстрана N,N'-метиленбисакриламидом [89, 123].
Для получения наилучших результатов рекомендуется следовать стандартным методикам [134]. Высушенные гранулы геля выдерживают (или автоклавируют) в рабочем буфере в течение трех суток. Гели, поставляемые в виде суспензий, например сефакрил, промывают рабочим буфером и готовят суспензию в этом буфере. В колонку наливают немного буферного раствора, а затем осторожно по стенке переносят деаэрированную суспензию гранул геля. На пористую пластинку в нижней части колонки можно предварительно поместить небольшой слой жесткого геля сефадекса G-25, что позволит исключить забивание пластинки обломками гранул при работе на мягких гелях. Если объем суспензии превышает объем колонки Vt, то колонку наращивают. При набивке колонки скорость потока жидкости (буфера) может быть несколько выше, чем при последующем фракционировании, однако скорость потока и гидростатическое давление не должны превышать величин, рекомендованных фирмами-изготовителями. После формирования столбика геля через колонку пропускают не менее двух объемов рабочего буферного раствора. При использовании длинных колонок поток элюента рекомендуется подавать снизу вверх. С этой целью колонки снабжают специальными приспособлениями (фирмы Pharmacia, LKB, Wright).
Обычно используют буферные растворы с pH 6:8 и ионной силой >0,1 (например, 0,1 М трис-НСl — 0,1 М NaCl, pH 8,0); иногда в зависимости от свойств исследуемого белка приходится изменять параметры буфера, например увеличить ионную силу с тем, чтобы воспрепятствовать агрегации олигомеров. Однако в случае сефарозы эффективность разделения зависит от концентрации солей и pH [104]. Хроматографию на сефакриле рекомендуется вести при ионной силе >0,5 или при pH 5,5, поскольку этот гель проявляет слабые ионообменные свойства [191.
Постоянную скорость элюирования задают с помощью перистальтического насоса. Элюат, собираемый на фракционном коллекторе, анализируют в потоке или выборочно по фракциям па содержание белка, для чего обычно регистрируют изменение оптической плотности при 280 нм. Другие методы детектирования используют при отсутствии в белке хромофоров (остатков триптофана и тирозина), при работе на микроуровне или при слишком высоком поглощении при 280 нм, например благодаря присутствию кофактора. В этих случаях можно определять оптическую плотность при 220 нм, интенсивность флуоресценции или радиоактивность (при работе с мечеными белками) [14, 161]; наконец, при анализе белковых фракций можно использовать химическую модификацию (разд. 1.4.5.1). Например, определенные объемы (аликвотные части) отдельных фракций можно подвергнуть щелочному гидролизу и последующему анализу по реакции с нингидрином. Для обнаружения белков можно использовать реакцию Лоури или реакцию связывания красителя. Последний метод вполне можно рекомендовать как наиболее простой и чувствительный, причем этому определению не мешает присутствие химических реагентов. Кроме того, состав фракций можно определять с помощью электрофореза в полиакриламидном геле.
Свободный объем V0 обычно определяют по объему элюирования голубого декстрана 2000 (фирма Pharmacia), суспензии вируса табачной мозаики, ферритина или других объектов с высокой молекулярной массой, не проникающих в гранулы геля. Теоретически V0 составляет 35% полного объема столбика геля Vt. Получение хорошо образованной (неразмытой) зоны синего декстрана служит критерием качества набивки колонки. В качестве маркера готовят раствор голубого декстрана (1 мг/мл) или белка (5—20 мг/мл) в буферном растворе, содержащем 10% (масс./об) сахарозы (плотность образца должна быть выше плотности элюирующего буфера). Образец маркера аккуратно наносят на колонку с помощью шприца или крана с дозирующей петлей. С целью уменьшить сорбцию голубого декстрана на сефадексе и сефарозе рабочий буфер должен иметь pH >5, а при работе на сефакриле — рН≥7. Объем образца не должен превышать 1—2% общего объема геля Vt. По завершении эксперимента определяют объем элюирования Ve исследуемого белка (по максимуму поглощения на графике оптическая плотность — объем элюирования). В случае превышения рекомендованного оптимального объема образца на кривой элюирования формируется плато, что затрудняет определение истинного значения Ve. Объем элюирования Ve можно найти по скорости элюирования, которую либо измеряют непосредственно в потоке или находят косвенным методом, измеряя количество элюата, собранного в единицу времени. Поскольку Ve пропорционален времени элюирования, в основу расчетов может быть положено время выхода с колонки исследуемого белка.
1.2.2.2. Анализ полученных результатов. При определении молекулярных масс методом гель-фильтрации для конкретной хроматографической колонки предварительно строят градуировочный график. На оси абсцисс откладывают объем элюирования или связанные с ним параметры, а на оси ординат молекулярную массу (в логарифмической шкале) известных белков. Наборы белков-маркеров фирмы Pharmacia включают рибонуклеазу (М 13 700), химотрипсиноген А (М 25 000), овальбумин (М 43 000), альбумин (М 67 000) или альдолазу (М 158 000), каталазу (М 232 000), ферритин (М 440 000), тироглобулин (М 669 000). Часто в расчетах используют величину Vc, однако более удобен коэффициент распределения Кav между жидкой фазой и фазой геля, поскольку этот параметр не зависит от объема колонки:
![]()
На рис. 1.2 приведен градуировочный график в координатах lgМ—Kavдля сефадекса G-200. Удобно также использовать график lg(100∙Kav) от N2/3 (где N — число аминокислотных остатков в белках-маркерах), который имеет линейную форму. При градуировке колонки рекомендуется использовать такие белки-маркеры, которые обеспечивают хорошее разрешение и определение Kav С высокой точностью.
Параметры большинства белков вписываются в градуировочный график. Отклонения возможны в тех случаях, когда олигомер склонен к агрегации или диссоциации на мономеры или же не относится к глобулярным белкам [12]. Белки не должны сорбироваться в гранулах геля и порождать тем самым ложные зоны (пики), принимаемые за низкомолекулярные примеси. Известно, что белки с высоким содержанием ароматических аминокислот или олигосахаридных цепей сорбируются на сефадексе. Потери белка на колонке по причине выпадения в осадок или сорбции можно оценить, сопоставляя суммарное содержание белка (по поглощению при 280 нм) в элюате и исходном образце, нанесенном на колонку.
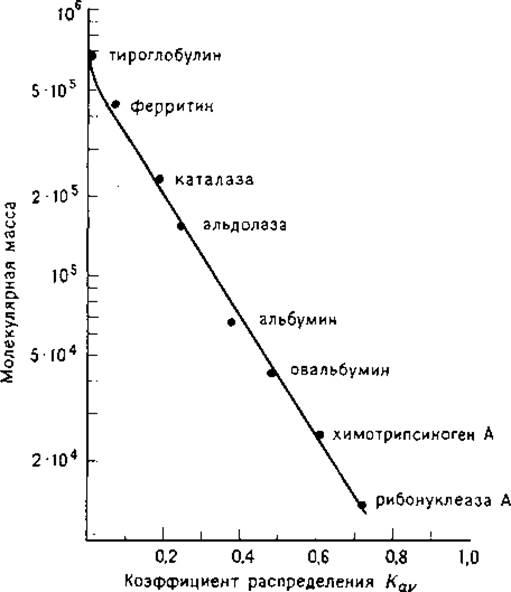
РИС. 1.2. Градуировочный график для сефадекса G-200, построенный с использованием белков-маркеров фирмы Pharmacia (из методического руководства фирмы).