Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Другие методы химического расщепления пептидных связей
Расщепление по остатку дегидроаланина
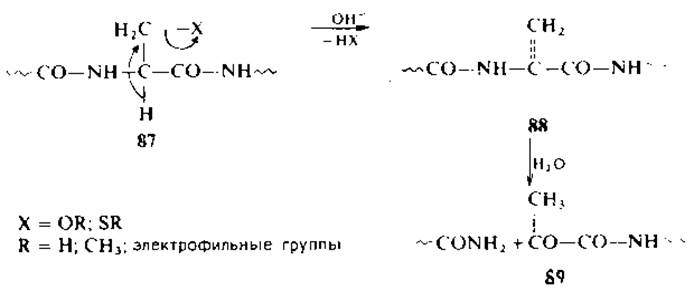
Некоторые производные серина и цистеина (87) в пептидах легко вступают в реакцию ß-элиминирования с последующим расщеплением пептидной связи по а-углеродному атому дегидроалапилпептидов (88).
У производных серина, несущих сильные электроноакцепторные группы по гидроксилу, такие, например, как О-тозильная [138] или О-дифснилфосфорная группы [149], процесс ß-эли- минирования индуцируется в основной среде. Например, химотрипсин путем тозилирования по остатку серина активного центра с помощью тозилфторида и последующей обработки основаниями превращается в дегидрохимотрипсин [184, 201].
Цистеин превращается в дегидроаланин при S-нитроарилировании остатка цистеина динитрофторобензолом и последующей обработке 0,1 М щелочью [178]. S-Метилсульфоний превращается в дегидроаланин при более низких pH (8,5—9) по сравнению с S-динитрофенилпроизводными [179].
При обработке пептидов щелочью остаток дегидроаланина (91) образуется непосредственно из цистина (90). Расщепление дисульфидной группы инициируется благодаря атаке гидроксил-ионом протона при а-углеродном атоме с образованием остатка S-тиоцистеина (92), который затем превращается в цистеин и свободную серу [189].
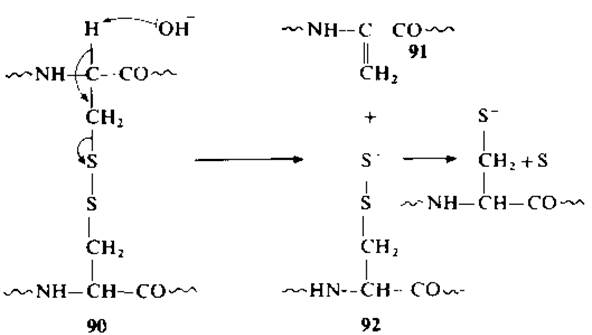
Расщепление связи С—S может проходить по обеим сторонам дисульфидного мостика, следовательно, при щелочной обработке цистинсодержащих пептидов образуется сложная смесь дегидроаланинсодержащих производных. Дегидроаланилпептиды расщепляют с помощью гидролиза или окисления [178]. В надмуравьиной кислоте идет окисление дегидроаланина в а,β-дигидроксиаланин, который затем гидролизуется при pH 10 до пептида с амидной группой и фрагмента, несущего на N-конце остаток гидроксипировиноградной кислоты. Расщепление проводят также путем бромирования в водной уксусной кислоте с образованием в качестве промежуточного продукта лабильного а,β-дибромоаланина. В присутствии брома идет расщепление пептидных связей остатков триптофана, тирозина и гистидина [181].
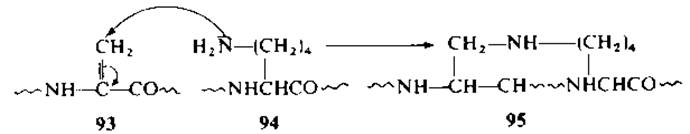
Вместе с тем методу расщепления пептидной связи через промежуточное образование дегидроаланина свойственны существенные недостатки. Остаток дугидроаланина (93) может вступать в реакцию с нуклеофилами, например с е-аминогруппой остатка лизина (94) с образованием DL-a-аминоф-β-(ε-N-L-лизин)пропионовой кислоты (лизиноаланина) (95) [12]. В щелочной среде в присутствии пероксида водорода может идти окисление боковых групп ряда аминокислот, что приводит к глубокой модификации пептидов. Обработка щелочью может сопровождаться побочными реакциями, например транспептидацией, гидролизом амидных групп, а также неспецифическим расщеплением пептидных связей.