Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Другие методы химического расщепления пептидных связей
Другие методы расщепления пептидных связей
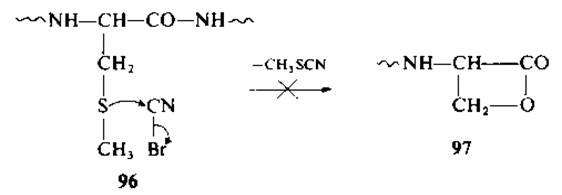
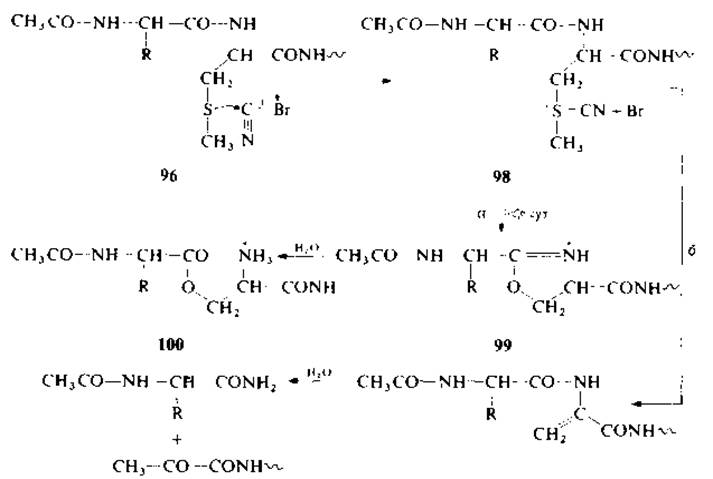
Низший аналог метионина — S-метилцистеин (96) — не вступает в реакцию с бромоцианом с последующим расщеплением пептидной связи по карбоксильной группе. В отличие от реакции с метионином в этом случае не образуется соответствующий ß-лактон (97). В том случае, если аминогруппа S-метил- цистеина ацилирована или аминоацилирована (98), реакция идет с образованием оксазолиний бромида (99) и метилтиоцианата [70]. При низкой температуре соединение 99 легко гидролизуется в О-ацилпроизводное (О-серилпептид) (100) (по механизму а). Наконец, указанный эфир гидролизуется далее с образованием ожидаемых фрагментов. При высокой температуре идет реакция ß-элиминирования с образованием пептида с дегидроаланином (по механизму б). Реакция с успехом применялась в отношении некоторых S-метилцистеинсодержащих пептидов.
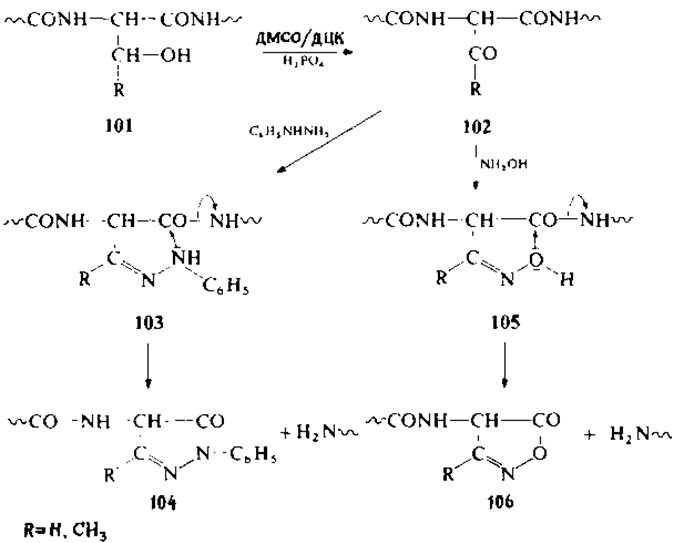
Известен метод расщепления пептидных связей серина и треонина (101), основанный на предварительном окислении гидроксильной группы дициклогексилкарбодиимидом в присутствии фосфорной кислоты в диметилсульфоксиде (102) и последующей реакции с фенилгидразином при 20°С в течение нескольких часов или при 40—70 °С в течение 20—40 мин. В ходе реакции промежуточный фенилгидразон (103) циклизуется в пиразолон (104) с одновременным отщеплением фрагмента со свободной N-концевой аминогруппой. Возможен и другой вариант, когда при действии гидроксиламина образуется промежуточный гидразон (105), который затем циклизуется в изооксазолинон (106) с образованием фрагмента со свободной аминогруппой [36, 37]. В опытах на модельных пептидах получен достаточно удовлетворительный выход продуктов реакции, однако по всей вероятности метод неприемлем для структурного анализа белков. Недавно опубликованы данные о расщеплении белков по остатку аспарагиновой кислоты под действием разбавленной НС1 (pH 2) или разбавленной муравьиной кислоты при 108°С в течение 2 ч. В этих условиях расщепляются большинство пептидных связей по аспарагиновой кислоте. Одновременно наблюдалось частичное деамидирование аспарагина в инсулине и дезацетилирование N-концевого глицина в цитохроме с.