Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, требующие притока энергии
Биологическая роль и закономерности биосинтеза антибиотиков
Механизмы действия антибиотиков на клеточные мишени
Ингибиторы синтеза клеточной стенки. Таким действием обладают ß-лактамные антибиотики, к числу которых относятся пенициллины, цефалоспорины, нокардицин А, сульфазецин, тиенамицин и др. Все перечисленные соединения имеют в своем составе ß-лактамное кольцо (рис. 18.1). Мишенью этих антибиотиков является бактериальный фермент гликопептидтранспептидаза, который катализирует формирование поперечных сшивок в молекуле муреина. ß-Лактамные антибиотики имеют структурное сходство с фрагментом субстрата этого фермента (-D-Аla-D-Аla-OH) и связываются в активном центре транспептидазы таким образом, что ß-лактамное кольцо оказывается в непосредственной близости от остатка серина. Гидроксильная группа серина участвует в формировании устойчивой ковалентной связи с атомом углерода нестабильного ß- лактамного кольца (рис. 18.1). В результате образуется неактивная ацилированная форма транспептидазы, которая не способна катализировать реакцию транспептидирования (глава 14). Такое ингибирование фермента является необратимым, а действие антибиотиков носит бактерицидный характер: дефектная клеточная стенка не обладает должным запасом прочности и при увеличении клетки в процессе роста или осмотического поступления в нее воды разрушается.
Кроме ß-лактамных антибиотиков, нарушение процесса синтеза клеточных стенок бактерий вызывает полипептидный антибиотик бацитрацин А. Показано, что молекула бацитрацина может связывать в тройной комплекс с ионами двухвалентных металлов молекулу фосфорилированного липидного переносчика. В результате не происходит дефосфорилирование липидного переносчика, т. е. регенерация его свободной формы. В таком случае не могут осуществиться все стадии синтеза муреина, в которых задействован липидный переносчик, и не формируется клеточная стенка (бактерицидный эффект).
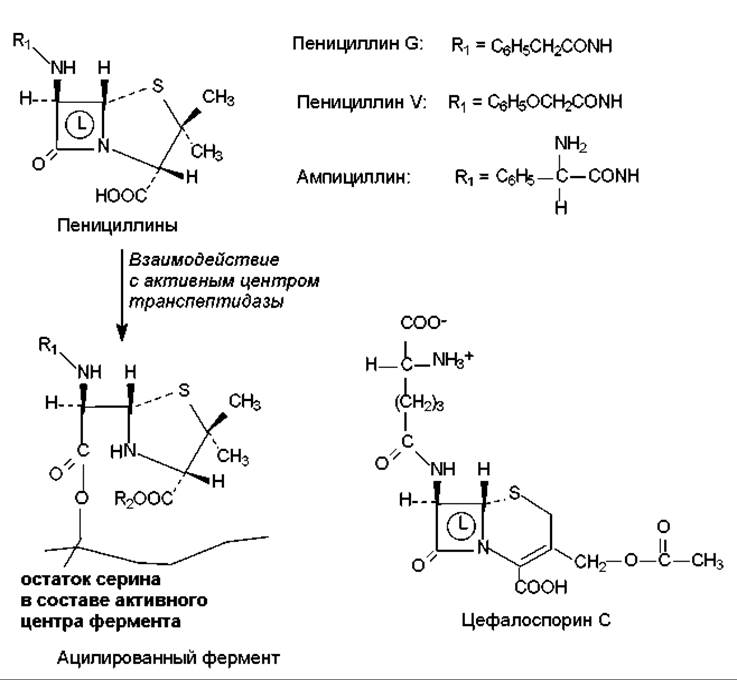
Рис. 18.1. Структура и механизм действия некоторых ß-лактамных антибиотиков: L — ß-лактамное кольцо
Следует добавить, что перечисленные антибиотики наиболее активны против грамположительных бактерий, поскольку именно их клеточные стенки содержат большое количество муреина. Для эукариот эти антибиотики малотоксичны, что объясняется отсутствием в их клетках основной мишени — ферментов и других компонентов синтеза муреина.
Антибиотик циклосерин — производное аминокислоты серин подавляет активность двух ферментов, участвующих в синтезе муреина: аланинрацемазы и D-аланил-D-аланинсинтетазы. Он активен против широкого круга бактерий, малотоксичен, но у людей может вызывать расстройства нервной системы.
Мембрано-активные антибиотики. Мишенью этих антибиотиков является, в первую очередь, плазматическая мембрана бактерий. Полимиксины (группа пептидных антибиотиков с циклолинейной структурой) способны связываться с фосфатными группами кардиолипина, фосфатидилэтаноламина и других кислых липидов, входящих в структуру липидного бислоя мембран. При этом наблюдается нарушение проницаемости мембраны — очень серьезное повреждение, влияющее на весь клеточный метаболизм (в первую очередь, происходит «потеря» ионов, создающих градиент на мембране). Кроме этого, полимиксины активируют фосфолипазы наружной мембраны грамотрицательных бактерий, что приводит к разрушению липидного бислоя. Эти нарушения носят бактерицидный характер, а действие полимиксинов направлено, в первую очередь, против грамотрицательных бактерий, обладающих дополнительной (наружной) мембраной.
Похожим образом действуют на мембраны полиеновые антибиотики (амфотерицин В, нистатин, леворин, трихомицин). Их молекулы содержат сопряженную систему двойных связей, а мишенью действия является мембрана. Полиеновые антибиотики связываются со стеролами особой структуры, которые преобладают в мембранах грибов. В результате в мембранах образуются крупные поры, приводящие к нарушению проницаемости.
Нарушают проницаемость мембран также антибиотики-ионофоры, описанные в главе 4.
Ингибиторы трансляции. К этой группе относится значительное количество антибиотиков (рис. 18.2), среди которых наибольшее распространение имеют тетрациклины, аминогликозидные антибиотики (стрептомицин, канамицины, неомицины, гентамицины), хлорамфеникол, макролидные антибиотики (эритромицины, олеандомицин, лейкомицины, тилозин). Особенностью этих веществ является способность связываться с рибосомами, блокируя синтез белка. Следует отметить, что большинство перечисленных антибиотиков характеризуется избирательностью связывания именно с субъединицами (или их составными частями) 70S-рибосом, присутствующими в клетках прокариот. Поэтому данные антибиотики специфичны по отношению к прокариотам. Их действие носит в основном обратимый характер, и поэтому они обусловливают чаще бактериостатический эффект.
Связываясь с рибосомами, ингибиторы трансляции либо препятствуют взаимодействию с рибосомами аминоацилтранспортных РНК (тетрациклины), либо ингибируют инициацию трансляции (стрептомицин), либо ингибируют активность пептидилтрансферазы — структурной части 50S-субъединицы рибосомы (хлорамфеникол), либо нарушают процесс транслокации рибосомы (эритромицин) и т. п.
Антибиотик пуромицин имеет структурное сходство с концевым фрагментом акцепторной ветви аминоацил-тРНК, но он значительно меньших размеров. Благодаря этому пуромицин способен быстро связываться с А-участком рибосом (70S и 80S), однако после присоединения к аминогруппе пуромицина пептидного остатка (пептидилтрансферазная реакция) весь комплекс отщепляется от рибосомы из-за отсутствия кодон-антикодонового взаимодействия. Пуромицин обладает высокой токсичностью по отношению к эукариотическим клеткам, поскольку не имеет избирательности связывания с 70S-рибосомами. Этот антибиотик активен против бактерий, простейших, гельминтов, а также некоторых злокачественных опухолей.
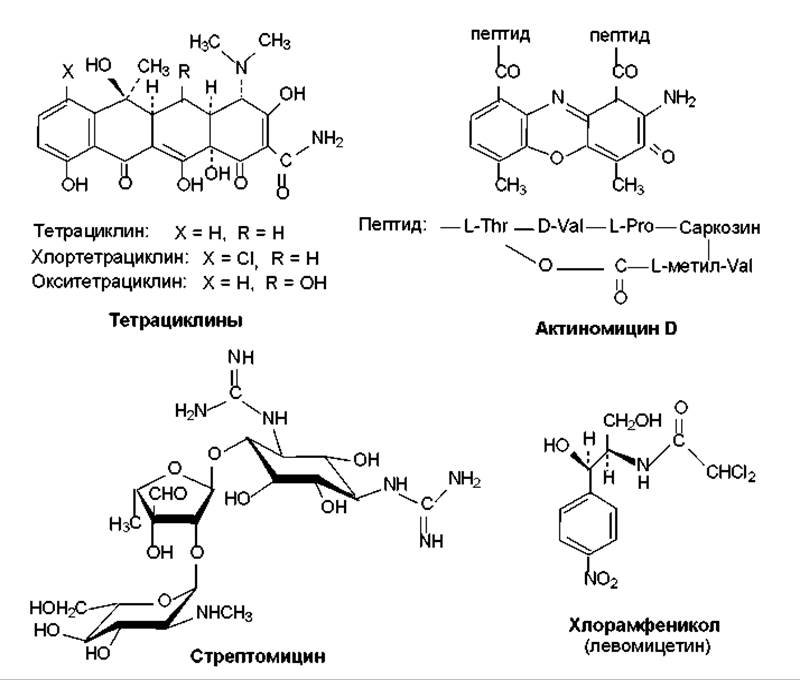
Рис. 18.2. Структура тетрациклинов, актиномицина D, стрептомицина, хлорамфеникола
Антибиотики-интеркаляторы. Действие этих антибиотиков основано на способности встраиваться (интеркалировать) в молекулы ДНК. Таким действием обладает, например, актиномицин D (рис. 18.2), адриамицин, дауномицин. Молекула актиномицина, в частности, встраивается своей плоской гетероциклической частью между параллельными плоскостями пар оснований ДНК. Подобным образом ведет себя дауномицин, две молекулы которого интеркалируют своими гетероциклическими ядрами между плоскостями пар оснований G/C. При таком воздействии локально нарушается структура ДНК, что приводит к ингибированию процессов репликации и транскрипции.
Поскольку структура ДНК отличается высокой консервативностью, антибиотики-интеркаляторы активны и в отношении ДНК эукариот, что делает их высокотоксичными. Эти антибиотики находят применение при химиотерапии злокачественных опухолей, клетки которых, как известно, делятся быстрее нормальных, а значит, и матричные процессы, на которые воздействуют названные антибиотики, в них более активны.
ДНК-тропные антибиотики. Эти антибиотики взаимодействуют с молекулами ДНК, приводя к их разрушению. Классическим примером служат митомицины (А, В, С), а также порфиромицин. Действие названных антибиотиков осуществляется двумя путями: во-первых, модификацией пуриновых оснований, во-вторых, формированием поперечных сшивок между антипараллельными цепями ДНК. Как результат, происходит подавление процесса репликации, возникают ошибки репликации, а также происходят разрывы молекулы ДНК. Еще один тип антибиотиков — блеомицины вызывают многочисленные одно- и двухнитевые разрывы в молекулах ДНК.
Большинство ДНК-тропных антибиотиков высокотоксичны и используются в качестве противоопухолевых препаратов.
Ингибиторы транскрипции. Кроме уже названных антибиотиков-интеркаляторов, транскрипцию подавляют рифамицины. Эти антибиотики взаимодействуют с ДНК-зависимыми РНК-полимеразами прокариот, в частности с ß-субъединицей минифермента. Связывание носит нековалентный характер, однако оказывается довольно прочным, из-за чего нарушается процесс синтеза цепей РНК.
Ингибиторы ферментативных процессов. В качестве таких антибиотиков выступают уже рассмотренные выше пенициллины, цефалоспорины, циклосерин, хлорамфеникол и др. Кроме того, следует отметить антимицин, подавляющий процесс транспорта электронов между цитохромами в дыхательной цепи, олигомицин, связывающийся с ферментами, обусловливающими сопряжение окисления субстратов с фосфорилированием, новобиоцин, являющийся ингибитором фермента ДНК-гиразы (принимает участие в репликации), актиноміцині А, ингибирующий активность цитохром С-редуктазы.