БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 9. ЭНЕРГЕТИЧЕСКАЯ ЦЕННОСТЬ ЖИРОВ
Жиры - основной источник энергии для синтеза АТР. Они обеспечивают образование примерно половины энергии, потребляемой сердцем и покоящимися скелетными мышцами. Количество энергии, запасенной организмом в виде нейтральных жиров, хранящихся в жировых клетках, практически ничем не ограничивается, в отличие от ее лимитированных запасов в виде гликогена. Кроме того, жиры - более компактная форма хранения энергии, поскольку они менее окислены и гидратированы по сравнению с гликогеном.
АТР образуется как при окислении жиров, так и при окислении глюкозы. В обоих процессах участвуют цикл лимонной кислоты и электронтранспортная цепь. Сходство этих двух метаболических путей объясняется тем, что как при окислении глюкозы, так и при окислении жиров образуется ацетил-СоА. Кроме того, распад жиров отличает универсальный механизм окисления жирных кислот путем последовательного отщепления от углеводородной цепи двух углеродных атомов в виде ацетил-СоА. При этом образуются NADH и FADH2, которые затем окисляются. Нельзя не подивиться эффективности использования одной и той же биохимической машины для получения энергии из самых разных пищевых веществ. Пути их окисления различаются лишь начальными стадиями, а в цикле лимонной кислоты они сливаются в общий поток.
В первую очередь необходимо обратить внимание на следующие замечания.
1. Прежде чем начнется окисление, жиры должны подвергнуться гидролизу для высвобождения жирных кислот. При этом из триглицеридов образуется также и глицерин, метаболическая судьба которого иная, чем у жирных кислот: он фосфорилируется окисляется в дигидроксиацетонфосфат. Таким образом, при голодании глицериновый остаток триглицеридов может использоваться печенью при глюконеогенезе (см. главу 11).
2. Периферические ткани извлекают жирные кислоты из крови, куда они экскретируются жировыми клетками в ответ на повышение уровня глюкагона. Эти кислоты попадают в клетки также и из хиломикронов и ЛПОНП, атакуемых липопротеинлипазой (см. с. 93).
3. Свободные жирные кислоты разносятся кровью в виде анионов, обратимо связанных с сывороточным альбумином. Они легко проникают в клетки, поэтому их концентрация там находится в прямой зависимости от уровня в крови. По мере того как свободные жирные кислоты поглощаются из крови, их постоянная концентрация поддерживается благодаря диссоциации альбуминовых комплексов.
4. Жирные кислоты расщепляются путем последовательного отщепления двух углеродных атомов в виде ацетил-СоА.
5. В ходе превращения в ацетил-СоА жирные кислоты постоянно находятся в форме ацил-СоА. Поэтому первая стадия их метаболизма, известная как активация жирныхкислот, заключается в синтезе ацил- СоА-производного жирной кислоты.
Механизм образования ацетил-СоА из жирных кислот
Активация жирных кислот путем синтеза их ацил-СоА-производных
Термин активация отражает тот факт, что тиоэфиры жирных кислот являются макроэргическими реакционноспособными соединениями. Реакция активации выглядит следующим образом:
RCOО- + АТР + CoA-SH —> RCO-S-CoA + AMP + РРi
∆G°' = -0,9 кДж • моль-1.
Изменение свободной энергии при этом невелико (из-за высокой энергии тиоэфира), однако действие пирофосфатазы приводит к тому, что суммарный процесс оказывается сильно экзоэргоничным и необратимым (∆G°' = -32,5 кДж • моль-1).
Реакцию активации жирных кислот катализируют три родственных фермента - ацил-СоА-синтетазы жирных кислот, специализирующиеся на кислотах с короткими, средними и длинными цепями.
Транспорт СоА-производных жирных кислот в митохондрии
Жирные кислоты активируются на внешней мембране митохондрий, которую топологически можно отождествить с цитоплазмой, однако их превращение в ацетил-СоА
происходит только в митохондриальном матриксе. Ацильная группа переносится в митохондрии без СоА при помощи специальной транспортной системы и уже внутри митохондрий вновь взаимодействует с СоА-SН с образованием ацил-СоА. В ходе транспорта сохраняется макроэргическая природа ацильного остатка, так что по другую сторону мембраны его не надо повторно активировать. Это возможно потому, что перенос жирнокислотного остатка в митохондрии осуществляет молекула карнитина:
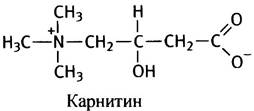
Хотя сложные эфиры обычно не являются макроэргами, структура карнитина такова, что связь ацил-карнитин является макроэргической. Возможно, именно поэтому эволюция остановила свой выбор на карнитине как на ацилтранспортирующем соединении. Ацильные производные карнитина проникают в матрикс, где протекает обратная реакция: ацильный остаток переносится с карнитина на тиольную группу свободного СоА, а карнитин возвращается назад за очередным остатком жирной кислоты.
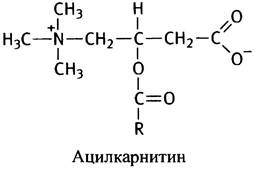
Схема трансмембранного переноса жирных кислот в митохондриях представлена на рис. 9.1. Две реакции переноса ацильных групп - на карнитин и на митохондриальный СоА - катализируют два фермента: первую, протекающую на внешней стороне митохондрии, - карнитин-ацилтрансфераза I, а вторую, имеющую место в матриксе, - карнитин-ацилтрансфераза II. При некоторых генетических дефектах ощущается нехватка карнитина или карнитин-ацилтрансферазы, что приводит к мышечным болям и к ожирению мышц.
Рис. 9.1. Механизм транспорта длинноцепочечных жирно-кислотных остатков в митохондрии: там они окисляются. Перенос ацильных остатков с ацилкарнитина на СоА не требует затрат энергии
Превращение ацил-СоА в ацетил-СоА внутри митохондрии
Этот процесс включает четыре последовательно протекающие реакции, три из которых похожи на уже встречавшиеся нам в цикле лимонной кислоты стадии
превращения сукцината (Сп) в оксалоацетат: дегидрогенизация с помощью FАD-зависимого фермента, гидратация и NАD+-зависимая дегидрогенизация. Вспомните последовательные превращения Сукцинат —> Фумарат —> Малат —> Оксалоацетат в цикле лимонной кислоты. Соответствующие реакции с производными ацил-СAпредставлены на рис. 9.2.
Рис. 9.2. Четыре последовательные реакции, посредством которых укорачивается углеводородная цепь жирнокислотных производных СоА. Цепь укорачивается на два атома углерода, высвобождающихся в виде ацетильной группы ацетил-СоА
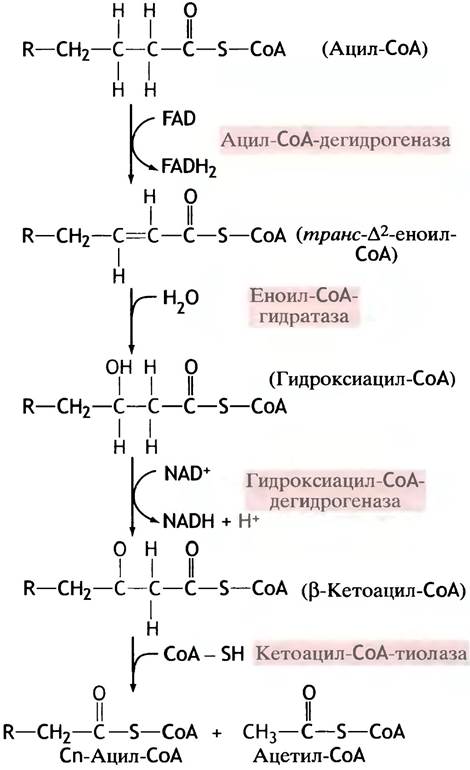
Ключевой реакцией в метаболизме жиров служит реакция взаимодействия СоА-SН с β-кетоацил-СоА в ходе которой разрывается углеводородная цепь остатке жирной кислоты. Ее двухуглеродный фрагмент отщепляется в виде ацетил-СоА, и остается укороченный на два атома углерода остаток жирной кислоты (ацил-СоА) Фермент, осуществляющий эту реакцию, называют тиолазой, поскольку молекула исходного ацил-СоА атакуется тиольной группой свободного СоА. Природные длинноцепочечные жирные кислоты содержат четное число атомов углерода, поэтому последовательное отщепление двухуглеродных фрагментов рано или поздно приводит к образованию бутирил-СоА, которьп превращается затем в (3-ацетоацетил-СоА. Расщепление этого соединения на два ацетил-СоА завершает процессе укорачивания жирнокислотной цепи:
![]()
Итак, на каждом этапе расщепления жирных кислот образуется β-кетоацил-СоА со все более укороченной углеводородной цепью. Это дает основание весь рассмотренный выше процесс в целом назвать β-окислением жирных кислот. NАDН и FАDН2, образующиеся при β-окислении, отдают затем свои электроны митохондриальной электронтранспортной цепи (см. рис. 8.19).
Энергетический выход при окислении жирных кислот
Молекула пальмитиновой кислоты (С16) превращается в 8 молекул ацетил-СоА, при этом дополнительно образуются 7 молекул FАDН и столько же FАDН2. Ацетил- СоА далее окисляется в цикле лимонной кислоты, а NADH и FАDН2-в митохондриальной электрон- транспортной цепи (см. главу 8). При окислении NАDН синтезируются 2,5 молекулы АТР, а при окислении FADH2- 1,5 молекулы (поскольку NADH образуется в матриксе, челночный механизм не задействован в его переносе внутрь митохондрий).
Таким образом, окисление 1 молекулы пальмитиновой кислоты приводит к синтезу 106 моль АТР из ADP и Рi (с учетом затраты двух молекул АТР на образование пальмитоил-СоА и синтеза одной молекулы GTP на каждый ацетил-СоА в цикле лимонной кислоты). Это означает, что КПД процесса равен 33%; такая доля свободной энергии преобразуется в полезную работу в виде синтеза АТР. Результаты нашего расчета можно представить и по-другому: окисление 256 г пальмитиновой кислоты дает 45 кг АТР. Разумеется, такого количества АТР никогда не бывает, он быстро гидролизуется, обеспечивая энергетические потребности организма.
Окисление ненасыщенных жиров
Оливковое масло - жидкое, потому что в нем высокое содержание мононенасыщенных жиров - триглицеридов и фосфолипидов, в состав которых входят ненасыщенные жирные кислоты с одной и более двойными связями в углеводородной цепи. Примером может служить пальмитоолеиновая кислота с двойной связью между девятым и десятым атомами углерода. Вплоть до двойной связи цепь такой кислоты укорачивается обычным окислением с образованием цис-∆3-еноил-СоА:
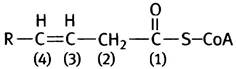
Двойная связь в этом соединении не позволяет ацил-СоА-дегидрогеназе ввести еще одну, соседнюю двойную связь между вторым и третим С-атомами. На этом β-окисление могло бы закончиться, однако фермент изомераза сдвигает двойную связь в нужное положение и образует трансизомер, который становится субстратом еноил-СоА-гидратазы (см. рис. 9.2).
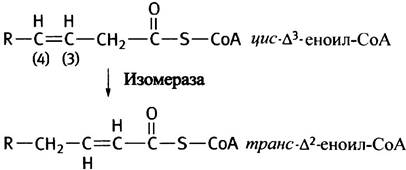
Это ухищрение решает проблему биологического окисления мононенасыщенных жирных кислот. Полиненасыщенные жирные кислоты создают дополнительные трудности. Возьмем, например, линолевую кислоту с двумя двойными связями (∆9 и ∆12). Судьба одной из них (∆9) при окислении такова, как описано выше. Другая связь (∆12) восстанавливается в нужный момент особым ферментом, благодаря чему гидролиз линолевой кислоты осуществляется по механизму β-окисления (на самом деле все обстоит несколько сложнее).
Всегда ли ацетил-СоА, образующийся при β-окислении, поступает в цикл лимонной кислоты?
До сих пор рассматривалась ситуация, когда весь синтезированный ацетил-СоА поступает в цикл лимонной кислоты. Так обычно и бывает во всех тканях, однако случаются чрезвычайные ситуации, когда в печени этого не происходит.
Иногда метаболизм жиров становится для организма основным источником энергии (см. главу 5). Это состояние наступает, например, при голоде, когда исчерпаны все запасы гликогена. У диабетиков глюкозный голод возникает не из-за недостатка глюкозы, а вследствие невозможности ее превращения. Как бы то ни было, торможение гликолиза побуждает жировые клетки высвобождать жирные кислоты, а печень - использовать их для синтеза избыточного количества ацетил-СоА. Избыточного в том смысле, что оно превышает потребности цикла лимонной кислоты. Ситуация усугубляется еще и тем, что прекращение углеводного метаболизма приводит к недостатку оксалоацетата, необходимого для производства цитрата из ацетил-СоА (см. с. 121).
В этой ситуации в клетках печени два ацетильных остатка соединяются в ацетоацетат (СН3СОСН2СОО-), который частично восстанавливается в β-гидроксибутират (СН3СНОНСН2СОО-). Эти два вещества - кетоновые тела - поступают в кровь.
Как ацетоацетат образуется из ацетил-СоА?
Ацетоацетил-СоА образуется из ацетил-СоА в результате обращения реакции, катализируемой кетоацил-СоА-тиолазой:
2СН3СО-S-СоА <-> СН3СОСН2СО-SСоА + СоА-SН
Казалось бы, свободный ацетоацетат должен был образоваться в результате гидролиза ацетоацетил-СоА (что сдвигало бы равновесие приведенной реакции в сторону образования продукта). Вместо этого ацетоацетил-СоА взаимодействует с третьей молекулой ацетил-СоА с образованием 3-гидрокси-3-метилглутарил-СоА (ГМГ-СоА), который расщепляется до ацетоацетата и ацетил-СоА (рис. 9.3).
Рис. 9.3. Образование кетоновых тел в митохондриях печени при избыточном окислении жиров (голодание, диабет). 3-Гидрокси-3-метилглутарил-СоА (ГМГ-СоА) служит предшественником холестерина и в этом случае синтезируется в цитоплазме в результате реакции, катализируемой гидроксиметилглутарил-СоА-синтазой
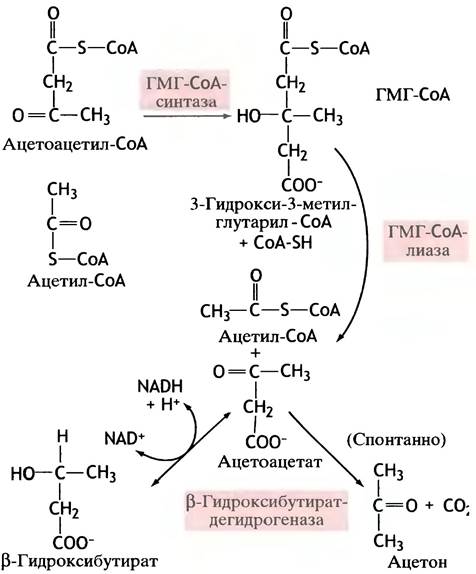
Почему синтез ацетоацетата происходит таким образом, непонятно. Гидроксиметилглутарил-СоА, синтезируемый многими животными клетками, является предшественником холестерина - важного компонента цитоплазматической мембраны (см. с. 58). Образование кетоновых тел происходит в митохондриях (именно там жиры превращаются в ацетил-СоА). Более того, образование гидроксиметилглутарил-СоА, необходимого для синтеза холестерина, сосредоточено в цитоплазме, где находится специальный фермент - гидроксиметил- глутарил-СоА-синтаза, прикрепленная к мембране эндоплазматического ретикулума.
Периферические ткани могут использовать ацетоацетат для генерации энергии. В митохондриях в результате реакции обмена ацильным остатком с сукцинил- СоА он превращается в ацетоацетил-СоА:
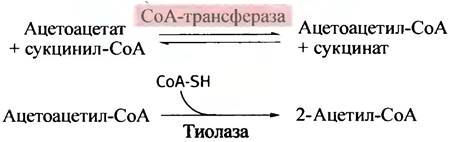
Ацетоацетил-СоА далее расщепляется тиолазой (с участием свободного СоА) на две молекулы ацетил- СоА. β-Гидроксибутират после предварительной дегидрогенизации также превращается в ацетоацетат.
Окисление жирных кислот с нечетным числом углеродных атомов
Небольшая доля жирных кислот в пищевых продуктах (например, растительного происхождения) имеет нечетное число углеродных атомов. При β-окислении таких кислот в качестве предпоследнего продукта образуется не ацетоацетил-СоА, а пятиуглеродный β-кетоацил-СоА. Расщепление такого остатка тиолазой приводит к появлению ацетил-СоА и трехуглеродного пропионил-СоА:
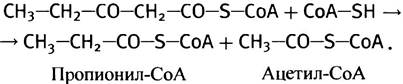
Пропионил-СоА превращается в сукцинил-СоА и вовлекается в цикл лимонной кислоты. Соответствующие реакции приведены ниже. Эпимераза катализирует превращение D-конфигурации метилмалонил-СоА в L-конфигурацию:
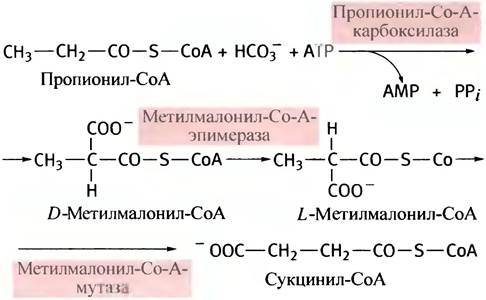
Последняя реакция (изомеризация метилмалонил- СоА) интересна тем, что в ней участвует наиболее сложно устроенный кофермент - дезоксиаденозилкобаламин, производное витамина В12 (рис. 9.4).
Рис. 9.4. Структура дезоксиаденозилкобаламина
Пропионат также образуется при расщеплении четырех аминокислот (валина, изолейцина, метионина и треонина), а еще из боковой цепи холестерина.
Если не хватает метилмалонил-СоА-мутазы или нарушен синтез кофермента из витамина В12, развивается смертельно опасный ацидоз.
Окисление жирных кислот в пероксисомах
Пероксисомы - небольшие, окруженные мембраной пузырьки, обнаруженные во многих животных клетках. Подробнее о них рассказано в главе 16. Заметим лишь,
что они также окисляют жирные кислоты, хотя основная масса последних подвергается окислению в митохондриях. При пероксисомальном β-окислении жирных кислот также образуется FАDН2, который затем окисляется не в митохондриях, а в самих пероксисомах, при непосредственном участии кислорода и с образованием перекиси водорода и тепла. Функции пероксисом менее изучены, чем функции других внутриклеточных органелл. Можно предположить, что одной из них является метаболизм жирных кислот, содержащих более 18 углеродных атомов, которые не окисляются митохондриальной системой.
До сих пор мы имели дело с образованием энергии из глюкозы и жиров. Остается третий главный компонент пищи - аминокислоты, и логично было бы теперь рассмотреть их превращения. Однако целесообразнее от метаболизма глюкозы и жиров перейти непосредственно к их синтезу и его регуляции в организме, тем более что при генерации энергии из аминокислот уже на начальных стадиях метаболизма образуются вещества, участвующие либо в гликолизе, либо в цикле лимонной кислоты, так что особым своеобразием эти превращения не отличаются. Наиболее важные аспекты метаболизма аминокислот не имеют отношения к производству энергии.
Вопросы к главе 9
1. Периферические ткани получают жирные кислоты из крови. Расскажите о трех возможных способах их доставки.
2. Какие клетки организма не используют жирные кислоты как источник энергии?
3. Что является первой стадией расщепления жирных кислот? Где она происходит? Где в клетках эукариот жирные кислоты превращаются в ацетил-СоА? Как жирные кислоты туда попадают?
4. Что общего между реакциями окисления жирных кислот до ацетил-СоА и некоторыми превращениями в цикле лимонной кислоты?
5. Каков выход АТР при окислении пальмитиновой кислоты? Поясните ответ.
6. Объясните, как мононенасыщенный жир (∆9) окисляется в ацетил-СоА.
7. Всегда ли ацетил-СоА, образовавшийся при расщеплении жирных кислот, попадает в цикл лимонной кислоты?
8. Гидроксиметилглутарил-СоА - промежуточный продукт, образующийся при синтезе ацетоацетата и холестерина. Где протекают эти процессы?