БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 21. ТРАНСКРИПЦИЯ ГЕНА — ПЕРВЫЙ ЭТАП В МЕХАНИЗМЕ КОНТРОЛЯ ЗА БИОСИНТЕЗОМ БЕЛКА
В молекуле ДНК в виде последовательности из 4 азотистых оснований закодирована информация о структуре белков. Одну аминокислоту кодирует последовательность из 3 оснований. При комбинации 4 азотистых оснований возможны 4 • 4 • 4 вариантов триплетов, поэтому ограничения кодирующих возможностей нет. Ген в биосинтезе белка непосредственно не участвует. У эукариот ДНК окружена ядерной мембраной, а белок- синтезирующий аппарат находится в цитоплазме. Каким образом тогда ген управляет синтезом белка? Он посылает из ядра в цитоплазму копии, в которых закодирована информация (например, у Е. соli такая копия поступает в цитоплазму непосредственно). Поскольку скопированная информация представлена в виде последовательности азотистых оснований, копия тоже должна быть нуклеиновой кислотой. Она носит название рибонуклеиновой кислоты (РНК), о которой речь шла выше; с учетом функции ее называют матричной (или информационной, или мессенджерной) РНК (для краткости - мРНК).
Матричная РНК
Структура РНК
РНК - полинуклеотид, похожий на ДНК, но имеющий свои особенности.
✵ Сахар в РНК представлен рибозой, имеющей во втором положении ОН-группу, а не дезоксирибозой.
✵ мРНК - одноцепочечная молекула, а не дуплекс двух молекул, из чего можно заключить, что мРНК - копия только одной из двух цепей ДНК гена.
✵ В РНК 4 азотистых основания: А, С, G и U. Т - отсутствует. И U, и Т образуют пару с А. Можно рассматривать Т как U, к которому присоединена метальная группа (объяснение возможной причины ее происхождения приведено на с. 256).
Если бы не эти различия, структуру одноцепочечной ДНК (см. с. 235) вполне можно было бы принять за РНК: те же 3' —> 5' фосфодиэфирные связи между соседними нуклеотидами, на 5'-конце нет нуклеотидного заместителя у 5'-ОН, а 3'-конец имеет свободную 3'-ОН-группу. Гидроксильная группа в 2'-положении делает молекулу РНК химически более нестабильной по сравнению с ДНК (см. с. 235). В разведенном растворе щелочи РНК разрушается при комнатной температуре, а молекула ДНК устойчива.
Как синтезируется мРНК?
«Строительными блоками» для синтеза мРНК служат АТР, СТР, GTP и UTP, синтезируемые во всех клетках (см. главу 18). В Е. coli синтез мРНК катализирует ДНК-зависимая РНК-полимераза (для краткости- РНК-полимераза). В клетках эукариот существуют три таких полимеразы.
Чтобы происходил катализируемый РНК-полимеразой синтез РНК, т. е. на одной цепи-матрице нуклеотиды собирались в определенной последовательности, необходимо разделение цепей ДНК. На участке синтеза РНК две цепи ДНК временно расходятся, а после прохождения полимеразы они соединяются вновь.
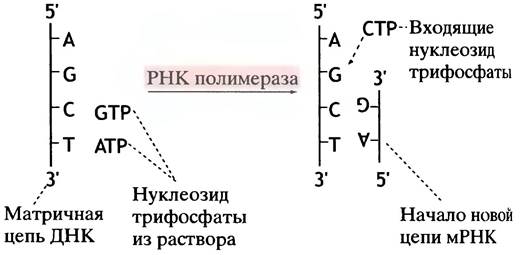
Процесс синтеза РНК во многом схож с синтезом ДНК: азотистое основание входящего рибонуклеотида должно быть комплементарно основанию на матрице ДНК (рис. 21.1).
Рис. 21.1. Копирование мРНК на матричной цепи ДНК. Вторая цепь ДНК не указана. Обратите внимание, что разделение цепей ДНК - временное
РНК-полимераза, продвигаясь вдоль матрицы, соединяет нуклеотиды в том порядке, который определен матрицей ДНК. Как и в случае ДНК, синтез РНК всегда
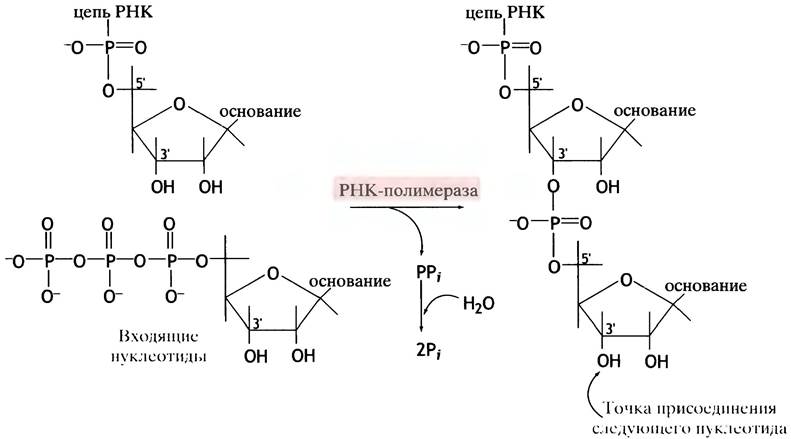
осуществляется в направлении 5' —> 3'. Нуклеотиды присоединяются к 3'-ОН-группам, и поэтому элонгация цепи происходит в направлении 5' —> 3'. Химическая реакция, катализируемая полимеразой, заключается в переносе α-фосфорильной группы нуклеозидтрифосфатов (прямо соединенной с рибозой) на 3'-ОН-группу предшествующего нуклеотида с высвобождением неорганического пирофосфата. Последний гидролизуется с образованием двух молекул Рi, что делает эту реакцию (рис. 21.2) сильно экзоэргонической.
Рис. 21.2. Реакция, катализируемая РНК-полимеразой
РНК-полимераза способна инициировать новые цепи, и ей не нужен праймер. В присутствии матрицы РНК-полимераза может сразу синтезировать всю молекулу мРНК. В этом заключается еще одно важное отличие процесса транскрипции от синтеза ДНК, поскольку ДНК-полимеразе всегда необходим праймер (см. с. 248).
Некоторые общие свойства мРНК
Обычная хромосома содержит тысячи различных генов. Каждую молекулу мРНК кодирует один ген (или небольшая группа генов у прокариот), поэтому в клетке постоянно образуется множество различных мРНК в соответствии с числом активных в данный момент генов. По сравнению с длинной молекулой ДНК молекула мРНК невелика. В цитоплазме многочисленные мРНК управляют синтезом множества белков, закодированных соответствующими генами.
Для данной живой клетки молекула ДНК бессмертна. Время полужизни мРНК у эукариот - от 20 минут до нескольких часов, а у бактерий - около двух минут.
Таким образом, для экспрессии гена (термин экспрессия означает, что ген работает и белок синтезируется) необходима постоянная транскрипция молекул мРНК. Можно сказать, что ген «штампует» копию за копией, а РНК- полимераза - его «штамповочная машина». Как только ген прекращает образование мРНК, деградация последней служит главным «выключателем» синтеза белка.
Клетки Е. coli ядерной мембраны не имеют, и гены контактируют с цитоплазмой. У эукариот одна мРНК всегда соответствует одному гену, а у прокариот одна мРНК может нести информацию сразу о нескольких белках. Ее называют полицистронной (генетический термин цистрон обозначает ген, контролирующий одну функцию). Кластеры генов, транскрибируемых в одну полицистронную мРНК, обеспечивают координированный синтез белков, функционирующих как единое целое (например, ферментов одного метаболического пути). Существуют и другие значительные различия в образовании мРНК про- и эукариот, которые будут рассмотрены ниже.
Некоторая важная терминология
Поток информации при экспресии гена происходит в направлении:
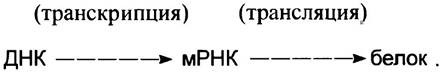
Стрелки обозначают направление переноса информации.
При копировании ДНК в РНК происходит переписывание (транскрипция) информации, поэтому образование мРНК называют транскрипцией гена, или чаще просто транскрипцией. О ДНК же говорят, что она транскрибируется. Образовавшиеся молекулы РНК называют транскриптами. Синтез белка на матричной РНК называют трансляцией.
До сих пор мы обсуждали синтез мРНК как копирование ДНК. Матрица цепи ДНК «копируется» только комплементарным способом: путем спаривания по Уотсону-Крику азотистых оснований входящих рибонуклеотидов с основаниями матрицы. Против А в матрице становится и в копии и т. д. Ту цепь ДНК, которая служит матрицей для синтеза мРНК, называют матричной цепью, а другую - нематричной цепью.
Кроме того, широко используются термины: кодирующая и некодирующая цепи, смысловая и несмысловая цепи, хотя нередко различные авторы понимают их по-разному. Единой согласованной терминологии не существует, однако важно знать, что имеется в виду при использовании того или иного термина. В этой книге подразумевается, что мРНК несет информацию об аминокислотной последовательности белка и таким образом передает послание гена на трансляционную машину.
Последовательность азотистых оснований в мРНК та же, что и в нематричной цепи ДНК (за исключением замены Т —> U), поэтому мы будем называть нематричную цепь кодирующей, или смысловой. Матричная же цепь здесь определяется как несмысловая, или некодирующая (рис. 21.3). У вирусов матричную цепь часто называют минус-цепь,или (-)-цепь, а некодирующую - плюс-цепь, или (+).
Рис. 21.3. Схематичное изображение, показывающее на примере мРНК термины «матричная» и «нематричная» для цепи ДНК как переносчика информации. У вирусов матричную цепь часто называют (-)-цепью, а некодирующую (+)-цепью

О чем пойдет речь дальше
До сих пор мы знакомились с экспрессией гена, рассматривая ген только как матрицу ДНК. Однако есть много других важных и интересных вопросов, например, каким образом, в клетке происходит отбор генов, подлежащих экспресии? Как РНК-полимераза «узнает»,
с какого места в транскрибируемом гене нужно начинать копирование ДНК и где остановиться? Каким образом контролируется скорость экспрессии гена? Один белок, кодируемый своим геном, может образовываться в больших количествах, а другой - в очень малых или не образовываться совсем. Некоторые гены могут быть экспрессированы только в определенное время. Как же это достигается? Для ответа на поставленные вопросы мы должны рассмотреть структуры реальных генов, точнее, последовательности их оснований.
До сих пор мы рассматривали биохимию животной клетки. Впрочем, различия многих метаболических процессов, протекающих у прокариот и эукариот, невелики и не затрагивают фундаментальных принципов. Однако при переходе к экспрессии генов они становятся столь значительными, что требуют самостоятельного рассмотрения. Начнем с Е. coli.
Транскрипция гена Е. coli
Что определяется термином «ген» у прокариот?
В главе 19 (см. с. 240) мы отмечали, что ген - это фрагмент большой молекулы ДНК. Теперь нам предстоит уточнить это определение.
Итак, ген функционирует только в качестве матрицы для транскрипции молекул РНК, у которых последовательность азотистых оснований соответствует нематричной цепи ДНК. Ген - это фрагмент ДНК, транскрибируемый в РНК. Большая группа генов кодирует рибосомные и транспортные РНК.
Остальные гены ответственны за образование молекул мРНК, которые и кодируют аминокислотные последовательности соответствующих белков. На каждом конце молекулы мРНК есть области, которые не транслируются в белок. На 5'-конце находится нетранслируемая область (НТО; в англоязычной литературе - untranslated region, UTR), которая содержит закодированный сигнал, необходимый для инициации трансляции. Участок на 3'-конце сигнализирует о терминации трансляции. Таким образом, ген, помимо закодированной информации о структуре белка, включает также участки - сайты - ДНК, которые транскрибируются, но не используются для кодирования данного белка.
Этим перечень участков ДНК, связанных с геном, не исчерпывается. Примыкающий к 5'-концу гена участок ДНК называют промотором. Он важен для транскрипции гена, но сам в РНК не транскрибируется.
Противоположный 3'-конец - терминаторная область - необходим для терминации транскрипции. В РНК он также не транскрибируется. Схематическая структура гена приведена на рис. 21.4. Транскрипция начинается со стартовой точки, которая служит матрицей для первого нуклеотида мРНК. Матрица первого нуклеотида обозначена как +1, а соседний нуклеотид с 5'-конца как -1. Стартовая точка обозначена стрелкой, указывающей направление транскрипции. Нуклеотиды, расположенные по отношению к стартовой точке в сторону 5'-конца, обозначаются термином против хода, а в сторону 3'-конца - по ходу транскрипции. На рис. 21.4 один конец гена помечен 5'. Это подводит нас к следующему вопросу.
Рис. 21.4. Структура прокариотного гена и его мРНК. 5'-Конец гена относится к нематричной, или смысловой цепи. В соседнем гене нематричной может быть другая цепь, а транскрипция будет происходить справа налево
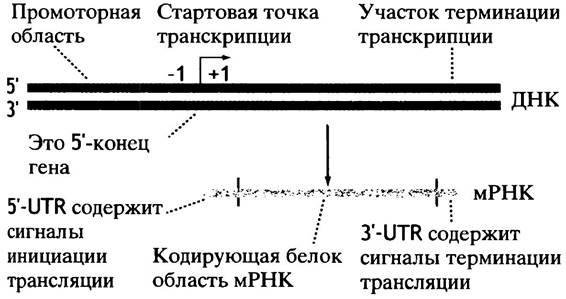
Что мы имеем в виду, говоря о 5'-конце гена?
5'-Конец гена - это конец, содержащий промотор. Поскольку синтез РНК всегда происходит в направлении 5' —> 3', то 5'-конец гена всегда соответствует 3'-концу матричной цепи (см. рис. 21.3). Следует отметить, что в физическом смысле концов нет: цепь ДНК продолжается и в следующем гене.
5'-Конец гена на схеме хромосомы обычно располагают слева. Цепь ДНК, являющаяся для одного гена матричной, для другого может быть и нематричной (смысловой). Использование цепи в качестве матрицы может переключаться от одного гена к другому. Если противоположная цепь используется таким образом на втором, соседнем гене, транскрипция происходит в противоположном направлении, так как синтез идет в направлении 5' —> 3'.
Фазы транскрипции гена
Существуют три фазы транскрипции гена: инициация, элонгация и терминация. Наиболее сложной из них является инициация.
Инициация транскрипции в Е. coli
В промоторах есть короткие последовательности азотистых оснований, называемые боксами или элементами. Это принятые термины, но последовательности оснований в любом смысле не являются «боксами» и не имеют ничего общего с элементами атома. В типичном промоторе Е. coli есть два бокса: бокс Прибнова (названный так по имени открывшего его автора), который расположен около участка -10, и бокс, находящийся левее на участке -35 по отношению к стартовой точке транскрипции.
Эти последовательности получили название консенсусных - из-за частой встречаемости у различных генов и малой вариабельности (хотя известны случаи отсутствия некоторых из этих последовательностей). Одиночные последовательности всегда приводятся в направлении 5' —> 3', но в гене есть вторая цепь ДНК. Таким образом, хотя мы и говорим, что бокс Прибнова имеет последовательность ТАТААТ, в действительности дело обстоит так:
![]()
Т. е. это двойная цепь, которая и распознается белками, регулирующими процесс транскрипции.
Правильная инициация транскрипции чрезвычайно важна, поскольку синтез мРНК должен начаться с точно определенного нуклеотида на матрице. Каким же образом РНК-полимераза оказывается в нужном месте? Важная роль в этом процессе принадлежит боксу Прибнова и элементу -35. ДНК-зависимая РНК-полимераза Е. соli - большой белковый комплекс, сердцевину которого формируют 4 субъединицы. Обладая сродством к любому отрезку ДНК, к которому он может произвольно
присоединиться, фермент не может «самостоятельно» узнать сайт инициации. При соединении с другим цитоплазматическим белком - сигма-белком, или сигма- фактором -образующийся холофермент теряет сродство к случайным последовательностям ДНК, но прочно связывается с элементом -35 и боксом Прибнова (несмотря на то, что азотистые основания ДНК внутри дуплекса спарены по Уотсону-Крику, они могут быть узнаны белками в бороздках ДНК; см. рис. 19.4). Это должным образом ориентирует фермент. РНК-полимераза может теперь разделить цепи ДНК и инициировать синтез РНК. В месте разделения цепей ДНК формируется «глазок» (длиной примерно 1,5 витка спирали), благодаря которому азотистые основания матричной цепи становятся доступны для соединения с нуклеозидтрифосфатами. Из них фермент образует несколько первых фосфодиэфирных связей - происходит инициация. В этот момент сигма-белок отходит, а полимераза движется вдоль гена, синтезируя мРНК со скоростью около 40 нуклеотидов в секунду. Так продолжается до тех пор, пока фермент не достигнет терминатора. Что вызывает отделение сигма-белка от фермента, до сих пор неизвестно.
Расплетание ДНК
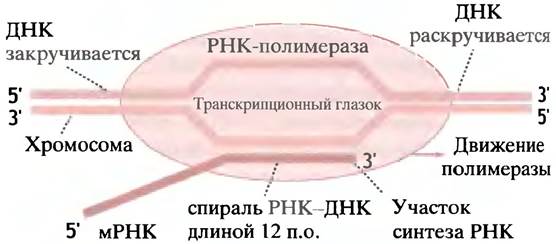
Для транскрипции гена необходимо временное разделение двойной спирали ДНК. Бокс Прибнова, характеризуемый высоким содержанием А и Т и потому более слабыми водородными связями, является местом первоначального разделения цепей. ДНК расплетается перед полимеразой и закручивается позади нее. Отрицательная сверхспирализация ДНК облегчает этот процесс (см. с. 244). Таким образом, временно образовавшийся «глазок» движется вдоль гена вместе с полимеразой. На коротком участке вновь синтезированная мРНК спаривается с матричной цепью, но затем отделяется от нее. На рис. 21.6 показано продвижение РНК-полимеразы вдоль двойной спирали ДНК.
Рис. 21.6. Схематичное изображение транскрипции ДНК РНК-полимеразой Е. coli. Полимераза расплетает участок ДНК длиной около 17 пар оснований, образуя транскрипционный глазок, который продвигается вдоль ДНК. ДНК расплетается впереди полимеразы и закручивается позади нее. Синтезированная РНК образует с ДНК двойную спираль РНК-ДНК длиной около 12 пар оснований
Терминация транскрипции
В конце некоторых генов прокариот находятся последовательности, которые в транскрибируемой РНК формируют структуру шпильки. Хотя молекула мРНК и является одноцепочечной, ее термодинамические особенности допускают спаривание оснований в пределах одной цепи. Вновь синтезированная мРНК связана с матричной цепью ДНК за счет спаривания оснований. Недалеко от конца гена последовательность оснований в транскрибированной мРНК способствует образованию шпилечной структуры (рис. 21.7). Последовательность оснований в этом месте содействует образованию стабильных пар G-C за счет 3 водородных связей в каждой. Сразу же вслед за шпилечной структурой в транскрипте мРНК находится несколько остатков U, слабо связывающих РНК с ДНК. Это, по-видимому, облегчает отделение мРНК и терминацию транскрипции. Шпилечная структура нарушает связывание мРНК с матрицей: ведь если основания преимущественно спариваются внутри цепи мРНК, они не могут образовывать пар с матрицей ДНК. Серия остатков U облегчает окончательное отделение мРНК из-за слабости водородных связей между А и U. Каков бы ни был точный механизм, эта шпилечная структура с последующими остатками U приводит к терминации транскрипции.
У многих генов прокариот есть и второй способ терминации транскрипции. В его осуществлении участвует так называемый белок Rho, или фактор Rho, необходимый для отделения мРНК от гибрида ДНК-РНК. Фактор Rho присоединяется к транскрибированной мРНК и двигается вдоль нее позади РНК-полимеразы. В участке терминации полимераза останавливается, возможно, из-за трудности разделения богатого парами G-C участка ДНК, что позволяет Rho-фактору догнать полимеразу. Этот белок обладает расплетающей (хеликазной) активностью, которая специфична в отношении ДНК-РНК дуплекса, образующегося в ходе транскрипции. Поэтому, догнав полимеразу, Rho-фактор отделяет РНК-транскрипт, тем самым заканчивая транскрипцию. мРНК управляет синтезом белка. У Е. coli она начинает делать это еще до завершения образования полной молекулы мРНК, поскольку транскрипция происходит при непосредственном контакте с цитоплазмой.
Однако остается открытым вопрос о контроле за транскрипцией генов в Е. coli.
Скорость инициации транскрипции гена у прокариот
К конститутивно экспрессируемым генам относятся гены, которые все время находятся во «включенном» состоянии, и скорость их экспрессии избирательно не модулируется. Такие гены кодируют ферменты и другие белки, постоянно необходимые для жизнедеятельности клетки. Однако иногда потребность в некоторых из таких конститутивных белков может сильно возрастать. Основное влияние на скорость экспрессии генов у бактерий оказывает скорость образования мРНК, а это в значительной степени определяется частотой инициации транскрипции данного гена. У разных генов она может сильно варьировать, так как они имеют промоторы разной «силы». «Сильный» промотор будет часто инициировать транскрипцию, что приведет к образованию многочисленных мРНК транскриптов и большого количества соответствующего белка. «Слабый» промотор оказывает противоположный эффект. Сила промотора является функцией последовательности оснований в боксах Прибнова и -35, расстояния между ними и основаниями в участке от +1 до +10. Более высокое сродство полимеразы к этим областям и сила промотора могут коррелировать и не так строго.
Контроль транскрипции различными сигма-факторами
Сигма-факторы являются одним из эффективных «инструментов» контроля целых блоков генов у прокариот. При определенных условиях обычный сигма-фактор заменяется иным, который побуждает полимеразу инициировать транскрипцию другого набора генов. К таким условиям относятся: 1) споруляция бацилл, когда после получения сигнала о неблагоприятных условиях окружающей среды образуется новый сигма-фактор; это вызывает экспрессию ряда генов, ведущих к споруляции; 2) азотное голодание, при котором образуется особый фактор; 3) тепловой шок (внезапный подъем температуры), после которого у Е. coli временно увеличивается синтез, стабильность и активность другого сигма-фактора, чей уровень в норме очень низок. Этот фактор управляет транскрипцией генов, кодирующих «белки теплового шока», которые защищают клетку от его последствий.
Lac-оперон
Каким образом осуществляется регуляция отдельных генов Е. соli?
Бактерии вынуждены приспосабливаться к постоянно меняющимся условиям окружающей среды. К тому же среди бактериальных популяций существует жестокая конкуренция. Типичная клетка Е. coli в оптимальных условиях делится каждые 20 минут. Если штамм способен сократить это время на 1 минуту, он очень быстро станет преобладать над другими штаммами. Неэффективность биохимических процессов в условиях такой конкуренции недопустима.
На образование ферментов затрачиваются ресурсы и энергия, и, если в данный момент эти ферменты не нужны, Е. coli не будет их синтезировать. Как уже отмечалось, конститутивные ферменты образуются постоянно при любых обстоятельствах. Поскольку глюкоза является основным сахаром, а другие сахара могут пойти по пути метаболизма глюкозы, ферменты, метаболизирующие глюкозу, - конститутивны. Клетка «предполагает», что они будут нужны всегда, поэтому промоторы кодирующих их генов не имеют «выключателя», они постоянно «включены».
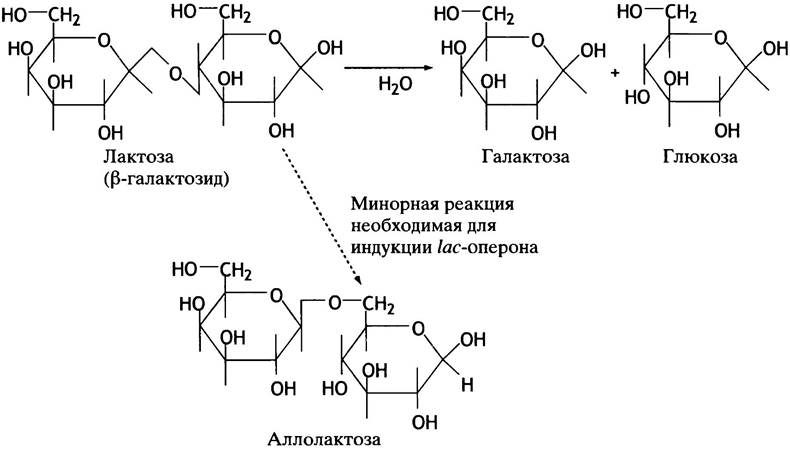
Однако Е. coli может столкнуться с другими сахарами, например, с присутствующим в молоке дисахаридом лактозой. Если это единственный доступный источник углерода, его утилизация позволит клетке выжить. Для этого необходим фермент β-галактозидаза, названный так потому, что лактоза - это β-галактозид, который при гидролизе распадается на галактозу и глюкозу (рис. 21.8). Для транспорта лактозы в клетку необходим дополнительный транспортный белок β-галактозидпермеаза. Третий белок - галактозидтрансацетилаза - защищает клетку от неметаболизирующихся, потенциально токсичных β-галактозидов. В норме эти белки синтезируются в течение нескольких минут. Они не нужны клетке до момента встречи с лактозой, но, когда она оказывается единственным источником энергии, происходит практически мгновенная активизация синтеза этих трех белков - и клетка может использовать лактозу в качестве источника углерода и энергии. Однако, если помимо лактозы присутствует и глюкоза, продукция этих ферментов невыгодна: зачем образовывать глюкозу внутри клетки, когда ее и так много в окружающей среде? В этом случае клетка «игнорирует» лактозный сигнал и не продуцирует указанные выше ферменты. Эта регуляция, к которой мы сейчас переходим, осуществляется на уровне инициации транскрипции гена.
Рис. 21.8. Реакции, катализируемые β-галактозидазой. Фермент, участвующий в метаболизме лактозы, часто называют лактазой
Структура lас-оперона Е. coli
Для начала несколько терминов: синтез белка в ответ на химический сигнал называется индукцией, а само химическое вещество - индуктором. Подавление синтеза белка называется репрессией.
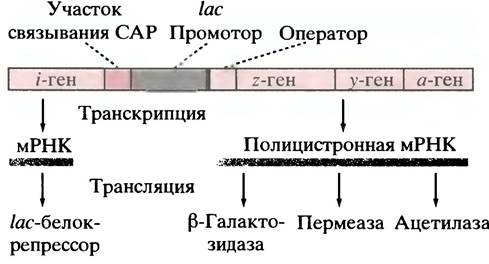
Как уже отмечалось ранее, гены эукариот представляют собой одиночные структуры. Многие из них сгруппированы, и такая группа может находиться под транскрипционным контролем одного промотора. РНК-полимераза транскрибирует всю группу, создавая молекулу полицистронной мРНК, которая кодирует несколько белков. Такая группа генов, контролируемая одним промотором, называется опероном, а промотор - часть этого оперона. Гены β-галактозидазы, лактозопермеазы
и трансацетилазы принадлежат к такому оперону. Их часто обозначают как z, y, и а соответственно. Существует также I-ген (i обозначает индуцибельность), кодирующий белок lас-репрессор. Репрессор может связываться с участком ДНК, который называется оператором. Наконец, есть фрагмент ДНК, с которым способен связываться белок: рецептор сАМР. Он назван белком-активатором катаболизма (САР), потому что участвует в индукции и других ферментов, осуществляющих катаболизм субстратов. Примерная организация этих элементов приведена на рис. 21.9.
Рис. 21.9. Структура lас-оперона. I-ген кодирует lаc-белок-репрессор
Теперь рассмотрим собственно механизм контроля. Следует заметить, что сам по себе lас-промотор - слабый промотор, и РНК-полимераза для инициации транскрипции практически не связывается с ним. Без посторонней помощи транскрипция с lас-оперона осуществляется только на низком уровне. Помощь приходит в виде САР-белка, который связывается с матрицей на фрагменте, соседствующем с местом связывания полимеразы. Связывание САР-белка вызывает изгиб двойной спирали на участке присоединения, что усиливает свойства промотора. Однако САР не присоединяется до тех пор, пока не вступит в контакт с сАМР, который является аллостерическим регулятором этого белка. сАМР образуется в клетке только при низком уровне глюкозы. Когда содержание глюкозы велико, сАМР в клетке Е. coli мало, САР-белок не связывается с опероном, так же, как и РНК-полимераза, и поэтому транскрипция lас-оперона минимальна. Это показано на рис. 21.10, а.
Всегда ли lас-оперон транскрибируется при низком уровне глюкозы? Нет, для транскрипции необходимо присутствие лактозы. В отсутствие лактозы lас-белок-репрессор присоединен к оператору, блокирует РНК-полимеразу, и транскрипции не происходит (рис. 21.10, б), Lас-репрессор - аллостерический белок. В отсутствие лактозы в окружающей среде он имеет высокое сродство к оператору. Если в среде есть лактоза, низкий уровень активности пермеазы обеспечивает попадание небольших количеств сахара в клетку. В ходе гидролиза лактозы небольшое количество этого дисахарида превращается в изомер - аллолактозу (см. рис. 21.8). Она связывается с белком-репрессором, и в результате аллостерических изменений последний диссоциирует от оператора, тем самым разблокируя оперон.
Рис. 21.10. Экспрессия lас-оперона. а - При высоких концентрациях глюкозы отсутствует сАМР, который способствует связыванию САР-белка, что необходимо для присоединения РНК-полимеразы к промотору; б - при низких концентрациях глюкозы, но в отсутствие лактозы, происходит связывание САР-белка, что способствует присоединению РНК-полимеразы к промотору. Однако транскрипция все еще не происходит, поскольку /ас-репрессор связан с оператором, блокируя движение полимеразы; в - аллолактоза связывается с репрессором, вызывая отделение последнего от оператора. Начинается транскрипция (в присутствии лактозы образуется небольшое количество ее изомера - аллолактозы, которая, собственно, и является индуктором). САР-белок - активатор катаболизма
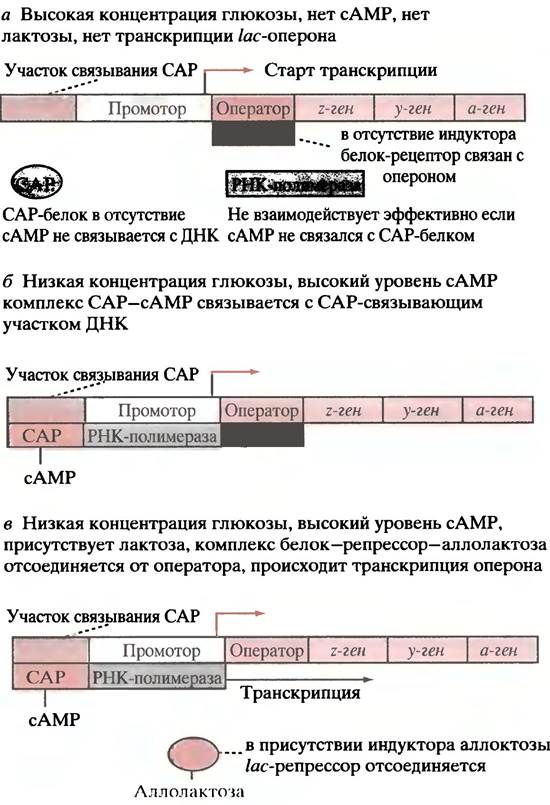
Почему индуктором является аллолактоза, а не лактоза? Возможно потому, что аллолактоза, будучи побочным продуктом β-галактозидазной реакции, образуется в достаточном для индукции количестве только при высоких концентрациях лактозы. Это предотвращает индукцию в присутствии следовых количеств лактозы.
Использование аллолактозы (а не лактозы) в качестве индуктора крайне целесообразно. Если бы индуктором являлась лактоза с низким сродством к белку-репрессору, то индукция была бы невозможна, так как индуцированная β-галактозидаза поддерживала бы низкий уровень лактозы независимо от концентрации последней вне клетки. Когда вся лактоза будет исчерпана, β -галактозидаза станет использовать и аллолактозу, которая также является субстратом этого фермента, обеспечивая тем самым механизм терминации индукции. Система будет, таким образом, постоянно тестировать скорость поступления лактозы, решая, стоит продолжать индукцию или нет.
После освобождения оператора РНК-полимераза может свободно двигаться по оперону, образуя полицистронную мРНК (рис. 21.10, в), трансляция которой в конечном итоге и приводит к синтезу трех ферментов.
На примере лактозного оперона был впервые расшифрован механизм регуляции генов прокариот, который, как оказалось, применим ко многим метаболическим путям. Триптофановый оперон (trp-оперон) клеток Е. соli, содержащий 5 структурных генов, необходим для образования трех ферментов, участвующих в синтезе триптофана. Он контролируется trp-белком-репрессором. Будучи связанным с триптофаном, этот белок блокирует оператор, препятствуя транскрипции мРНК.
Второй механизм регуляции trр-оперона вступает в действие в отношении тех молекул РНК-полимеразы, которым удается преодолеть репрессорный блок при высокой концентрации триптофана. Этот механизм называется аттенуацией.
У прокариот трансляция мРНК начинается задолго до завершения образования полной молекулы (после синтеза небольшого участка), и поэтому полимеразу сопровождает рибосома, осуществляющая трансляцию (механизм трансляции подробно изложен в следующей главе). Рибосома - это нуклеопротеиновая частица, которая движется вдоль мРНК, добавляя остатки аминокислот к растущей полипептидной цепи. Оперон первоначально кодирует так называемый лидерный пептид длиной 14 аминокислот. Он отличается от лидерного пептида, присоединяемого к определенным белкам (см. главу 22). Лидерный пептид аттенуации разрушается сразу же после образования. Он содержит 2 следующих один за другим остатка триптофана. Если молекул триптофана много, рибосома присоединяет их и движется дальше вдоль мРНК; если же триптофана недостаточно, то рибосома останавливается на триплетах триптофана в области аттенуации. Когда уровень триптофана позволяет рибосоме перейти этот участок при трансляции, пары нуклеотидов, образующиеся внутри частично синтезированной молекулы мРНК, формируют терминаторную шпильку - и транскрипция преждевременно заканчивается. Если же рибосома находится в области аттенуации (в отсутствие триптофана), она взаимодействует со спаривающимися основаниями, что позволяет полимеразе завершить транскрипцию оперона. Таким образом, уровень транскрипции регулируется содержанием триптофана. Чем триптофана меньше, тем больше молекул полимеразы способны провести полный синтез мРНК.
Известно, что аттенуация контролирует работу шести оперонов, ответственных за биосинтез специфических аминокислот. Среди них только trр-оперон обладает репрессорным контролем. У всех шести оперонов есть один и тот же чувствительный метод определения уровня своей аминокислоты в клетке, который заключается в присутствии множественных остатков данной аминокислоты в лидерном пептиде. В гистидиновом опероне этот пептид содержит 7 остатков гистидина.
Механизм контроля lас-оперона (и других оперонов) у бактерий подробно изучен. Он работает по-военному четко: САР связывается и способствует присоединению полимеразы, белок-репрессор связывается и блокирует транскрипцию, а индуктор ее разблокирует. Контроль транскрипции генов эукариот более сложен. Однако сначала нам необходимо рассмотреть процесс транскрипции у эукариотических генов.
Транскрипция генов и ее контроль у эукариот
Основные процессы, обусловливающие образование мРНК у эукариот
У эукариот составные части для синтеза РНК те же, что и у прокариот. Поэтому рис. 21.1, иллюстрирующий синтез РНК из 4 рибонуклеотидов на основе матрицы ДНК, полностью применим и для РНК эукариот. ДНК-зависимая РНК-полимераза, которая транскрибирует гены, кодирующие эукариотические белки, называется РНК-полимеразой II.(РНК-полимеразы I и III будут рассмотрены в главе 22, где описана транскрипция генов молекул РНК.)
Процесс инициации транскрипции генов эукариот сложен и будет рассмотрен в разделе, посвященном регуляции. Допустим, что инициация уже произошла. Это позволит нам познакомиться с образованием РНК у эукариот, которое отличается от разобранного нами выше процесса у прокариот.
Терминация транскрипции у эукариот
До сих пор непонятно: каким образом РНК-полимераза II осуществляет терминацию транскрипции у генов эукариот? Ведь в эукариотических генах нет ничего похожего на то, что соответствовало бы прокариотическим сигналам терминации. Когда РНК-полимераза II достигает 3'-ОН-конца гена, она синтезирует последовательность AAUAAA, кодируемую матричной цепью; после этого транскрипция продолжается, и только потом фермент каким-то образом завершает свою работу. Особый фермент отщепляет транскрипт РНК (за пределами уже упоминавшейся последовательности), а затем другой фермент, независимый от матрицы, осуществляет полиаденилирование, присоединяя (с использованием АТР) примерно 200 адениновых нуклеотидов, образующих поли-А-«хвост». У мРНК гистоновых белков такого хвоста нет, поэтому, возможно, он не имеет существенного значения для трансляции. Некоторые экспериментальные данные позволяют преположить, что полиаденилирование обеспечивает стабильность мРНК в клетке.
РНК-полимераза II кэпирует транскрибируемую РНК
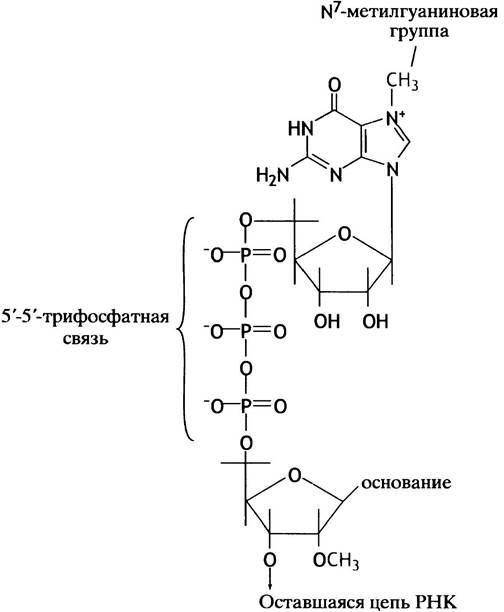
Сразу же после инициации синтеза РНК первичный транскрипт РНК гена эукариот претерпевает модификацию с 5'-конца, или кэпирование. На 5'-конце РНК есть трифосфатная группа: первый нуклеотидтрифосфат, включенный в РНК, просто принимает нуклеотид на свою 3'-ОН-группу, причем исходная трифосфатная группа остается неизменной. Концевой фосфат этой группы удаляется, его место занимает остаток вМР, переносимый от GТР (рис. 21.11). 5'-Трифосфатная связь встречается очень редко. Затем происходит метилирование G в положении N-7, а также 2'-ОН второго и иногда третьего нуклеотида. По причине формирования кэпа на первом нуклеотиде РНК стартовая точка гена (нуклеотид +1) часто обозначается как кэп-сайт. Считается, что кэп защищает конец мРНК от атаки экзонуклеазы и участвует в инициации трансляции.
Рис. 21.11. Структура 5'-кэпа у мРНК эукариот. Концевой нуклеозидтрифосфат первичного транскрипта РНК в ходе реакции с GТР превращается в дифосфат, при этом выделяется пирофосфат. Затем происходят реакции метилирования (третья метальная группа может быть присоединена к 2'-ОН следующего нуклеотида первичного транскрипта). После чего копированный первичный транскрипт достраивается до мРНК
Это различие в образовании мРНК у про- и эукариот не единственное, так как большинство генов эукариот относятся к прерывистым генам.
Что такое прерывистые гены?
За исключением коротких нетранслируемых 5'- и 3'-областей, протяженность мРНК прокариот и эукариот пропорциональна размеру кодируемых ими белков (или,
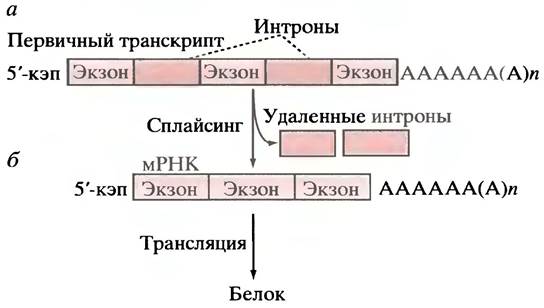
в случае полицистронных мРНК, - нескольких кодируемых белков). Это утверждение справедливо для первичного транскрипта мРНК бактерий, однако для большинства генов эукариот первичные транскрипты намного длиннее (иногда в 10 раз), чем можно было бы ожидать. Последнее обусловлено тем, что транслируемая в белок последовательность оснований РНК в молекуле мРНК разделена на несколько частей, связанных промежуточными участками, не кодирующими аминокислотные последовательности. Последовательности ДНК, с которых транскрибируются такие фрагменты, не несущие информации о структуре белков, получили название интронов, а кодирующие белок последовательности - экзонов. В гене человека может быть от 2 до 50 нитронов (рис. 21.12, а), длина которых варьирует от 50 до 20 000 пар оснований. Длина экзонов обычно не превышает 1000 пар оснований. Процесс удаления нитронов из первичного транскрипта и объединения экзонов с образованием зрелой молекулы мРНК называется сплайсингом (рис. 21.12,б). Хотя и принято считать, что интроны обычно не несут никакой информации, известно, что некоторые из них, например, энхансеры, содержат регуляторные последовательности (см. ниже).
Рис. 21.12. Первичный транскрипт РНК-полимеразой II гена эукариот. а - Интроны после кэпирования и добавления «хвоста» поли-А; б - удаление интронов с образованием зрелой мРНК называется сплайсингом
Механизм сплайсинга
Удаление интронов из первичного транскрипта РНК и соединение экзонов в молекулу мРНК - непростая задача. Ключом для ее решения является реакция трансэтерификации, в ходе которой фосфодиэфирная связь переносится на другую -ОН-группу. При этом не происходит ни гидролиза, ни значительной потери энергии:
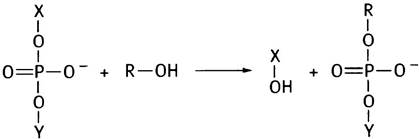
Если Х-Y - цепь РНК, то она будет разорвана.
Теперь мы подошли к вопросу созревания (процессингу) РНК - сплайсингу. Сочленения экзона с нитроном «помечены» консенсусными последовательностями. Все интроны начинаются с GU, а заканчиваются АG, хотя сами консенсусные последовательности длиннее. В приведенной реакции RОН в действительности является 2'-ОН-группой адениннуклеотида в интронной цепи (рис. 21.13). Эта группа атакует 5'-фосфат G-нуклеотида в месте соединения, образуя лассоподобную структуру. В результате происходит разрыв цепи с 3'-конца экзона 1 и освобождение 3'-ОН, который атакует 5'-конец экзона 2, соединяя оба экзона.
Рис. 21.13. Два этапа механизма сплайсинга мРНК. Поскольку сплайсинг осуществляется путем переноса фосфоэфирных связей, он не сопровождается потреблением энергии
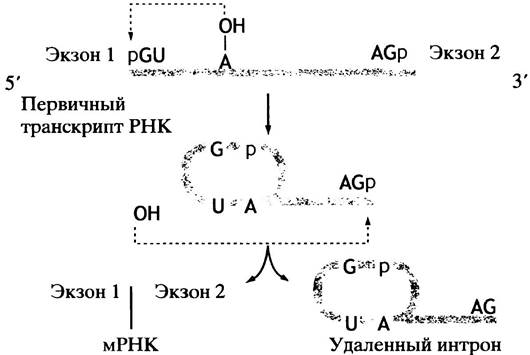
У большинства эукариот сплайсинг в ядре катализируют сложные рибонуклеопротеиновые частицы - сплайсосомы. Молекулы РНК этих частиц обозначают мяРНК - малая ядерная РНК.
По-видимому, мяРНК образуют гибридные молекулы путем спаривания с основаниями консенсусных последовательностей в местах сплайсинга на первичном транскрипте РНК и определяют местоположение подлежащих удалению интронов. Мутация в консенсусной последовательности может привести к неправильному
сплайсингу или к невозможности удаления интрона. При генетическом заболевании β-талассемии не происходит образования нормальных количеств β-цепи гемоглобина по причине замены с 5'-конца интрона G на А, и поэтому первичный транскрипт не преобразуется в зрелую мРНК должным образом.
У простейших Тetrehymena точный сплайсинг осуществляется без помощи белков самим РНК-транскриптом. На биохимиков этот факт произвел впечатление разорвавшейся бомбы: молекула РНК сама катализирует специфические химические реакции?! Ведь до этого подобные функции приписывали только белкам. Поэтому данное открытие ознаменовало начало новой эры в биохимии РНК и, кроме того, дало дополнительные аргументы в пользу некоторых эволюционных теорий, согласно которым первые формы жизни основывалась на РНК, а белки появились позднее.
Таким образом, первичный транскрипт кодирующего белок гена эукариот, образованный с участием РНК- полимеразы II, кэпируется, «подрезается», снабжается хвостом, подвергается сплайсингу - и только после этого выходит из ядра в виде зрелой мРНК.
Каков биологический статус интронов?
Биологический смысл существования интронов заключается в том, что они облегчают эволюцию. Подобно тому как исследования структуры белка выявили домены, генетические исследования выявили наличие экзонов: было обнаружено, что последние часто кодируют дискретные домены белка, хотя это соответствие и не всегда полное. Как уже отмечалось ранее (см. с. 47), считается, что новые белки появлялись в процессе эволюции в результате «тасования доменов». Согласно этой концепции, один и тот же домен может использоваться повторно, объединяясь с другими, так что новое семейство белков составляется из уже существующих доменов. Разделение частей гена на экзоны, кодирующие дискретные белковые домены, облегчает их тасование. Последнее обеспечивает более высокую скорость образования новых белков за счет рекомбинации, а не точечных мутаций ДНК, ведущих к заменам отдельных аминокислот.
Роль интронов в тасовании экзонов нуждается в разъяснении. Тасование экзонов может происходить в результате перегруппировки хромосомы. Последовательность ДНК, кодирующая белковый домен, должна оставаться интактной, и существование интронов с каждой стороны экзона может облегчить успешную транспозицию. Перестановка внутри области, кодирующей белковый домен, вероятно, нарушит его структуру и будет нежизнеспособной, поскольку каждый белковый домен (см. с. 47) представляет собой автономную структуру, которая может существовать в качестве дискретного объекта. Так, как интроны не несут кодирующих белок последовательностей, миграция генов сопровождается, вероятно, меньшим риском повреждения доменов и, следовательно, более успешным тасованием экзонов.
Каково происхождение прерывистых генов?
Существует две гипотезы. Согласно первой, непрерывный ген прокариот примитивен, а интроны появились в ходе эволюции позднее (модель «поздних интронов»). Но это не объясняет происхождение интронов.
Вторая гипотеза представлена в экзонной теории генов — моделью «ранних интронов». Она постулирует примитивность интронов, которые, возможно, представляли собой слившиеся, нетранскрибируемые фланкирующие области древних минигенов - «строительного материала» современных генов. Тот факт, что молекулы РНК могут обладать способностью к самосплайсингу, снимает вопрос о необходимости существования сложного механизма сплайсинга на ранних этапах эволюции. В соответствии с этой гипотезой, непрерывные гены прокариот рассматриваются как более поздний результат эволюции, облегчающий быстрое деление клеток.
Однако, если интроны были встроены в древние непрерывные гены беспорядочно, некоторые части генов, кодирующие белковые домены, могли бы приобрести интроны случайно, и они, удачно помещенные с каждой стороны этих генов, обеспечили бы успешное тасование экзонов. Если допустить, что подобное тасование дало эволюционное преимущество, то, вероятно, многие из современных генов, образовавшихся в результате тасования экзонов, должны автоматически демонстрировать соответствие между белковыми доменами и экзонами. В свете этого именно тасование, а не что-либо иное, привело к соответствию экзонов и доменов. Впрочем, это соответствие проясняет происхождение интронов.
Исследование нескольких древних генов, кодирующих белки, сохраненные в течение длительного эволюционного периода, не выявило соответствия между экзон-интронной структурой и структурными свойствами белков. Вероятно, эти факты дают аргументы против модели «ранних интронов» и указывают на примитивность непрерывных генов. Заметим, что тасование экзонов не оспаривается ни одной из гипотез. Это предмет другого обсуждения, не связанного с происхождением нитронов.
Прерывистые гены у прокариот могли бы создать сложные проблемы со сплайсингом, поскольку мРНК транслируется рибосомами с 5'-конца еще до того, как завершен синтез 3'-конца.
Альтернативный сплайсинг
Существует одно хорошо известное преимущество, которое дают прерывистые гены - альтернативный сплайсинг. При типичном сплайсинге все экзоны первичного транскрипта соединяются вместе с образованием зрелой мРНК. Однако известно много случаев, когда сплайсинг происходит по различным схемам: одна группа экзонов образует одну мРНК, а другая группа того же транскрипта гена - другую, что приводит в конечном счете к появлению различных белков. Такой механизм может быть применен для образования белков, необходимых в различных тканях или в одной ткани, но в разное время.
Механизм транскрипции генов эукариот и ее контроль
Хотя инициация транскрипции генов эукариот предшествует транскрипции, процессингу и т. д., мы отложили обсуждение этой темы до настоящего момента, поскольку она сложна и неотделима от проблемы контроля за активностью гена.
Распаковывание ДНК для транскрипции
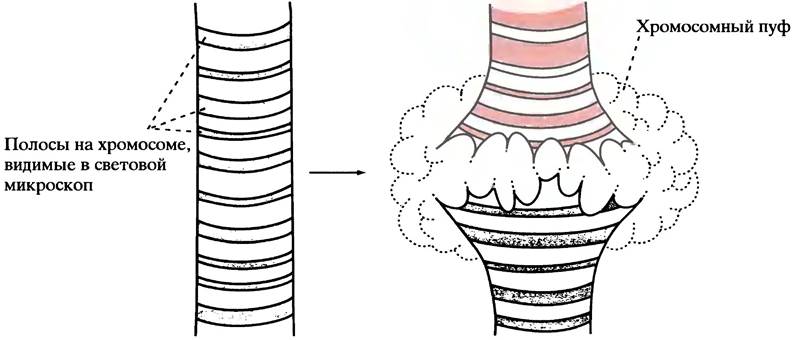
Напомним, что для размещения в ядре громадная молекула эукариотической ДНК должна быть хорошо упакована (см. с. 237). Перед транскрипцией (или во время нее) структура ДНК избирательно распаковывается в транскрибируемых участках. Известны два факта, свидетельствующие об избирательном распаковывании ДНК. Во- первых, в политенных хромосомах слюнных желез насекомых «распаковывание» ДНК можно увидеть в световом микроскопе. Поскольку эти уникальные хромосомы использовались в классических исследованиях, рассмотрим их в первую очередь.
Клетки слюнной железы личинок фруктовой мушки Drosophila велики и имеют необычную структуру. Хромосомы реплицируются около 1000 раз без деления клетки и лежат, выстроившись в линию, удлиненные и плотно упакованные. Такая упорядоченная структура под микроскопом имеет вид полос. В отдельной хромосоме их увидеть нельзя, однако при увеличении в тысячи раз они становятся различимыми. В процессе развития личинки экспрессируются последовательные группы генов, и можно наблюдать разуплотнение специфических полос (так называемых хромосомных пуфов) в ходе транскрипции ДНК (рис. 21.14).
Рис.21.14. Схематичное изображение хромосомных пуфов транскрипционно-активного хроматина политенных хромосом слюнных желез насекомых
Во-вторых, в экспериментах in vitro показано, что транскрипция генов эукариот связана с разрыхлением упаковки ДНК. Оказалось, что транскрипционноактивные области хроматина становятся более восприимчивыми к добавлению ДНКазы - фермента, гидролизующего ДНК. Известно, например, что гены глобина становятся особенно чувствительными к действию ДНКазы только в хроматине клеток, синтезирующих глобин, и только в момент активного транскрибирования.
Необходимость генетического контроля у дифференцированных эукариот
В клетке Е. coli имеется около 4000-5000 генов. В человеческой - 50 000-100 000. В клетке Е. coli большинство генов или все они экспрессируются во время деления. Несмотря на то, что lас-оперон, например, активен лишь при низкой концентрации глюкозы и в присутствии лактозы, каждой клетке Е. coli, в отличие от эукариот, заведомо необходима транскрипция всех генов.
У эукариот индукция определенных генов происходит под действием химических индукторов. В печени, например, фенобарбитал вызывает увеличение количества метаболизирующих его ферментов. Встречается и репрессия генов: холестерин, например, репрессирует первый фермент метаболического пути своего синтеза (см. с. 146). В большинстве своем подобные эффекты не столь критичны для жизнедеятельности клетки как, скажем, в случае lас-оперона, но все равно очень важны.
У животных имеется целый ряд гормонов и других регулирующих агентов, которые вызывают селективную модуляцию синтеза специфических белков, контролируя
транскрипцию их генов. Сложность таких регуляторных эффектов очень велика, и действительно, активность гена может контролироваться различными факторами (см. главу 26). Столь сложной регуляции у Е. coli не найдено.
У эукариот различные гены экспрессируются в разные моменты времени. Некоторые из них, так называемые гены домашнего хозяйства, экспрессируются постоянно и во всех тканях. Ферменты гликолиза, белки, необходимые для синтеза ДНК и белка, и т. д. нужны любым клеткам, так что гены «домашнего хозяйства» экспрессируются практически в каждой, кроме высоко специализированных клеток, например, зрелых эритроцитов. Другие белки необходимы только в специализированных тканях: незрелые красные кровяные клетки образуют гемоглобин; есть белки, специфичные для печени, мышц, почек и т. д. Каждый тип клеток одного организма содержат одинаковый набор генов. Это означает, что в мышечной клетке, например, экспрессируются только определенные гены. Однако проблема экспрессии тканеспецифичностью не исчерпывается: ведь в ходе эмбрионального развития на ранней стадии процесса дифференциации требуются одни гены, другие начинают работать позднее, в ходе развития отдельных тканей. Из этого следует, что гены эукариот, с одной стороны, могут экспрессироваться с постоянной скоростью конститутивно, с другой - подвержены множественному контролю различными гормонами и другими факторами.
Проблема заключается в том, что у прокариот можно «выключить» ген репрессором либо, в случае lас-оперона, - сАМР или лактозой. Но как осуществить множественную регуляцию гена эукариот?
Структура генов эукариот II типа
В этом разделе мы обсудим транскрипцию кодирующих белок генов, которые используют РНК-полимеразу II.
У эукариотических и прокариотических генов с 5'-конца стартового фрагмента существует промотор с короткой последовательностью между нуклеотидами -3 и +5, в так называемой области инициации (рис. 21.15). У 80 % генов есть ТАТА-бокс с центром в положении -25. Его последовательность напоминает бокс Прибнова в промоторе прокариот.
Рис. 21.15. Некоторые активирующие последовательности в области промотора гена эукариот, расположенные перед стартовой точкой
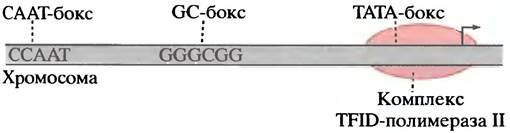
На расстоянии 100-200 пар оснований перед стартовой точкой располагаются короткие специфические последовательности ДНК, распознаваемые особыми белками -транскрипционными факторами: СААТ-боксом, GС-боксом и октамерным боксом (включающим 8 пар оснований). В различных генах они расположены в области между -100 и -200 нуклеотидами. Впрочем, есть и другие боксы, или элементы, ДНК - энхансеры. Они связывают транскрипционные факторы, ускоряющие транскрипцию гена. Энхансеры могут располагаться на расстоянии тысяч пар оснований от гена, поскольку их функционирование не зависит от ориентации в ДНК.
Все это делает определение промотора гена эукариот менее точным по сравнению с геном прокариот. Является ли удаленный энхансер частью промотора? Одно полезное рабочее определение дано в учебном пособии Льюина «Гены»: «Промотор эукариот включает последовательности ДНК, которые должны находиться в относительно фиксированных положениях по отношению к стартовой точке». Следовательно, промотор включает область инициации, ТАТА-бокс и боксы GС и СААТ, расположенные выше точки инициации, но исключает энхансеры.
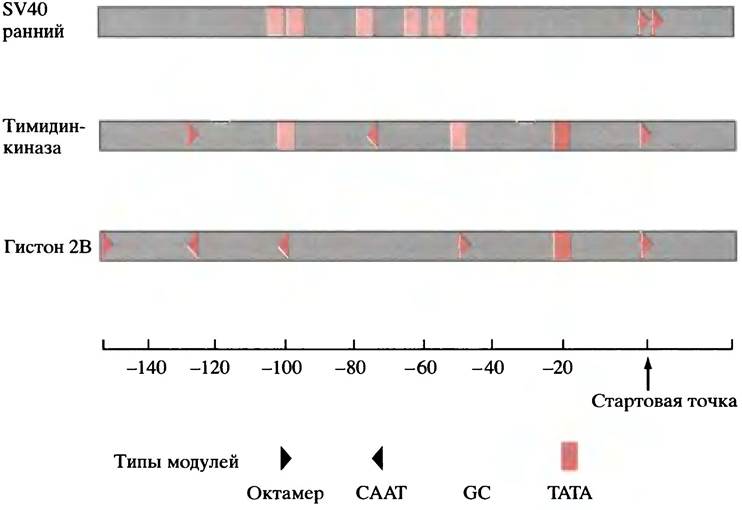
Одним из наиболее трудных для понимания аспектов является как бы сделанная наугад природа механизма генетического контроля у эукариот. Это подводит нас к замечательному и несколько смущающему заключению о том, что ни один из элементов не является обязательным для транскрипции и что различные гены имеют разные комбинации элементов. У 20% генов, включая многие гены «домашнего хозяйства», нет ТАТА-боксов, некоторые лишены и других элементов, или же у них существуют множественные копии одного и того же элемента. Вариации, найденные в трех образцах генов, приведены на рис. 21.16.
Рис. 21.16 Элементы промоторов трех генов эукариот. Промоторы содержат различные комбинации ТАТА-боксов, СААТ-боксов, GС-боксов и других элементов
Механизм инициации транскрипции генов эукариот
Стабильный комплекс инициации
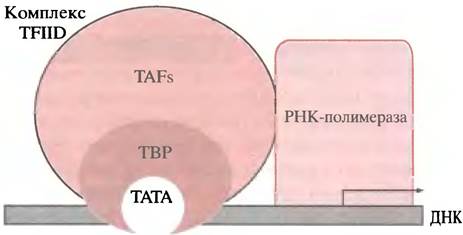
У бактерий РНК-полимераза узнает правильный сайт на промоторе и непосредственно связывается с ДНК, чему в ряде случаев способствует, например, САР. У эукариот для образования основного инициаторного комплекса на ДНК, необходимого для всех генов II типа, к которому присоединяется РНК-полимераза, требуется ряд белков - общих факторов транскрипции, присутствующих во всех клетках. К ним относятся: ТВР-белок (англ. ТАТА binding protein) присоединяющийся к ТАТА-боксу; с ТАТА-боксом связаны восемь и более TAF-белков (TBP-associated factors), образующих TFIID -комплекс (transcriptional factor D for polymerase II - фактор транскрипции D для полимеразы II); с TFIIDсвязывается РНК-полимераза II и другие белки, завершая образование основного инициаторного комплекса. Все это происходит у генов, имеющих ТАТА-бокс. У генов без ТАТА-бокса комплекс собирается в инициаторной области; при этом, возможно, для достижения правильного положения полимеразы используется другой фактор. Если гены транскрибируются полимеразами I и III, то собираются различные другие стабильные комплексы, которые мобилизуют соответствующую полимеразу.
Однако, как уже отмечалось, существуют различные гены. Некоторые из них, например, гены «домашнего хозяйства», экспрессируются постоянно, другие - тканеспецифичные - экспрессируются только в определенных клетках, третьи - индуцибельны (например, специфические гены, транскрипция которых активируется стероидными гормонами). Наконец, существуют гены, которые, наоборот, являются объектами негативного контроля, а некоторые - объектами для различных комбинаций указанных выше типов регуляции. Как же осуществляются все эти типы регуляции? Здесь уместно рассмотреть специфические факторы транскрипции, которые комбинируются с энхансером и элементами, расположенными перед стартовой точкой.
Какова роль транскрипционных факторов?
Все гены в хроматине (это ДНК, связанная с белками; см. с. 237) в отсутствие факторов транскрипции находятся в «выключенном», или репрессированном, состоянии, так как нуклеосома блокирует область инициации каждого промотора. До тех пор, пока нуклеосома не будет вытеснена (это позволит осуществить сборку инициаторного комплекса), ген не транскрибируется.
Рис. 21.17. Модель основного инициаторного комплекса для РНК-полимеразы II. Комплекс ТFIID включает ТАТА-связывающий белок (ТВР) и многочисленные ТАF-белки. Формы, размеры и положения компонентов указаны произвольно
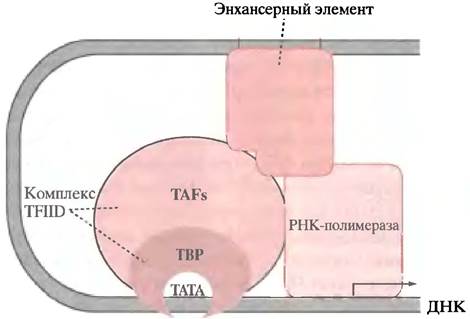
В активации одного и того же гена могут участвовать различные факторы транскрипции. Прежде всего к ним относятся факторы, которые связываются с боксами GС и СААТ, расположенными перед стартовой точкой. Они есть во всех клетках, и конститутивно экспрессирующиеся гены могут нуждаться только в них. Каким образом факторы транскрипции, связывающиеся с удаленными элементами, участвуют в формировании комплекса? Это может происходить в результате образования петли ДНК. Каждый фактор имеет по меньшей мере два участка связывания - один с ДНК, а другой с белками, участвующими в формировании транскрипционного комплекса, как показано на рис. 21.18.
Рис. 21.18. Гипотетическая модель, показывающая, каким образом белок, связывающийся с сайтом ДНК, удаленным от стартовой точки, может участвовать в инициации транскрипции РНК-полимеразой II. Участки взаимодействия между транскрипционным фактором, основным инициаторным комплексом и РНК-полимеразой нарисованы произвольно. Энхансерные элементы, расположенные за тысячи пар оснований, могут участвовать в образовании комплекса за счет механизма образования петли (см. рис. 21.19)
Каким образом осуществляется избирательный контроль экспрессии генов? Это функция элементов, расположенных в разных участках ДНК. Даже на расстоянии тысяч пар оснований они могут влиять на транскрипцию гена. Например, присутствие в ДНК удаленного энхансера увеличивает в сотни раз транскрипцию гена β-глобина.
Ген β-глобина экспрессируется только в незрелых эритроцитах; его транскрипция зависит от связывания транскрипционного фактора с GАТА-боксом. Данный фактор присутствует лишь в этих клетках, что и обеспечивает специфичность экспрессии.
Как регулируется скорость транскрипции индуцибельного гена? В качестве примера приведем активацию ряда генов стероидными гормонами.
В клетках-мишенях присутствуют неактивные факторы транскрипции. Они не способны самостоятельно связываться с соответствующими элементами ДНК. Гормон, поступающий в клетку, активирует фактор транскрипции, который затем связывается с ДНК, вызывая активацию транскрипции. Механизм активации этого фактора описан в главе 26, где мы познакомимся с клеточной сигнализацией, основным механизмом которой является активация факторов транскрипции. Отметим, что существует и негативный контроль транскрипции гена.
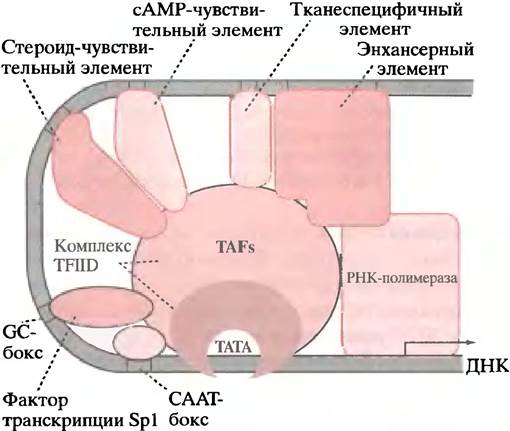
Основной вопрос - каким образом взаимодействие факторов транскрипции и инициаторного комплекса регулирует инициацию - остается пока без ответа. Важное свойство регуляции экспрессии генов эукариот - ее высокая гибкость; т. е. многие факторы могут внести свой вклад в регуляцию транскрипции при условии наличия для них соответствующего участка связывания на молекуле ДНК (рис. 21.19).
Рис. 21.19. Множественный контроль инициации транскрипции гена эукариот (схематично). Размеры, положение и взаимодействие белков, а также комбинация регуляторных элементов - условны
Структура ДНК-связывающих белков
Из изложенного в этой главе становится понятной важная роль белков, связывающихся со специфическими участками ДНК. Существуют многочисленные репрессоры и факторы транскрипции, участвующие в процессе дифференцировки, эмбрионального развития и т. д. Эффективность их действия зависит от способности этих соединений узнавать ДНК и связываться с ней.
Для выяснения структуры белков, взаимодействующих с соответствующими участками ДНК, были предприняты широкомасштабные исследования. Оказалось, что на основании структурных характеристик большинство ДНК-связывающих белков может быть сгруппировано в несколько семейств, среди которых наиболее важными являются белки с мотивами «спираль-поворот-спираль», гомеодоменные белки, белки со структурами типа «лейциновой молнии» и, наконец, белки с мотивами «цинковые пальцы».
Структуры, или мотивы, давшие эти названия, представляют собой лишь небольшие участки белков, характеризующие все семейство. Например, на рис. 21.20 показан только характерный для всего семейства фрагмент «спираль-поворот-спираль» мономера ДНК-связывающего белка.
Рис. 21.20 Фрагмент одного из ДНК-связывающих белков и его взаимодействие с ДНК. а - Фрагмент «спираль-поворот-спираль»; б - связывание этого белка с ДНК в больших бороздках
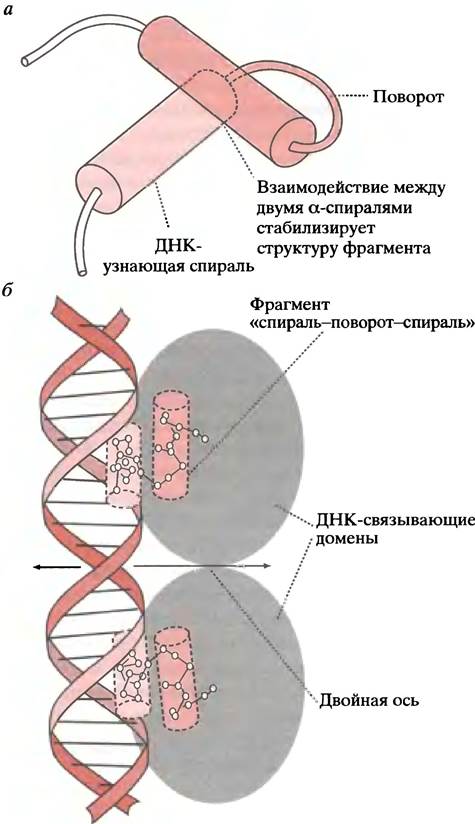
ДНК-связывающие белки присоединяются к двухцепочечной ДНК; сайт-специфическое связывание происходит за счет взаимодействия между боковыми цепями аминокислотных остатков и основаниями ДНК. Дополнительная стабилизация может достигаться связыванием с сахарофосфатным скелетом. Контактные взаимодействия узнающих мотивов белка с азотистыми основаниями происходят преимущественно в большой бороздке двойной спирали, куда экспонированы некоторые атомы азотистых оснований. Во многих случаях такое связывание обусловлено узнаванием а-спирали белка, которая укладывается в большую бороздку.
Важно отметить, что для специфического присоединения белка на молекуле ДНК необходимо наличие двух соседних участков. Они могут быть идентичными, образованными палиндромным расположением оснований (см. ниже) или различаться. С палиндромными участками способны связываться, например,
белки-гомодимеры, состоящие из двух одинаковых субъединиц, а с другими - белки-гетеродимеры, состоящие из различных субъединиц. На белках с фрагментами «цинковые пальцы» могут располагаться множественные ДНК-узнающие мотивы.
Сущность вариабельного контроля гена состоит в том, что ДНК-связывающие белки, например, факторы транскрипции и репрессоры, во многих случаях взаимодействуют с ДНК только после соответствующего «инструктажа». Мы уже познакомились с ситуациями, при которых активация транскрипционного фактора достигается аллостерической модификацией регуляторного белка при связывании лиганда (вспомним регуляцию lас-оперона). У эукариот такая «инструкция» обычно приходит в виде внешнего внеклеточного сигнала, скажем, гормона или фактора роста. Подобные механизмы активации факторов транскрипции рассмотрены в главе 26.
Теперь рассмотрим семейства ДНК-связывающих белков.
Белки с мотивом «спираль-поворот-спираль» (НТН)
Это первое идентифицированное семейство ДНК-связывающих белков. У прокариот обнаружено много белков такого типа, например, лямбда-репрессор. Бактериофаг лямбда Е. coli описан нас. 314. Мы не будем разбирать здесь роль белка-репрессора - это довольно сложно; скажем только, что он связывается с определенной областью ДНК фага лямбда и участвует в «принятии решения» о вхождении инфицирующего вируса в литический или лизогенный циклы (разъяснения см. на с. 314—315). Сейчас гораздо важнее, что механизм его связывания с ДНК изучен очень подробно.
Как мы уже объясняли, мотив «спираль-поворот- спираль» (англ. helix-turn-helix, НТН) представляет собой небольшой участок белка, с помощью которого происходит связывание с операторным участком ДНК. (Это не домен белка, и он не может существовать сам по себе при выделении; мотив означает узнаваемое структурное свойство). Мотив включает две α-спирали, соединенные β-изгибом. Одна из спиралей (узнающая) располагается в большой бороздке ДНК (см. рис. 21.20, а). Оператор или ДНК-узнающий участок представляет собой неполный палиндром. Палиндромом называют фразу или слово, которые можно одинаково прочесть слева направо или справа налево. Например, фраза «Madam I′m Adam» симметрична относительно буквы «I» (в русском языке в качестве примера можно привести фразу «ум его Бог ему»; прим, переводчика.). Палиндромные ДНК-связывающие участки имеют парную симметрию (когда две единицы действуют как одна или как группа из двух). Ниже показана структура оператора.
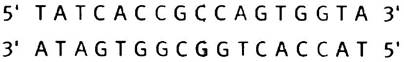
Две половины палиндрома представляют собой идентичные участки связывания, хотя нуклеотиды показывают, что палиндром не абсолютен. Белок-репрессор - это димер, узнающие спирали двух фрагментов НТН которого подходят к данным нуклеотидам (см. рис. 21.20, б).
Белки, содержащие «лейциновую молнию»
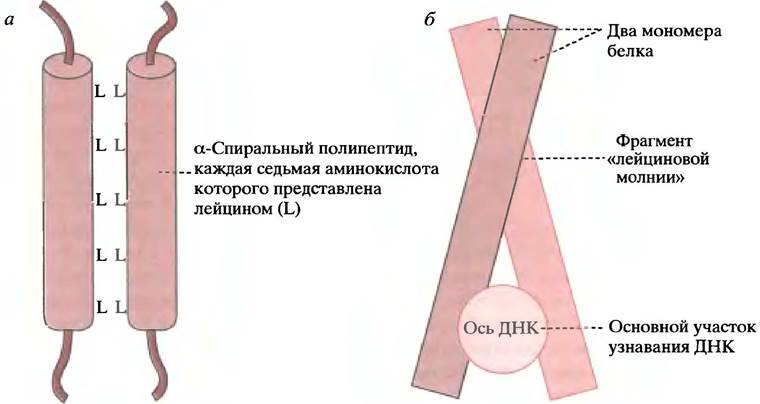
Обнаружены среди многочисленных факторов транскрипции эукариот. В данном случае название обозначает не фрагмент узнавания (как у НТН-белков), а характерную структуру, которая вызывает димеризацию двух субъединиц (последние могут и не иметь идентичных участков узнавания). Во фрагменте «лейциновой молнии» каждая седьмая аминокислота представлена лейцином. Поскольку виток образуют 3,6 аминокислотных остатка, все остатки лейцина появляются на одной стороне α-спирали, формируя гидрофобную поверхность. Две таких субъединицы соединяются за счет гидрофобных взаимодействий между боковыми цепями лейцинов (рис. 21.21, а). Кстати говоря, термин молния - неверен. Он был предложен, когда предполагали, что остатки лейцина переплетаются подобно зубцам застежки-молнии. В действительности ДНК-связывающим участком каждого мономера является область, богатая остатками положительно заряженных аминокислот - аргинина и лизина. Образно говоря, димер присоединяется к ДНК у рукоятки «ножниц», располагаясь между двумя «лезвиями» в соседних сегментах большой бороздки дуплекса (рис. 21.21, б).
Рис. 21.21. Белки, содержащие «лейциновую молнию». а - Строение фрагмента «лейциновой молнии». Гидрофобные остатки лейцина располагаются друг против друга, но не переплетаются подобно зубцам на молнии; б - прикрепление к ДНК белка, содержащего «лейциновую молнию» (вид вниз по оси ДНК)
Белки с мотивом «цинковые пальцы»
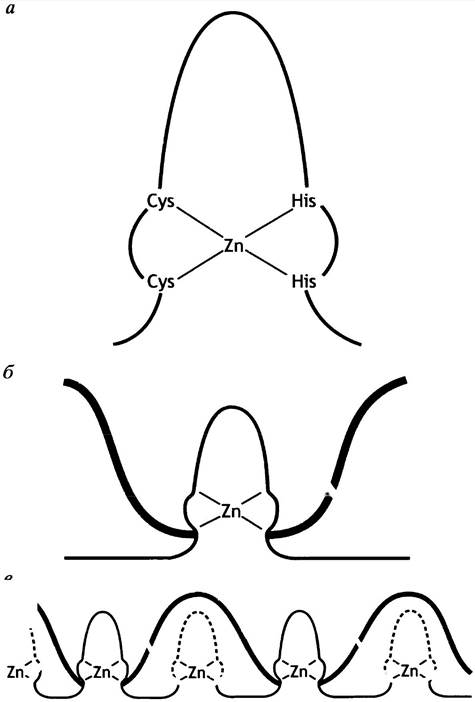
В этом ДНК-связывающем мотиве атом цинка, соединенный с 2 остатками гистидина и 2 остатками цистеина, стабилизирует пальцеподобную структуру (рис. 21.22, а), одна часть которой является узнающей α-спиралью, располагающейся в большой бороздке ДНК (рис. 21.22, б). Факторы транскрипции могут иметь несколько таких пальцев, обусловливающих множественные контакты с ДНК (рис. 21.22, в). Один такой белок-регулятор гена имеет около 30 цинковых пальцев. Не все цинковые пальцы специфически связываются с ДНК. Некоторые из - них неспецифичны, но они помогают стабилизировать специфическое связывание. Мотив «цинковые пальцы» характерен для многих регуляторных белков различных эукариотических генов, например, для внутриклеточных рецепторов стероидных гормонов.
Гомеодоменные белки и эмбриональное развитие
Расшифровка механизма процесса дифференцировки и эмбрионального развития - одна из важнейших задач биологии. Оплодотворенное яйцо многоклеточного организма делится и дифференцируется в различные ткани: эпидермис, нервы, мышцы, печень и т. д. Поскольку каждая клетка имеет один и тот же набор генов, дифференцировка включает селективную экспрессию генов в различных тканях. О том, как это происходит, до сих пор известно немного. Однако несколько лет назад было идентифицировано несколько гомейотических генов, ответственных за правильное эмбриональное развитие. Их важность была установлена в ходе изучения влияния мутаций в этих генах на развитие плодовой мушки дрозофилы. Важным в рассматриваемом контексте моментом является то, что продукты гомейотических генов - все кодируемые ими белки - имеют сходные домены, именуемые гомеодоменами. Участки ДНК, кодирующие такие гомеодомены, называются гомеобоксами. Гомеодомены - это ДНК-узнающие белки длиной около 60 аминокислотных остатков; они напоминают фрагмент «спираль-поворот-спираль» с узнающей спиралью, расположенной в большой бороздке. Кодируемые гомейотическими генами белки связываются со специфическими участками ДНК. Поэтому можно предположить, что гомейотические гены кодируют факторы транскрипции. Хотя гены-мишени еще не известны, установлено, что в ряде случаев эти факторы служат активаторами одних генов и репрессорами других. Структура гомеодоменов характеризуется высокой степенью консервативности и высокой степенью сходства у насекомых (дрозофила) и позвоночных, включая человека.
Рис. 21.22. Белки с мотивом типа «цинковые пальцы» а - Структура «цинкового пальца»; б - модель взаимодействия между областью мишени в ДНК и белком, содержащим «цинковый палец». Одна сторона структуры «пальца» представляет собой α-спираль: она прикрепляется к большой бороздке ДНК; в - множество фрагментов типа «цинковых пальцев», связанных с ДНК
А теперь определимся с терминологией. Если речь идет о транскрипции, термин бокс обычно ассоциируется с последовательностью ДНК, узнаваемой белком (например, рассматриваемые ранее боксы ТАТА и GС). Слово бокс при обсуждении генов гомеобокса обозначает последовательность оснований, кодирующих гомеодомен. В этом случае данный термин несет совершенно иную смысловую нагрузку, хотя и в первом, и во втором примере речь идет о специфических участках ДНК.
Стабильность мРНК и контроль экспрессии генов
Хотя значение регуляции транскрипции при экспрессии генов очень велико, стабильности индивидуальных мРНК отводится не менее важная роль. Чаще всего скорость синтеза белка отражает количество образовавшейся мРНК, за исключением тех случаев, когда трансляция мессенджера (мРНК) контролируется способом, описанным для синтеза аминолевулинатсинтазы эритроцитов и глобина (см. с. 366 и 367 соответственно). Уровень мРНК в клетках зависит от соотношения скоростей ее синтеза и распада. При определенной скорости образования мРНК ее содержание в клетке будет тем выше, чем длиннее время ее полужизни, что, естественно, приводит к более высокой скорости синтеза соответствующего белка. Механизмы, влияющие на время полужизни мРНК, представляют, таким образом, способ регуляции экспрессии гена.
Время полужизни мРНК прокариот обычно ограничено 2-3 минутами. Быстрый оборот мессенджера позволяет оперативно реагировать на изменения среды. У млекопитающих время полужизни индивидуальных мРНК составляет от 10 минут до 2 дней. Время полужизни одной из самых стабильных мРНК (мРНК глобин) составляет около 10 часов. Регуляторные белки обычно кодируются короткоживущими мРНК, так что изменения скорости транскрипции их генов быстро отражается на скорости их экспрессии. Время полужизни мРНК факторов транскрипции обычно составляет менее 30 минут. Таким образом, клетка содержит мРНК, скорость деградации которых различна, а стабильность отдельных мРНК может изменяться.
Несмотря на потенциальную важность стабильности мРНК, процесс ее распада изучен в гораздо меньшей степени, чем синтез и его регуляция. Немного известно
и о ферментах, участвующих в процессе распада, однако некоторые механизмы, определяющие продолжительность жизни мРНК, уже установлены.
Структуры, определяющие стабильность мРНК и их роль в регуляции экспрессии
Почти все мРНК имеют поли-А-«хвост», присоединяющийся к З3'-концу перед выходом молекулы РНК из ядра (рис. 21.23, а) исключение составляют мРНК гистонов. Считается, что поли-А-«хвост» защищает мРНК эукариот от быстрой деградации. Деаденилирование часто предшествует деструкции мРНК. Уже обнаружен белок, который связывается с «хвостом» поли-А, тормозя тем самым распад мРНК с 3'-конца молекулы, но механизм, посредством которого поли-А защищает мРНК, детально не выяснен. Предполагают, что поли-А влияет на транспорт, трансляцию и распад мРНК.
У мРНК гистонов поли-А-«хвост» отсутствует, и стабильность этих молекул определяется крайней шпилечной петлей на 3'-конце (рис. 21.23, б). Синтез гистонов необходим только во время S-фазы клеточного цикла эукариот, когда происходит синтез ДНК и сборка нуклеосом. Гены гистонов транскрибируются во время S-фазы клеточного цикла, но в С2-фазе этот процесс прекращается - и уровень мРНК гистонов быстро падает. Последнее частично обусловлено остановкой транскрипции, но кроме того происходит сокращение времени полужизни мРНК с 40 до 10 минут, которое зависит от присутствия шпилечной петли на 3'-конце. Перенос последней на мРНК глобина приводит к образованию гибридного мессенджера, который после введения в культивируемые клетки дестабилизируется в конце S-фазы, подобно мРНК гистона. Для дестабилизации мРНК гистонов необходимо присутствие свободных мономеров гистонов, которые накапливаются вскоре после окончания синтеза ДНК (и, следовательно, сборки нуклеосом) в конце S-фазы. Быстрое выключение синтеза гистонов необходимо по причине цитотоксичности их мономеров. Четырехкратное уменьшение времени полужизни гистоновых мессенджеров означает, что после прекращения транскрипции гена гистона процесс деградации мРНК длится в течение 2 часов, а без дестабилизации он занимает около 9 часов (рис. 21.24).
Рис. 21.23. Организация структур, присутствующих в нетранслируемой области 3'-конца (untranslated region, UTR) мРНК млекопитающих, которые влияют на время полу- жизни молекул в клетке. а - «Хвост» поли-А найден в большинстве мРНК эукариот; б - шпилечная петля, обнаруженная у гистоновых мРНК; в - железо-чувствительный элемент (iron-responsive element) мРНК трансферрина; г-AU-элемент (AU-rich element, AURE) найден у большого числа нестабильных мРНК эукариот
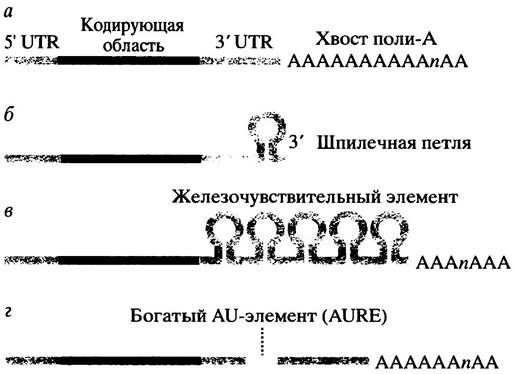
Рис. 21.24. Влияние четырехкратного уменьшения времени полужизни мРНК на ее количество в клетке после прекращения синтеза
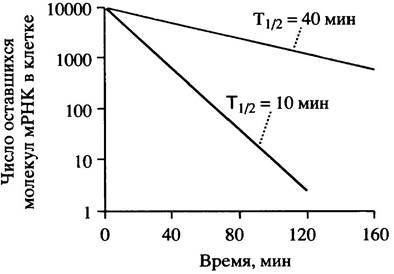
Синтез β-тубулина регулируется при помощи механизма обратной связи, модулирующего стабильность мРНК. В главе 29 описана роль агрегации этого белка и ее влияние на формирование микротрубочек. Присутствие мономеров свободного тубулина дестабилизирует его мРНК. Для того, чтобы происходила деградация, мРНК должна участвовать в процессе трансляции, поскольку частично синтезированный пептид каким-то образом способствует процессу дестабилизации. Механизм вызываемого посредством тубулина распада мРНК пока непонятен, но регуляторный смысл этой системы очевиден.
Синтез рецепторного белка трансферрина представляет еще один пример того, как стабильность мРНК регулирует синтез белка. Рецептор ответственен за транспорт железа в клетки (см. с. 368). В 3'-нетранслируемой области мРНК есть группа из пяти шпилечных петель, называемая железочувствительным элементом (англ. iron-responsiveelement, IRE) (см. рис. 21.23, в). В отсутствие железа IRE-связывающий белок присоединяется к IRE и стабилизирует мРНК, увеличивая тем самым синтез рецептора и повышая поступление железа в клетку. При избытке железа происходит образование комплекса железа с этим белком, в результате последний не связывается с IRE, что, как полагают, делает эту область доступной для эндонуклеазы.
Короткоживущие мРНК могут содержать так называемые последовательности нестабильности, которые служат сигналом для быстрой деградации мРНК в клетке. Структурной особенностью многих нестабильных мРНК является существование богатых аденином и урацилом элементов (англ. adenine/uracil-rich elements', AURE) в 3'-нетранслируемых областях молекул (см. рис. 21.23, г). Эти элементы в разных мРНК различны, однако у каждого из них есть последовательности AU длиной по меньшей мере в 9 оснований. Они вызывают дестабилизацию мРНК, возможно, при помощи AURE-связывающих белков. До сих пор неизвестно, как AURE функционируют. Их влияние на время полужизни мРНК может быть непрямым, обусловленным воздействием на трансляцию; впрочем, присутствие AURE всегда ассоциируется с быстрым деаденилированием мРНК. Особенно интересный пример представляет мРНК - продукт гена c-fos, который кодирует факторы транскрипции, содержащих лейциновую молнию. Эта мРНК имеет в нетранслируемой области AURE (термины c-fos, v-fos и онкогенность объяснены на с. 356). Ген v-fos является сильным онкогеном, вызывающим развитие рака; у мРНК этого гена нет AURE, найденного у мРНК c-fos, и время полужизни в клетке дольше, чем у мРНК c-fos. При делеции области AURE нормальный ген c-fos превращается в онкоген. (О взаимосвязи регуляторных белков с онкогенностью см. главу 26).
Механизм, определяющий стабильность мРНК в клетке, сложен. В дополнение к изложенному выше, отметим, что ряд гормонов модулирует стабильность специфических мессенджеров. В заключение добавим, что регуляция распада мРНК представляет собой один из важных методов контроля за экспрессией гена.
Транскрипция гена в митохондриях
В предыдущих главах уже рассматривалась центральная роль митохондрий в выработке энергии в ходе окисления поступающих с пищей субстратов. Митохондрии -реплицирующиеся органеллы клеток эукариот. У них есть собственная ДНК и белоксинтезирующий аппарат (так же, как и у хлоропластов). Митохондрии делятся; поэтому в разных клетках поддерживается определенное число этих органелл: около 1000 в гепатоците крысы и 107 в овоците лягушки. Митохондриальная ДНК у млекопитающих обычно представляет собой кольцевой дуплекс, содержащий менее 20 000 нуклеотидов; в каждой митохондрии может быть представлено 5 или 10 копий такого дуплекса.
Митохондриальная ДНК кодирует лишь небольшую часть белков этих органелл; остальные белки кодируются ядерной ДНК. Белки синтезируются в цитоплазме и транспортируются в митохондрии (см. главу 22). В митохондриях обе цепи ДНК полностью транскрибируются в линейные длинные транскрипты (молекулы полимеразы движутся в противоположных направлениях, так как синтез всегда происходит в направлении 5' —> 3'). Эти первичные транскрипты (непонятным пока образом) подвергаются процессингу с образованием мРНК, тРНК и рРНК. Чтобы образовалось больше рРНК, производится много более коротких транскриптов, окружающих гены рРНК.
В отличие от синтеза белка в цитоплазме (цитоплазматическая трансляция), трансляция в митохондриях обладает рядом особенностей, свойственных прокариотам. Отсюда возникло предположение о том, что митохондрии появились в результате поглощения эукариотическими клетками прокариотических, ставших симбионтами (аналогичная теория объясняет происхождение хлоропластов в растительных клетках). Свойства митохондриальной системы транскрипции и в самом деле представляют собой смесь прокариотических и эукариотических типов. В митохондриях млекопитающих мРНК полиаденилированы (что характерно для эукариот), но не кэпированы (свойство прокариот), и (как у прокариот) в митохондриальных генах нет интронов.
В митохондриях трипаносом образующиеся мРНК подвергаются последующему редактированию. Транскрипты РНК обладают дополнительными и, расположенными в особых местах для образования правильной последовательности, кодирующей белки. Эти и не были предусмотрены в ДНК. Позже было обнаружено, что редактирование мРНК может происходить и в ядерных транскриптах. В результате транскрипции гена аполипопротеина В млекопитающих (см. с. 96) из одного транскрипта образуется две мРНК. «Нередактированная» мРНК кодирует апопротеин В100, а меньший аполипопротеин В48 кодируется «отредактированной» версией, где соответствующий С из ДНК конвертируется в и с образованием трансляционного стоп-кодона (см. главу 22).
Вирус обезьян (гены которого обладают свойствами генов эукариот) образует мРНК, которые редактируются путем инсерции (встраивания) двух остатков G, не закодированных в ДНК. Пока неясно, имеют ли эти вариации биологический смысл или же представляют собой пример эволюционного «ремесленничества».
Гены, не кодирующие белки
Помимо генов, ответственных за синтез белков, имеются гены, кодирующие особые молекулы РНК, которые не являются мессенджерами. В следующем разделе вы узнаете, что белки синтезируются нуклеопротеиновыми частицами - рибосомами и что для построения полипептидных цепей из аминокислот необходимы небольшие многочисленные транспортные РНК (тРНК). Рибосомы содержат молекулы рибосомных РНК (рРНК); у прокариот они содержат 3 различных молекулы рРНК, а у эукариот - 4 молекулы. При транскрипции около половины от общего количества РНК приходится на долю рРНК. Поскольку тРНК и рРНК по сравнению с мРНК живут долго, большая часть РНК в клетке представлена именно этими формами. В клетках Е. coli три рРНК и несколько тРНК транскрибируются вместе в виде большой молекулы предшественника, которая затем разрезается на соответствующие более мелкие фрагменты. В отличие от прокариот, у эукариот существует три РНК-полимеразы.
РНК-полимераза II, которая транскрибирует гены, кодирующие белки, уже была описана. РНК-полимераза I транскрибирует большую часть рРНК, а РНК-полимераза III - тРНК и более мелкие рРНК. Поскольку клетке нужно много тРНК и рРНК, существуют множественные копии их генов. У эукариот могут быть сотни и тысячи генов рРНК, организованных в виде тандема - голова к хвосту; они находятся в нуклеолярных областях ядра. Гены, транскрибируемые полимеразой III, необычны тем, что регуляторные элементы, или боксы, встречаются не только с 5'-конца стартовой точки ДНК, но также в транскрибируемой области, а именно после стартовой точки.
Вопросы к главе 21
1. Каковы отличия синтеза РНК от синтеза ДНК?
2. С помощью схем опишите компоненты гена Е. coli и фланкирующих областей.
3. Опишите процесс инициации транскрипции гена Е. coli.
4. Опишите два способа терминации транскрипции гена Е. coli.
5. Какие факторы определяют силу промотора у конститутивного гена Е. соli
6. Опишите регуляцию lас-оперона.
7. Опишите основные отличия между образованием РНК у эукариот и прокариот.
8. Пользуясь схемами, объясните механизм сплайсинга. Какова возможная биологическая роль существования интронов?
9. Каковы отличия инициации транскрипции у эукариот сравнительно с прокариотами?
10. Какие семейства факторов транскрипции выделены на основе сходства структурных мотивов?