БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 26. ХИМИЧЕСКАЯ СИГНАЛИЗАЦИЯ В ОРГАНИЗМЕ
В главе 12 мы уже обсуждали регуляцию метаболизма внешними факторами, обеспечивающими сообщение между клетками. Жизнедеятельность каждой отдельной клетки подчинена нуждам организма как единого целого. Животное не может существовать без сложной системы межклеточных коммуникаций, которые осуществляются через разнообразную систему команд.
Теперь выяснилось, что внешнее управление клетками намного сложнее, чем это можно было представить. Механизмы, осуществляющие отдельные виды регуляции, известны, однако до конца неясно, как все регуляторные факторы объединяются в единую систему в целом организме или хотя бы в отдельной клетке. Сообщение между клетками обеспечивают сигнальные молекулы. Они выделяются из одних клеток и мигрируют к другим, снабженным рецепторами, способными воспринимать эти сигналы. Это - клетки-мишени. Связывание сигнальной молекулы с рецептором приводит к биохимическому ответу клетки.
Сигнал может передаваться при непосредственном контакте между двумя клетками. Как пример можно привести активацию хелперной Т-клетки (см. главу 25) антиген-представляющей клеткой. Наличие щелевых контактов или регулируемых пор между соседними клетками позволяет молекулам мигрировать от одной клетки к другой, осуществляя прямое сообщение между цитоплазмами и координируя клеточные функции. В это главе мы разберем следующие вопросы.
✵ Какие виды клеточной активности контролируются внешними сигналами?
✵ Какие типы сигнальных молекул участвуют в химической сигнализации?
✵ Какие клетки выделяют сигнальные молекулы. Каким образом контролируется их выделение и как они доходят до своих клеток-мишеней?
✵ Как клетки-мишени распознают сигналы?
✵ Как клетка отвечает на принятый сигнал?
Какие виды клеточной активности регулируются внешними сигналами?
Для удобства их можно разделить на две группы.
Регуляция, не затрагивающая экспрессию гена. Примерами служат: изменение активности ферментов, участвующих в метаболизме жиров и углеводов
(см. главу 12); активация произвольного сокращения поперечнополосатой мышцы ацетилхолином (см. главу 28); открытие лиганд-зависимых пор в мембранах нервной клетки при включении нервного импульса (рис. 26.24).
Регуляция, затрагивающая экспрессию генов. Большинство факторов внешнего управления действуют именно этим способом. Поскольку регуляция экспрессии гена влияет практически на все процессы, протекающие в клетках, список таких процессов безграничен. У животных контроль экспрессии генов осуществляется главным образом на уровне инициации транскрипции гена, и это, в свою очередь, зависит от активности специфических факторов транскрипции (см. с. 267).
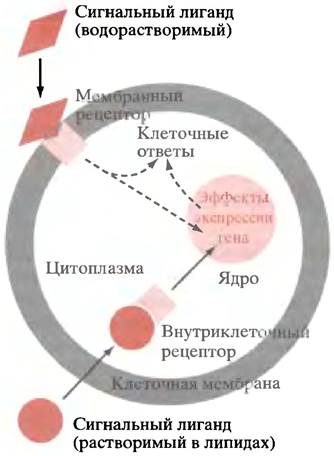
Таким образом, основная часть этой главы касается механизмов, посредством которых факторы внешнего управления влияют на транскрипцию специфических генов. Большинство внешних сигнальных молекул, доставляя свои сигналы, не входят в клетку, а взаимодействуют с внешними доменами мембраносвязанных рецепторов. Поэтому возникают вопросы: как сигналы, воспринимаемые снаружи клеточной мембраны, приводят к определенным событиям внутри клетки (трансмембранная передача сигнала)? Как сигнал, генерируемый на цитоплазматической стороне мембраны, передается к контролируемому участку? В случае контроля гена это означает передачу сигнала от цитоплазматической мембраны к ядру клетки (рис. 26.1). Кроме того, небольшое число растворимых в липидах сигнальных молекул могут проходить через липидный бислой внутрь клетки, где они контактируют с внутриклеточными рецепторами, участвующими в регуляции гена (см. рис. 26.1).
Рис. 26.1. Рецептор-опосредованная сигнализация. Водорастворимые сигнальные молекулы не могут пройти сквозь липидный бислой. Они связываются с внешними доменами рецепторов. Растворимые в липидах сигнальные молекулы, например, стероиды и тироксин, непосредственно поступают в клетку и связываются с внутриклеточными рецепторами. Некоторые внутриклеточные рецепторы находятся в ядре; стероидные рецепторы после связывания с лигандом двигаются в ядро. В случае оксида азота внутриклеточный рецептор вырабатывает сGМР, который может вызывать прямые метаболические эффекты
Что такое сигнальные молекулы?
С химической точки зрения - это белки, большие и маленькие пептиды, стероиды, эйкозаноиды, катехоламины, тироксин и оксид азота. К числу первых шести групп веществ относятся: инсулин, глюкагон, вазопрессин, половые гормоны, простагландины и адреналин.
Биологическая классификация включает следующие группы регуляторов:
1) гормоны;
2) факторы роста и цитокины;
3) нейромедиаторы.
Гормоны
Это «классические» сигнальные молекулы, большинство из которых известно давно, вероятно потому, что в организме они находятся в относительно больших количествах. Гормоны образуются клетками, специализирующимися на их продукции и собранными в железы, секретирующие гормоны прямо в кровоток, а не в протоки, сообщающиеся с внешней средой (как это происходит при секреции панкреатических пищеварительных ферментов в кишечник). Поэтому эндокринные железы называют еще беспроточными железами. Гормоны «находят» свои клетки-мишени при помощи системы кровообращения, достигая тканей, расположенных на значительном удалении от гормон-секретирующей железы. Известно большое число гормонов и подробно описаны их биологические эффекты. Основные гормоны и оказываемое ими действие приведены в таблице 26.1.
Факторы роста
В недавно опубликованной статье было выдвинуто предположение о том, что этому классу сигнальных молекул больше подходит название регуляторные факторы развития, поскольку их роль становится понятнее, если рассматривать их в качестве регуляторов развития, а не факторов, стимулирующих рост клеток.
Факторы роста - это регуляторные белки, выделяемые клетками той же ткани, к которой они принадлежат, например, гепатоцитами, лимфоцитами и т. д. Факторы роста взаимодействуют с наружным рецептором клетки. Первым был открыт фактор роста из тромбоцитов (PDGF; от англ. platelet-derived growth factor), который, как оказалось, образуется и во многих других клетках. Другой классический пример - фактор роста эпидермиса (EGF; от англ. epidermal growth factor). Обнаружено много разнообразных факторов. Около 20 из них участвуют в регуляции развития гемопоэтических клеток в костном мозге. Многие факторы роста являются колоний-стимулирующими факторами (CSF; от англ. colony-stimulating factors), или интерлейкинами. Свое название они получили за стимулирование роста колоний определенных лейкоцитов в экспериментальных условиях. Интерлейкинами они названы «в честь» лейкоцитов, влияющих посредством секреции на другие лейкоциты. Большинство факторов роста были открыты благодаря их митогенному (ростовому) влиянию на клетки, однако действие факторов роста гораздо сложнее. При определенных ситуациях один и тот же фактор может стимулировать или ингибировать клеточную дифференцировку, оказывая совершенно различное воздействие на одну и ту же клетку. Вот почему термин фактор регуляции развития представляется более уместным для описания этих регуляторов, но мы будем использовать общепринятый - факторы роста.
Термин цитокин используется иммунологами для факторов роста, участвующих в иммунном ответе.
Несмотря на разнообразие биологических эффектов, все факторы роста взаимодействуют с внешними рецепторами клетки и опосредованно влияют на инициацию транскрипции специфических генов.
Чем кроме характеристик, упомянутых выше, фактор роста отличается от гормона? Как уже отмечалось, гормоны выделяются в систему кровообращения и разносятся по всему организму, достигая своих клеток-мишеней. Большинство факторов роста в своем действии паракринны: они диффундируют на коротком расстоянии и действуют местно только на близлежащие клетки. Хотя есть и такие, что действуют аутокринно, стимулируя секретирующие их клетки (например, интерлейкин-2 стимулирует пролиферацию Т-клеток), иным способом; высвобождение инсулина и глюкагона из поджелудочной железы напрямую зависит от уровня глюкозы в крови.
Таблица 26.1 Основные гормоны и их функции
Секретирующий орган |
Гормон |
Ткань-мишень |
Функция |
Гипоталамус |
Рилизинг-факторы |
Передняя доля гипофиза |
Стимуляция секреции гормонов |
Соматостатин (также и из поджелудочной железы) |
Передняя доля гипофиза |
Тормозит выделение соматотропина |
|
Передняя доля гипофиза |
Тиреотропный гормон |
Щитовидная железа |
Стимулирует выделение тироксина (Т4) и трииодтиронина (Т3) |
Адренокортико- тропный гормон (АКТГ) |
Кора надпочечников |
Стимулирует выделение адренокортикостероидов |
|
Гонадотропины (лютеинизирующий гормон, LH, и фолликулостимулирующий гормон, FSH) |
Яички и яичники |
Стимулирует выделение половых гормонов и развитие клеток |
|
Соматотропин |
Печень |
Стимулирует синтез инсулиноподобных факторов роста IGFI и IGFII |
|
Пролактин |
Молочная железа |
Необходим для лактации |
|
Задняя доля гипофиза |
Антидиуретический гормон (ADH), или вазопрессин |
Почечные канальцы |
Способствует реабсорбции воды |
Окситоцин |
Гладкая мускулатура |
Стимулирует сокращение матки |
|
Щитовидная железа |
Тироксин (Т4) и трииодтиронин (Т3) |
Печень, мышцы |
Стимулирует метаболические процессы |
Паращитовидная железа |
Паратиреоидный гормон |
Костная ткань, почки, кишечник |
Поддерживает уровень Са2+ в крови, стимулирует реабсорбцию и захват Са2+, поступающего с пищей |
Кальпитонин (также из щитовидной железы) |
Костная ткань, почки |
Ингибирует реабсорбцию Са2+ |
|
Кора надпочечников |
Глюкокортикостероиды (кортизол) |
Многие ткани |
Способствует глюконеогенезу |
Минералокортико- стероиды (альдостерон) |
Почки, кровь |
Поддерживает водно-солевой баланс |
|
Мозговое вещество надпочечников |
Катехоламины (адреналин, норадреналин) |
Печень, мышцы, сердце |
Мобилизуют жирные кислоты и глюкозу в кровоток |
Гонады |
Половые гормоны (тестостерон из яичек, эстрадиол и прогестерон из яичников) |
Органы во спризводства, вторичные половые органы |
Способствуют созреванию организма и функционированию половых органов |
Печень |
Соматомедины (инсулиноподобные факторы роста: IGFI, IGFII) |
Печень, костная ткань |
Стимулируют рост |
Поджелудочная железа |
Инсулин |
Печень, мышцы |
Стимулирует синтез гликогена, липогенез, синтез белка |
Глюкагон |
Многие ткани |
Стимулирует распад гликогена, липолиз |
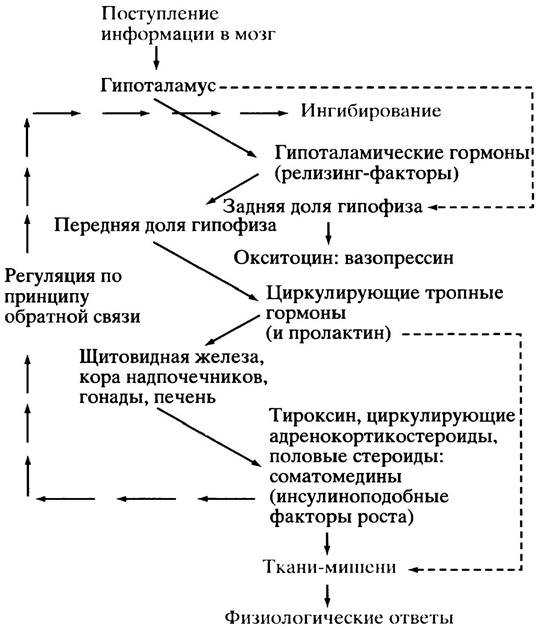
Рис. 26.3. Гипоталамической регуляция выделения гормонов
Регуляция высвобождения факторов роста
О ней известно относительно немного, и вполне возможно, что выделение этих факторов контролируют многочисленные механизмы. Повреждение эпителиального слоя кровеносных сосудов приводит к разрыву тромбоцитов и выделению PDGF, который стимулирует деление клеток и репарацию; но PDGF также образуется многими другими клетками организма. В иммунной системе активация В- и Т-клеток вызывает выделение факторов роста (цитокинов), стимулирующих их пролиферацию (см. главу 25). Факторы роста могут стимулировать клетки к выделению других факторов роста. Вкратце, факторы роста участвуют в процессах развития и репарации клеток и в защитных механизмах, например, иммунного ответа, который включает экстенсивный контроль клеточной пролиферации и дифференцировки.
Регуляция высвобождения нейромедиаторов
Нервный импульс, проходящий по аксону нервной клетки, вызывает выделение посредством экзоцитоза нейромедиаторов из везикул нервных окончаний. Механизм этого высвобождения будет описан позже.
Удаление сигнальных молекул
Сущность контроля заключается в его обратимости. Выделенные сигнальные молекулы должны быть удалены, в противном случае исходный сигнал длился бы неопределенно долго. Классическим примером удаления сигнальных молекул служит разрушение ацетилхолина ацетилхолинэстеразой, присутствующей в нервных синапсах. Удаление сигнала необходимо для подготовки синапса к восприятию следующего нервного импульса. Для ацетилхолина это происходит в ходе следующей реакции:
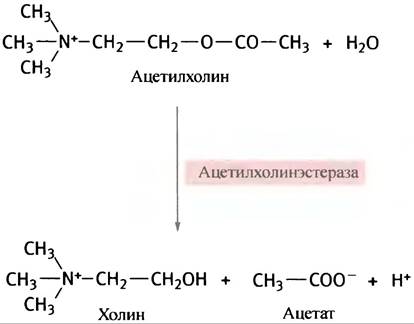
Катехоламины, выделяемые нервными окончаниями, захватываются соседними клетками или удаляются посредством метаболического разрушения.
Каким образом сигналы распознаются клетками-мишенями?
Как уже отмечалось, для каждого сигнала клетки-мишени имеют рецепторы на внешней поверхности или внутри клетки. С ними сигнальные молекулы связываются, вызывая изменения в конформации рецепторного белка (или белков), что приводит к определенному ответу. Несколько гормонов (стероиды, тироксин, а также оксид
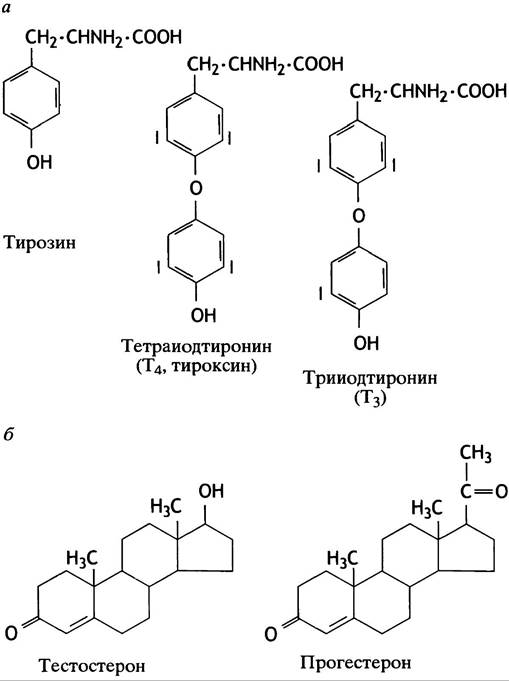
азота) растворимы в липидах и поступают прямо в клетку, непосредственно через липидный бислой, связываясь с внутриклеточными рецепторами (см. рис. 26.1). Структуры тиреоидных гормонов и двух стероидных гормонов представлены на рис. 26.4. Остальные сигнальные молекулы водорастворимы и связываются с рецепторами на поверхности клеточной мембраны (см. рис. 26.1).
Сущность регуляции - специфичность: сигнальная молекула (называемая лигандом, или агонистом) исключительно точно взаимодействует со своим рецептором - так же, как субстрат со своим ферментом. Вот почему гормон, разносимый током крови по всему организму, влияет только на свои клетки-мишени. Если клетка не имеет специфического рецептора, она «не видит» этого сигнала. Точно также телеприемник без соответствующей антены не может принимать сигнал спутникового телевидения.
Рис. 26.4. Структуры гормонов: а - Структуры тирозина и тиреоидных гормонов; б - структуры двух стероидных гормонов
Как связывание лиганда приводит к клеточному ответу?
Внутриклеточные рецептор-опосредованные ответы
Стероидные гормоны регулируют экспрессию специфических генов клеток-мишеней на уровне инициации транскрипции. К их числу относятся глюкокортикоиды, эстроген и прогестерон (см. табл. 26.1). Эти растворимые в липидах гормоны легко проходят сквозь липидный бислой клетки к своим рецепторам.
Рецепторы эстрогена и прогестерона локализованы в ядре, а глюкокортикоидный рецептор - в цитоплазме. Все они имеют «цинковые пальцы» (см. с. 279) в качестве ДНК-связывающего домена и существуют в комплексе с белками теплового шока (Нsр). Как мы помним, белки теплового шока являются шаперонами (см. с. 298), участвующими в сворачивании и поддержании определенной конформации ряда белков.
Наиболее хорошо исследован «цинковый палец» глюкокортикоидного рецептора, поэтому мы опишем его в качестве примера. В цитоплазме рецептор связан с комплексом белков теплового шока, которые экранируют ядерную сигнальную метку (специфическую пептидную последовательность).
Когда глюкокортикоидный гормон связывается со специфическим участком на рецепторе, комплекс белков теплового шока диссоциирует от него, обнажая сигнальную метку, и рецептор транспортируется в ядро. Там он соединяется в форме димера с глюкокортикоид-чувствительным элементом ДНК (рис. 26.5). Последний представлен палиндромом, каждая половина которого соединена с двумя «цинковыми пальцами» (см. рис. 21.22) молекулы рецепторного димера.
Рис. 26.5. Активация гена стероидными гормонами. В качестве примера взят глюкокортикоидный рецептор из надсемейства рецепторов стероидных гормонов и тироксина, которые образуют комплексы с белками теплового шока (Нsр) и связываются «цинковыми пальцами» с участками ДНК
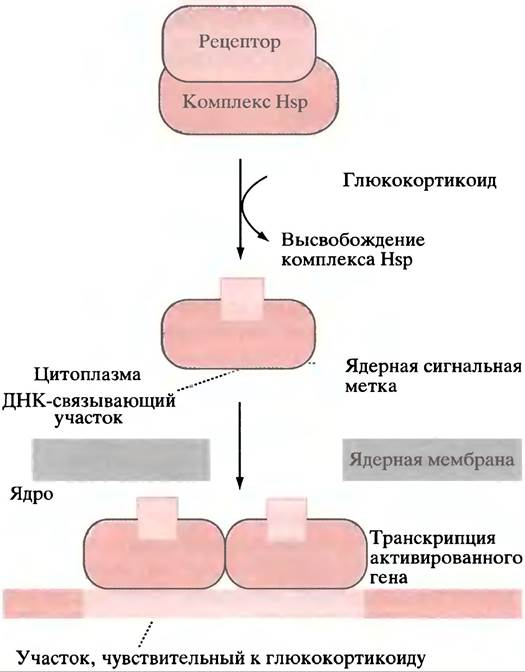
В случае рецепторов других стероидных гормонов ядерная сигнальная метка не экранирована комплексом белков теплового шока, так что вся структура транспортируется в ядро. Но до тех пор, пока Нsр не освободится в ходе присоединения гормона, связывания с ДНК не происходит.
Мембранные рецептор-опосредованные ответы
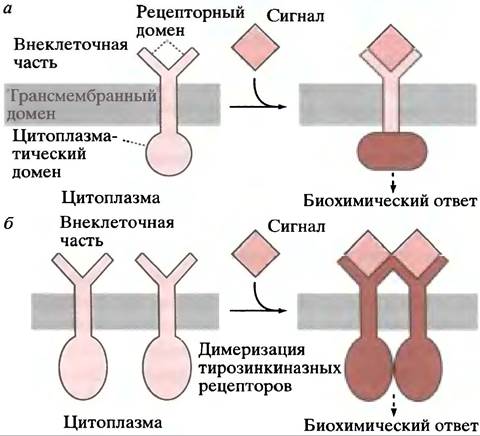
Многочисленные межклеточные связи в организме осуществляются через мембранные рецепторы. На рис. 26.6. приведены два типа таких рецепторов. В первом случае связывание лиганда активирует внутренний домен рецептора, во втором - связывание лиганда вызывает димеризацию рецепторов, что сопровождается активацией внутренних доменов. Каким образом сигнал, генерируемый на цитоплазматической стороне мембраны, передается к участку контроля - сложный вопрос, поэтому мы сначала рассмотрим мембранные рецептор-опос- редуемые ответы, а затем познакомимся с отдельными сигнальными путями, ведущими к клеточным ответам.
Рис. 26.6. Трансмембранная передача сигнала рецепторами. а - Связывание лиганда с рецептором вызывает аллостерическое изменение цитозольного домена рецепторной белковой молекулы; б - связывание лиганда приводит к димеризации мембранных рецепторов. Этот механизм применим к рецепторам, обладающим тирозинкиназной активностью (см. с. 353). Связывание двух цитоплазматических доменов приводит к биохимическому ответу
Резюме по мембранным рецептор-опосредуемым ответам
Основной предмет обсуждения этого раздела - фосфорилирование белка под действием использующей АТР протеинкиназы. Трудно преувеличить значение фосфорилирования белков в процессах клеточной регуляции: у животных фосфорилирование участвует в реализации гормонального контроля, регуляции факторами роста, регуляции фаз клеточного цикла циклинами и в контроле сокращения гладкой мышцы. На рис. 26.7. показаны основные принципы регуляции посредством фосфорилирования. Стоит еще раз обратиться к рис. 12.8, иллюстрирующему центральную роль фосфорилирования в проведении внешних сигналов.
Рис. 26.7. Основной принцип регуляции для большинства внешних сигналов. Фосфорилирование белка изменяет его свойства, что приводит к определенному клеточному ответу. Обратите внимание, что фосфорилирование может стать причиной активации или дезактивации различных белков. Внешние сигналы в конечном счете влияют на активность протеинкиназы и протеин- фосфатазы
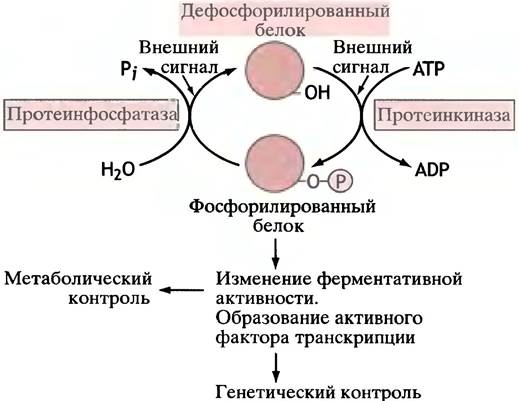
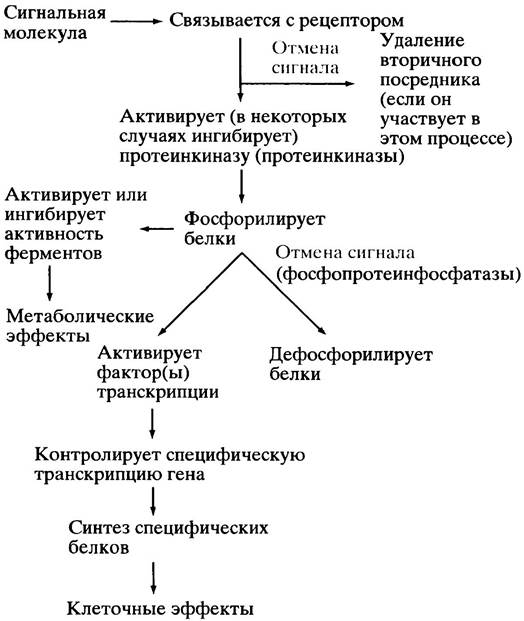
Из вышесказанного со всей очевидностью следует, что в большинстве случаев рецептор-опосредуемая сигнализация включает активацию протеинкиназ. Дефосфорилирование фосфопротеинов катализируют протеинфосфатазы, и эта стадия также может быть объектом для контроля. Рис. 26.8. суммирует взаимоотношения регуляторных систем, опосредуемых мембранными рецепторами. Схема показывает также обратимость действия сигнала путем разрушения вторичного посредника.
Рис. 26.8. Упрощенное изображение главных событий в мембранной рецептор-опосредованной сигнализации. Обратите внимание, что одна стрелка может отражать несколько этапов данного процесса
Модуляция рецепторного ответа на сигнал
Повторное воздействие сигнала на клетку-мишень часто приводит к более слабому ответу. В случае одного класса рецепторов адреналина регуляция по принципу
обратной связи сопровождается фосфорилированием рецепторного белка и снижению чувствительности (это называется десенситизацией) рецептора к лиганду. Во избежание путаницы отметим, что для других типов рецепторов, которые будут описаны позднее, фосфорилирование является составной частью процесса активации. Другой тип модуляции ответа заключается в контроле числа функциональных рецепторов в мембране. В случае рецептора инсулина комплекс инсулин-рецептор захватывается внутрь клетки в ходе эндоцитоза. Процесс возвращения рецептора назад к мембране контролируется числом рецепторов в ней. Это может способствовать снижению ответа клетки к данному сигналу и, таким образом, ослаблять действие регуляторной системы; последнее известно, как понижающая регуляция, или даунрегуляция (англ. downregulatiori).
Описание отдельных сигнальных путей внутри клетки, связывающих активацию рецептора с клеточным ответом
сАМР-опосредованные пути
Поскольку в главе 12 (см. с. 166) мы уже познакомились с регуляцией метаболизма путем изменения активности протеинкиназы под действием сАМР, в этом разделе мы обсудим, как изменяется уровень самого сАМР в клетке и как сАМР регулирует экспрессию гена.
Многие гормоны - первичные посредники, включая адренокортикотропный гормон (АСТН), антидиуретический гормон (ADH), гонадотропины, тироид- стимулирующий гормон (TSH), паратиреоидный гормон, глюкагон, катехоламины (адреналиннорадреналин) и соматостатин (см. табл. 26.1), используют сАМР в качестве вторичного посредника. Этот далеко не полный список приведен только для демонстрации крайне разнообразного влияния сАМР на различные клетки. Система работает потому, что ответ сАМР у данной клетки соответствует сигналу, который клетка способна уловить своими специфическими рецепторами. Таким образом, в клетке А сигнал X увеличивает уровень сАМР, который обуславливает клеточные ответы, соответствующие сигналу X. У клетки В нет рецепторов для сигнала X, но есть для сигнала Y; они также увеличивают уровень сАМР, но в клетке В это вызывает ответы, соответствующие сигналу Y.
Мы обсудим два случая, связанные с проявлением этих эффектов: 1) как связывание сигнальной молекулы с рецептором контролирует уровень сАМР в клетке; 2) как сАМР влияет на транскрипцию гена.
Контроль уровня сАМР в клетках
сАМР образуется в клетке из АТР под действием фермента аденилатциклазы, локализованого на внутренней стороне клеточной мембраны (рис. 26.9).
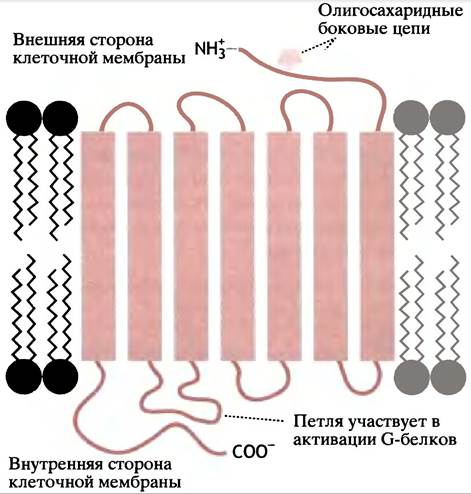
Давайте рассмотрим типичный пример активации аденилатциклазы адреналином, в результате которой в печени и скелетной мышце образуется сАМР (см. с. 167). Рецептор (в данном случае β2-адренорецептор) - белок, полипептидная цепь которого прошивает мембрану 7 раз (рис. 26.10). Каждый из 7 трансмембранных сегментов содержит около 19 гидрофобных аминокислот. Последние образуют α-спиральную структуру, достаточную для перекрывания гидрофобного липидного бислоя мембраны. Адреналин «попадает» в щель между трансмембранными спиралями.
Рис. 26.9. Образование и гидролиз сАМР. а - Образование 3', 5'-циклического АМР с участием аденилатциклазы; б - гидролиз 3', 5-циклического АМР фосфодиэстеразой
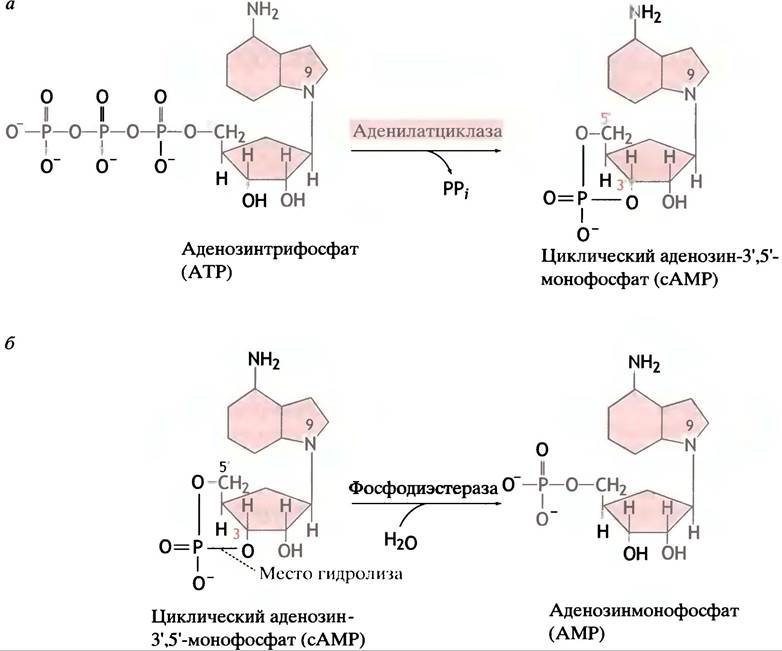
Рис. 26.10. Расположение β2-адренорецептора в клеточной мембране
С внутренней (цитоплазматической) поверхностью рецепторного белка связан регуляторный G-белок, который имеет 3 субъединицы: α, β и y. Поскольку это 3 различных полипептида, белок называется гетеротримерным G-белком, или просто тримерным G-белком. На α-субъединице расположен участок, который может связывать либо GTP, либо GDP. Когда он занят GDP, не происходит ничего (рис. 26.11, а).
Рис. 26.11. Регуляция активности аденилатциклазы адреналином
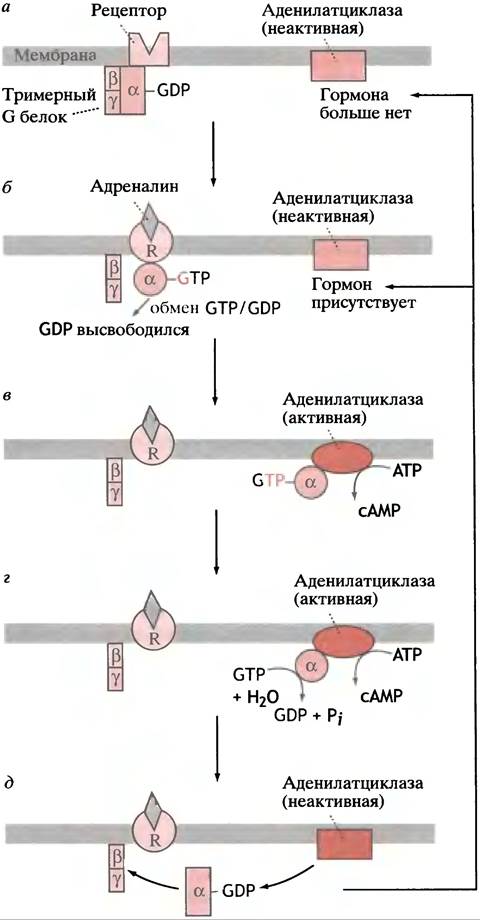
Когда молекула адреналина связывается с рецептором, цитоплазматический домен последнего претерпевает конформационные изменения. Это, в свою очередь, вызывает конформационные изменения связанного с ним G-белка. Последнее приводит к тому, что G-белок (названный в данной системе Gs; «s» означает стимуляторный) обменивает GDP на GTP. G-белок не может производить этот обмен до тех пор, пока не будет соединен с рецептором, связанным с гормоном. Комплекс α-субъединица-GТР отсоединяется от G-белка, мигрирует к молекуле аденилатциклазы и активирует ее, что приводит к образованию АТР (рис. 26.11, б, в).
Таким образом, гормон стимулирует синтез сАМР, используя в качестве посредника G-белок (см. рис. 26.11, в). Активация образования сАМР α-GTP-субъединицей должна быть ограничена во времени: в противном случае одиночный гормональный стимул будет действовать неопределенно долго. Если рецептор больше не связывает гормон, образование сАМР должно прекратиться; гидролиз сАМР в клетке фосфодиэстеразой завершает процесс (см. рис. 26.9, б).
Ситуация подобна той, что происходит на лестнице с ограниченным временем освещения: когда вы нажимаете кнопку - свет зажигается, а потом кнопка начинает медленно возвращаться в исходное положение - и свет выключается через минуту или две. Время от времени вы должны нажимать кнопку, чтобы свет не гас. G-белок как раз и является «хронометражным прибором», который ограничивает время активации аденилат- циклазы.
α-Субъединица G-белка в связанной с GTP форме (которая активирует аденилатциклазу) обладает ферментативной GТРазной активностью. Она гидролизует GTP до GDP и Pi (рис. 26.11, г). GТРазная активность низка, так что гидролиз GTP происходит не сразу. Как только в ходе гидролиза образуется GDP, α-субъединица возвращается в исходное состояние. Она отсоединяется от аденилатциклазы, которая становится неактивной, и в связанном с GDP состоянии присоединяется к β-
и y-субъединицам, образуя комплекс G-белoк-GDP, контактирующий с рецептором (рис. 26.11,6). Если последний все еще связывает молекулу гормона, весь цикл может начаться сначала (см. рис. 26.11, б). Место GDP занимает GTP, α-субъединица диссоциирует для того, чтобы активировать молекулу аденилатциклазы. Если рецептор больше не связывает молекулу гормона (см. рис. 26.11, а), процесс останавливается. Таким образом, чтобы продолжить синтез сАМР, α-субъединица
перемещается взад и вперед от рецептора к аденилат- циклазе. Продолжительность ее пребывания на аде- нилатциклазе определяется временем, необходимым для гидролиза присоединенной молекулы GTP.
Система обладает эффектом усиления: одна связанная с рецептором молекула гормона может активировать одну за другой молекулы G-белка, а, следовательно, одна молекула гормона, связываясь с рецептором, способна привести к активации нескольких молекул аденилатциклазы и образованию большого числа молекул сАМР. Важность гидролиза GTP в процессе синтеза АТР можно проиллюстрировать на примере холеры. Клетки слизистой кишечника выделяют в просвет кишечника Na+, и сАМР стимулирует этот процесс. Холерный токсин необратимо ингибирует GТРазную активность α-субъединицы G-белка. Таким образом, гормональный сигнал, активирующий аденилатциклазу, не может быть выключен; она оказывается «замороженной» в состоянии α-GTP. Продолжительное образование сАМР приводит к массированной потере ионов Na+, за которыми следуют молекулы воды, вызывая изнуряющий понос и возможную смерть от потери жидкости и электролитов.
В случае, приведенном на рис.26.11, GTP-α-субъединица стимулирует активность аденилатциклазы. Адренорецепторы другого типа (α2-адренорецепторы) действуют аналогичным образом, однако здесь используется другая субъединица α-GTP (Gi), которая ингибирует активность аденилатциклазы. α- и β-Адренорецепторы опосредуют различные эффекты катехоламинов. Как мы уже знаем (см. с. 167), при необходимости внезапного действия адреналин стимулирует печень и скелетные мышцы, что реализуется через β2-адренорецепторы, активирующие аденилатциклазу. В отличие от них α2-адренорецепторы ингибируют аденилатциклазу. Еще один подтип - α1-адренорецепторы - также имеют свои отличия: они не используют сАМР в качестве вторичного посредника, а вызывают высвобождение Са2+ посредством фосфоинозитидного пути (см. с. 352). Таким образом, один гормон может оказывать совершенно противоположное влияние, в зависимости от типа рецептора.
Как сАМР действует на транскрипцию генов?
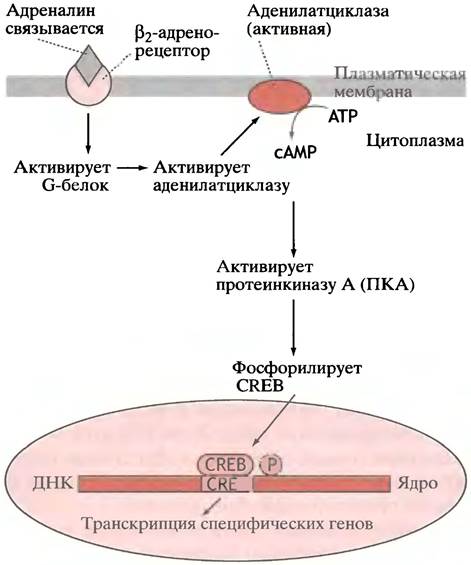
В главе 12 мы описали, как сАМР активирует протеинкиназу А (ПКА). Помимо участия в контроле активности ферментов, ПКА является частью важного механизма регуляции экспрессии гена. Промоторы нескольких сАМР-индуцибельных генов содержат сАМР-чувствительные элементы (CREs). Когда ПКА фосфорилирует
CRE-связывающий белок (CREB; от англ. cAMP-responsive element binding protein), он становится активным фактором транскрипции типа «лейциновой молнии» (рис. 26.12). Существует семейство CREB-белков, выполняющих, по-видимому, различные функции в клетке.
Рис. 26.12. Схематичное изображение, иллюстрирующее функцию β2-адренорецептора. Рецептор-опосредованная стимуляция аденилатциклазы и увеличение уровня сАМР вызывают активацию сАМР-зависимой протеинкиназы (ПКА). Фосфорилирование СRЕВ формирует активный центр факторов транскрипции для специфических генов
Итак, мы сказали, что сАМР является вторичным посредником (см. с. 166) в передаче внешнего сигнала функциональным элементам как в цитоплазме, так и в ядре клетки. Другой циклический нуклеотид - cGMP - выполняет ту же функцию в иных регуляторных системах, которые мы и рассмотрим.
Передача сигнала с использованием циклического GМР в качестве вторичного посредника
Ряд сигналов вызывает увеличение уровня сGМР внутри клетки, что в свою очередь активирует протеинкиназу (ПКС). Образование сGМР из GТР катализируют
мембраносвязанная и растворимая формы фермента гуанилатциклазы (рис. 26.13). В первом случае гуанилатциклаза является внутриклеточным доменом мембранного рецепторного белка. Связывание гормона с внешним рецептором приводит к активации внутриклеточного домена и увеличению синтеза сGМР. Этот путь отличается от механизма, при помощи которого адренорецептор запускает образование сАМР: в данном случае внутренний домен рецептора сам является гуанилатциклазой и активируется непосредственно в ходе присоединения гормона (рис. 26.14). Образовавшийся сGМР опосредует клеточный ответ, активируя особую протеинкиназу (ПКG). Примером этого типа регуляции может служить натрийуретический фактор предсердий, вырабатываемый эндотелиальными клетками: он стимулирует секрецию Nа+ почками. Эффекты сGМР более специализированы по сравнению с сАМР. Они включают расслабление гладкой мускулатуры и воздействуют на нервные клетки и зрение (см. ниже).
Рис. 26.13. Образование 3',5'-циклического GМР, катализируемое гуанилатциклазой
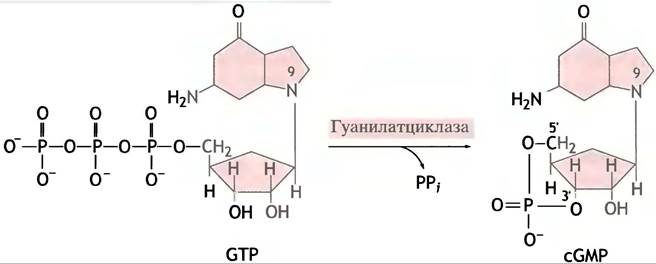
Рис. 26.14. Схематичное изображение, иллюстрирующее основные принципы действия циклических нуклеотидов в качестве вторичных посредников в клеточной сигнализации. R1 - рецептор α2-адренергического типа; R2 - рецептор β2-адренергического типа; R3 - участок связывания натрийуретического пептида предсердий, один из доменов которого встроен в мембрану, а каталитический домен ориентирован в сторону. АЦ - аденилатциклаза плазматической мембраны, ГЦ1 - гуанилатциклаза плазматической мембраны, ГЦ2- цитоплазматическая гуанилатциклаза, активируемая оксидом азота (NO)
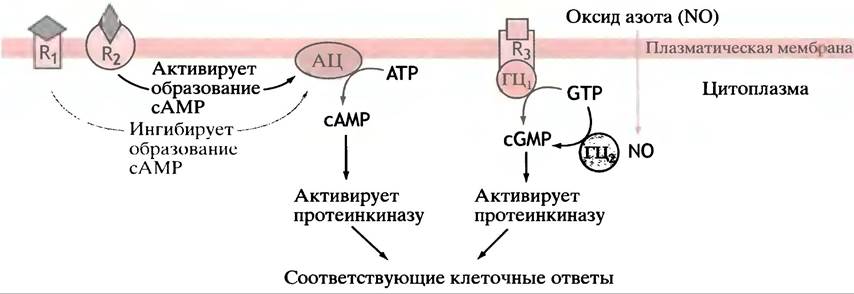
В цитозоле есть и другая, растворимая форма гуанилатциклазы. В качестве простетической группы она содержит молекулу гема, с которой связывается, пожалуй, самая простая межклеточная сигнальная молекула - NO, или оксид азота. Молекула гема представляет чрезвычайно чувствительный детектор NO; она передает сигнал активации ферменту. NO образуется в эндотелиальных клетках сосудистой системы из гуанидиновой группы аргинина под действием фермента нитроксидсинтазы. NO диффундирует в мускулатуру кровеносных сосудов, вызывая образование сGМР, который, в свою очередь, способствует расслаблению мышц и расслаблению сосудов. Ацетилхолин стимулирует образование оксида азота, из чего следует, что оно может опосредоваться нервной регуляцией. Оксид азота также синтезируется в ответ на механическое воздействие, оказываемое кровотоком на эндотелиальные клетки выстилки кровеносных сосудов, приводя к расширению сосудов (вазодилатации).
Тринитроглицерин - лекарство, давно используемое для лечения стенокардии, из него медленно образуется оксид азота, вызывая тем самым расслабление сосудов и уменьшение нагрузки на сердце. Поскольку за считанные секунды NO окисляется до NO2 и NO3, он является сигнальной молекулой локального действия; будучи быстро растворимым в липидах, оксид азота легко выходит из продуцирующих его клеток и переходит в соседние. Оксид азота является частью сложной регуляторной системы с множественными физиологическими эффектами. Рис. 26.14 суммирует основные принципы действия циклических нуклеотидов в качестве вторичных посредников в межклеточной сигнализации.
Гормоны, передающие сигнал при помощи различных вторичных мессенджеров; фосфоинозитидный каскад
До сих пор мы знакомились с разнообразной группой гормонов, использующих в качестве вторичных посредников циклические нуклеотиды - сАМР и cGMP. Другая группа гормонов и факторов роста использует для передачи сигналов иные внутриклеточные механизмы. Потенциальные гормоны связываются со специфическими рецепторами клетки, которые также взаимодействуют с G-белками (т. е. с GTP-связывающими белками), но в передаче сигнала циклические нуклеотиды не участвуют. Примерами гормонов, использующих такой механизм, могут служить тиротропин-релизинг гормон, гонадотропин-релизинг гормон и фактор роста PDGF.
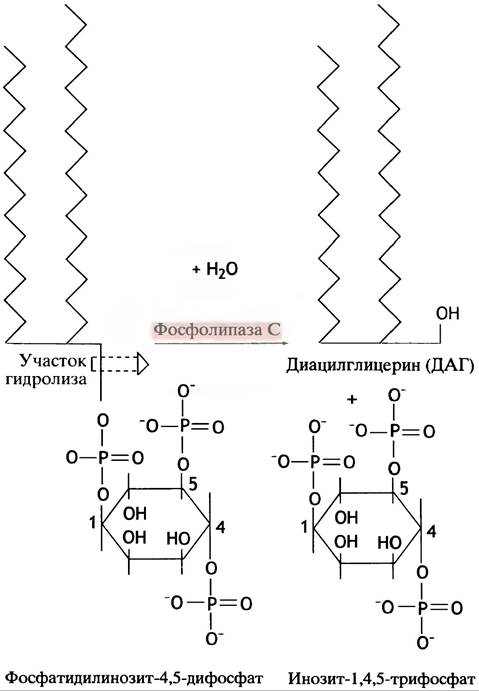
Фосфолипид фосфатидилинозит-4,5-дифосфат (РIР2) образуется в мембране при фосфорилировании фосфатидилинозита, структура которого приведена в главе 10. Еще раз отметим, что G-белок связывает рецепторный стимул с сигнальным путем внутри клетки и действует в качестве «молекулярного хрономегражного прибора». Взаимодействие гормона с рецептором вызывает у связанного с рецептором G-белка обмен GDP на GTP. Комплекс Gp-GTP мигрирует и активирует мембраносвязанный фермент фосфолипазу С, которая расщепляет РIР2 на инозиттрифосфат (IР3) и диацилглицерин (ДАГ) (рис. 26.15). G-белок гидролизует GTP до GDP и Рi, приводя к самоинактивации фермента.
Рис. 26.15. Гидролиз фосфатидилинозит-4,5-дифосфата (РIР2) до диацилглицерина (ДАГ) и инозиттрифосфата IР3
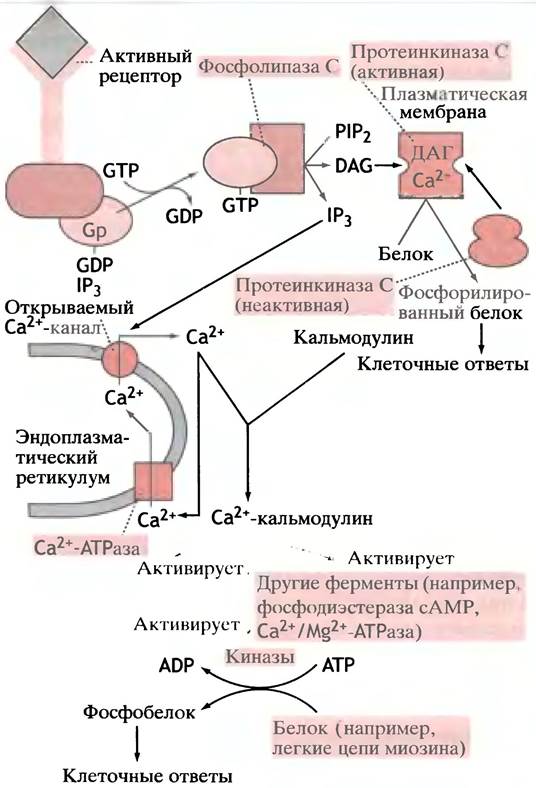
IР3 вызывает высвобождение Са2+ из просвета эндоплазматического ретикулума (ЭР), содержащего высокие концентрации этого иона. IР3 открывает в мембране лиганд-зависимые Са2+-каналы (см. ниже), обеспечивая поступление иона в цитоплазму. Под действием Са2+-АТРазы ионы Са2+ постоянно возвращаются в просвет ЭР, а IР3 и ДАГ удаляются ферментативным путем. Таким образом, соединение гормона или любого другого агониста с рецептором, задействованным в фосфоинозитидном каскаде, приводит к увеличению внутриклеточного ДАГ и Са2+ (рис. 26.16), а обращение процесса происходит после диссоциации комплекса гормон-рецептор.
Рис. 26.16. Фосфатидилинозитидный каскад: взаимосвязь ДАГ, IР3 и Са2+ в качестве вторичных посредников. Gp-белок связывается с фосфолипазой С только в комплексе с GTP; обращение процесса происходит при гидролизе GTP до GDP
ДАГ является физиологическим активатором особой протеинкиназы, отличающейся от ПКА и ПКG. Для ее максимальной активации также необходим Са2+.
Активируемая ДАГ протеинкиназа носит название ПКС; она связана с молекулами фосфатидилсерина, расположенными на цитозольной стороне клеточной мембраны. ПКС участвует в регуляции многочисленных клеточных процессов, фосфорилируя различные белки-мишени и некоторые факторы роста. Важную роль ПКС в контроле за делением клеток иллюстрирует онкогенный эффект форболовых эфиров, являющихся так называемыми опухолевыми промоторами. Форболовые эфиры - аналоги ДАГ, активирующие ПКС. Ниже приведены структуры ДАГ и форболового эфира (запоминать структуру последнего не обязательно).
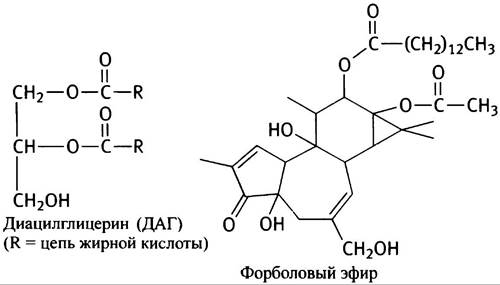
Может показаться абсурдным, что ДАГ оказывает такой же активирующий эффект на ПКС, что и агент, являющийся промотором образования опухоли. Различие их действия, по-видимому, заключается в том, что ДАГ быстро разрушается и активирует ПКС только тогда, когда это требуется, в то время как форболовые эфиры «живут» дольше, пролонгируя столь нежелательный организму сигнал.
На рис. 26.16 показано, что стимуляция описанного в этом разделе типа рецептора приводит к образованию двух посредников - ДАГ и Са2+, причем оба необходимы для максимальной активации ПКС. Однако Са2+ и сам по себе является важным вторичным посредником.
Каковы другие мессенджерные эффекты кальция?
В реализации эффектов Са2+ как вторичного посредника участвует кальмодулин. Этот широко распространенный белок имеет 4 высокоаффинных участка для ионов Са2+; их связывание вызывает изменение конформации кальмодулина. Активированный таким образом кальмодулин изменяет активность ферментов (и других белков), с которыми он взаимодействует. Существует ряд Са2+-кальмодулин-активируемых протеинкиназ; из этого следует, что реализация многих эффектов Са2+ в клетке также включает фосфорилирование белка.
Список белков-мишеней этих киназ включает гликогенфосфорилазу и гликогенсинтетазу (с. 88-89). Поскольку один тип адренорецепторов (α1) активирует фосфоинозитидный путь, вызывая увеличение Са2+ в цитоплазме клетки, адреналин может влиять на метаболизм гликогена как посредством этого механизма, так и через сАМР. Другими белками-мишенями Са2+-кальмодулин-зависимых киназ являются киназы легких цепей миозина (см. с. 386).
Рецепторы, ассоциированные с тирозинкиназой
Хотя в этом разделе мы все еще знакомимся с мембранными рецепторами, теперь нам предстоит рассмотреть очень важную область, совершенно отличную от всего вышесказаного.
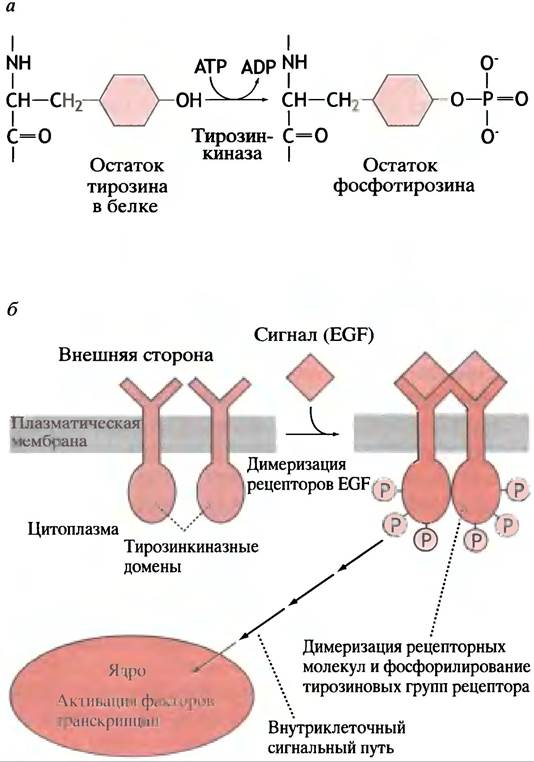
Фосфорилирование - основной этап регуляции, однако мишенью фосфорилирования является аминокислота тирозин самого рецепторного белка, т. е. происходит его самофосфорилирование (аутофосфорилирование).
Все описанные до сих пор протеинкиназы фосфорилируют гидроксильные группы остатков серина или треонина своих белков-мишеней. Теперь мы обсуждаем
активацию рецептора, которая обусловлена фосфорилированием гидроксильной группы специфических тирозиновых остатков белков в ответ на связывание сигнальной молекулы (рис. 26.17, а). Само по себе это может показаться вполне тривиальным, но связанные с тирозинкиназой рецепторы представляют особый тип рецепторов, активирующих специфические сигнальные пути. Их важность подчеркивает то, что у большинства факторов роста и некоторых гормонов, например, инсулина, есть рецепторы подобного типа.
Рис. 26.17. Активация различных ферментативных и генетических процессов при взаимодействии рецептора EGF со специфическими лигандами. а - Белковый уровень: фосфорилирование тирозина тирозинкиназой; б - клеточный уровень: суммарное влияние EGF на клетку- мишень
Для иллюстрации такой сигнальной системы мы рассмотрим фактор роста эпидермиса (EGF; от англ. epidermal growth factor).
Связывание лиганда вызывает димеризацию рецепторов EGF в мембране клетки (рис. 26.17, б). Это приводит к множественному фосфорилированию остатков тирозина в цитоплазматических доменах рецепторов. Цитоплазматические домены являются тирозинкиназами, которые, возможно, фосфорилируют друг друга в ходе димеризации. Фосфорилирование приводит к активации сигнального пути от мембранного рецептора к ядру клетки и завершается активацией фактора транскрипции.
Ras-путь - распространенный сигнальный путь от мембраны к гену эукариот
Белок, известный под названием Ras-белок, присутствует во всех клетках эукариот. Это небольшой мономерный GTP-связывающий белок, обладающий GТРазной активностью. Оказалось, что он является частью главного сигнального пути от тирозинкиназы, ассоциированной с рецепторами факторов роста, к факторам транскрипции генов. Особенность этого пути заключается в том, что в нем нет низкомолекулярных вторичных посредников: все его компоненты принадлежат к белкам.
Ras-белок и другие составляющие этого внутриклеточного сигнального пути важны для регуляции клетки; мутации, обуславливающие появление аномальных форм этих белков - онкогенны, они приводят к неконтролируемому делению клеток.
Рис. 26.18 иллюстрирует эту систему. В цитоплазме есть белок, связывающий рецептор фактора роста (GRB, от англ. growth factor receptor-binding protein), который связан с так называемым SOS-белком. При помощи SH2-домена GRB взаимодействует с фосфорилированным рецептором. Этот домен найден также у семейства цитоплазматических белков, которые, как полагают, играют роль в связывании фосфорилированного рецептора. Название SH2 происходит от наличия домена, гомологичного домену 2 Src-белка, кодируемого онкогеном вируса саркомы Рауса (см. с. 314). Отсюда для краткости - SH2.
Рис. 26.18. Активация Ras-пути EGF (упрощенная схема). Светлым показано неактивное состояние, темным - активное состояние. а - Неактивное состояние без EGF;
б - активированное с EGF; GRB - белок связывающий рецептор фактора роста; SOS (son of sevenless) - белок, участвующий в этом сигнальном пути, получил свое имя «в честь» соответствующей мутации (sevenless mutation) у дрозофилы. Raf, Ras, Jun, и Fos получили названия от своих онкогенов. Обратите внимание, что рецептор фосфорилируется по остатку тирозина, но последующие киназы каскада относятся к се- рин/треониновому типу. Механизм активации Raf-киназы Ras-GTP до сих пор детально не выяснен
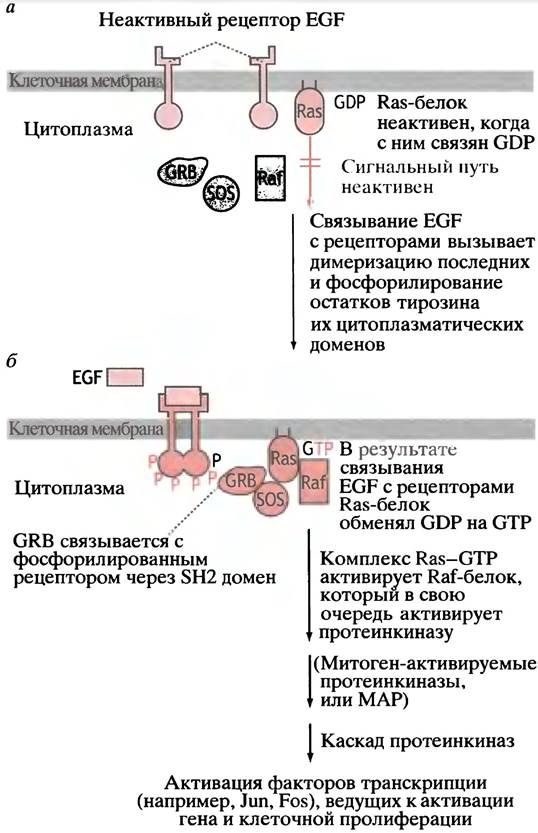
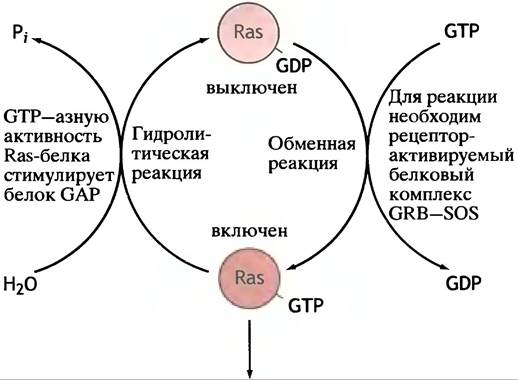
Соединение GRB-SOS с активированным рецептором вызывает в Ras-белке обмен GDP на GTP (рис. 26.19). Это в точности напоминает активацию G-белка при образовании сАМР (см. рис. 26.11). Ras-белок обладает низкой GТРазной активностью, выполняющей функцию молекулярного «хронометражного прибора».
Рис. 26.19. Активация Ras-белка
Следующим компонентом этого пути является Raf-белок - протеинкиназа серин-треонинового типа, для активации которой необходим Ras-GTP. Это начало
серин/треонинового протеинкиназного каскада, заканчивающегося фосфорилированием белков-факторов транскрипции; активация последних способствует их присоединению к соответствующим чувствительным элементам и обеспечивает транскрипцию специфических генов.
Ras-путь и онкогенез
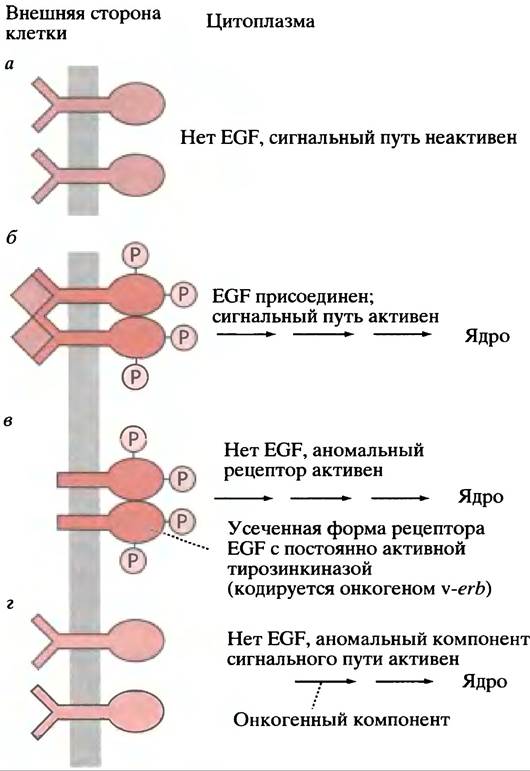
В главе 23 мы объяснили, что вызывающие рак гены, переносимые ретровирусами, являются мутированными формами протоонкогенов, присутствующих в нормальных клетках. Ras- и Raf-белки - это продукты протоонкогенов; когда соответствующие онкогены вносятся ретровирусами в клетки, они вызывают рак. Похоже, что онкогенные копии Ras- и Raf-белков (как и другие компоненты Ras-пути, показанные на рис. 26.18) постоянно находятся в «активированном» состоянии. Внутриклеточный сигнальный путь ведет себя так, словно сигнальная молекула находится на рецепторе постоянно. Таким онкогеном является v-erbB, который кодирует аномальный рецептор EGF. У него отсутствует внешний домен, но цитоплазматический домен находится постоянно в фосфорилированном состоянии (рис. 26.20). Таким образом, в присутствии любого из этих онкогенных белков Ras-путь работает в неконтролируемом режиме. Онкогены могут появляться не только в ходе ретровирусной инфекции; нормальные протоонкогены иногда трансформируются в онкогены в результате мутации.
Рис. 26.20. Продукты онкогенов как компоненты сигнальных путей от мембраны к ядру: в качестве примера использован рецептор EGF. а - Нормальный рецептор - неактивен; б - нормальный рецептор - активен; в - постоянно активный усеченный рецептор; г - нормальный рецептор или компонент сигнального пути постоянно активен
Превращение протоонкогенов в онкогены может происходить не только в результате мутации одного основания. Хромосомные перестройки способствуют транслокации генов, участвующих в контроле дифференциации и деления клеток. Это ведет к образованию онкогенов по нескольким путям.
1. Протоонкоген способен оказаться под контролем другого регуляторного элемента, вызывающего избыточную экспрессию (англ. overexpression) определенного белка. Например, лимфома Бэркитта возникает тогда, когда ген с-myc становится под контроль промотора гена иммуноглобулина.
2. Транслокация может вызывать слияние генов и приводить к образованию онкогенных гибридных белков.
3. Амплификация способна вызвать избыточную продукцию регуляторного белка.
Рак является результатом приобретения клеткой множественных генетических аномалий. В дополнение к превращению протоонкогенов в онкогены, развитие рака часто включает потерю функционального гена-супрессора опухоли. Около половины всех случаев возникновения злокачественных опухолей у человека сопряжено с потерей гена-супрессора опухоли р53. Продукт гена р53 оказывает комплексные эффекты, включающие стимуляцию механизмов репарации ДНК; однако наиболее существенным является его способность контролировать переход от фазы G1 к фазе S клеточного цикла, участвуя в предотвращении неконтролируемого деления клетки.
Замечание по терминологии
Как отмечалось ранее, онкогены называют по названию переносящих их ретровирусов - и записывают курсивом. Так, онкоген ras был найден у вируса саркомы крыс (англ. Rat Sarcoma virus). Онкоген идентифицируется с буквой «V» (для вируса), а протоонкоген - с буквой «с» (цитоплазматический, англ. cytoplasmic). Таким образом, эти гены обозначают соответственно, как v-ras и с-ras и т. д. Белки-продукты записываются как Ras, Raf и т. д. (курсивом не выделяются).
Белок SOS назван по мутации в гене рецепторов у плодовых мушек (sevenless): белок-продукт этого гена называется son of sevenless, отсюда и образовалось название SOS. В дальнейшем оказалось, что этот белок повсеместно присутствует у эукариот. (Не путать этот белок с SOS-ответом Е. coli)
Почему Ras-путь такой длинный?
Заманчиво предположить, что протеинкиназный каскад является механизмом амплификации, аналогичным механизмам распада гликогена и свертывания крови.
Вполне возможно, что Ras-путь взаимосвязан в нескольких точках с другими регуляторными путями.
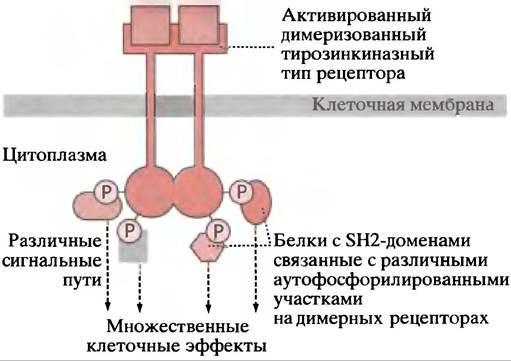
Накапливается все больше данных в пользу существования обширной интерференции (англ. crosstalk), регуляторных механизмов. Так, Ras-белок может фосфорилироваться и активироваться ПКС, после того как последняя будет активирована в фосфоинозитидном пути. Разные протеинкиназы Ras-пути могут иметь другие белки-мишени, активируя таким образом альтернативные пути и регуляторные каскады. Кроме того, активированный тирозинкиназный тип рецептора может соединяться с SН2-белками других сигнальных путей, так что один тип рецептора способен активировать несколько путей (рис. 26.21). Используя аналогию с электричеством, Ras- и другие сигнальные пути являются электронными контурами на очень сложной приборной панели с пересекающимися связями, однако пока мы не можем видеть, как этот «прибор» функционирует в качестве интегрированной регуляторной системы. Характерной чертой сигнальных путей является наличие белок-белковых взаимодействий, которые, по-видимому, образуют сети такой же степени сложности, как метаболические пути.
Рис. 26.21. Гипотетическое изображение, показывающее, каким образом множественные белки с SН2-доменами могли бы играть роль связующих звеньев в интегрированной регуляторной системе
С Ras-путем резко контрастирует другой внутриклеточный рецептор, опосредующий относительно простой сигнальный путь, в котором не участвует тирозинкиназа. Рассмотрим его более подробно.
Прямой внутриклеточный сигнальный путь от рецептора к ядру
Сигнализация интерферонами
В 1957 году было показано, что клетки позвоночных, инфицированные вирусом, секретируют белки, названные интерферонами, которые защищают от тех же или других вирусов (это явление было названо интерференцией). Антивирусная активность интерферонов до конца не понята, но известно, что на генах есть интерферон-стимулируемые чувствительные элементы (ISRE; от англ. interferon-stimulated response elements), так что присоединение интерферона к рецептору клетки вызывает специфические ответы генов клетки.
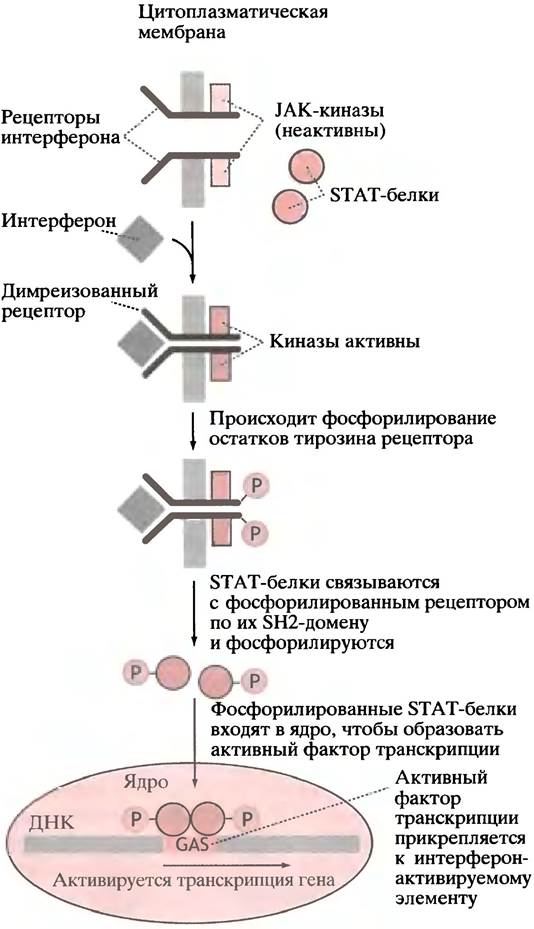
Рецептор у-интерферона отличается от описанного для EGF. С ним связаны две молекулы цитоплазматической тирозинкиназы(JAK-киназы). Связывание лиганда вызывает димеризацию рецепторов; это приводит к активации тирозинкиназы, в результате чего остатки тирозина рецепторного димера фосфорилируются. Это, в свою очередь, вызывает связывание двух цитозольных белков с фосфорилированным рецептором. Белки имеют те же SН2-домены, что и у GRB-белка Ras-пути; как уже отмечалось, SН2-домен найден у белков, взаимодействующих с фосфорилированными рецепторами тирозинового типа. Протеинкиназы, все еще связанные
с рецептором, фосфорилируют два SН2-белка, которые после этого двигаются в ядро, где собираются в активный фактор транскрипции и способствуют транскрипции ISRE-элeмeнтoв (рис. 26.22).
Рис. 26.22. Сигнальный путь, при помощи которого y-интерферон активирует специфическую транскрипцию гена. STAT - передатчик сигнала и активатор транскрипции; GAS - активируемый y-интерфероном элемент последовательности. Обратите внимание, что в отличие от рецептора EGF, который сам является тирозинкиназой, в этом пути димерный рецептор активирует цитоплазматические тирозинкиназы, или Янус- киназы (JAK, Janus kinases), названные в честь двуликого Януса (они имеют два киназных центра). У α-интерферона и нескольких цитокинов есть аналогичные сигнальные пути
Насколько общим является этот прямой путь?
Основной вопрос в том, насколько общей является эта система, или же она специфична в отношении лишь нескольких сигнальных молекул. Широкое распространение системы мог бы обеспечить механизм, где неограниченное число сигналов оказывало бы специфическое влияние на клетки. Известно, что второй интерферон и несколько цитокинов, участвующих в регуляции образования красных кровяных телец, используют именно этот путь. Можно предположить, что различные фосфорилированные рецепторы способны связывать разные цитозольные SH2-белки, которые затем превращаются в различные специфические факторы транскрипции и обеспечивают передачу большого числа сигналов к специфическим клеточным «органам управления».
В заключение можно привести цитату из обзора в журнале «Nature», где говорится: «В течение следующих нескольких лет появятся сотни и даже тысячи статей, описывающих, как различные белки посылают свои сигналы по внутриклеточным сигнальным путям».
Внешние сигналы, регулирующие лиганд-зависимые ионные каналы
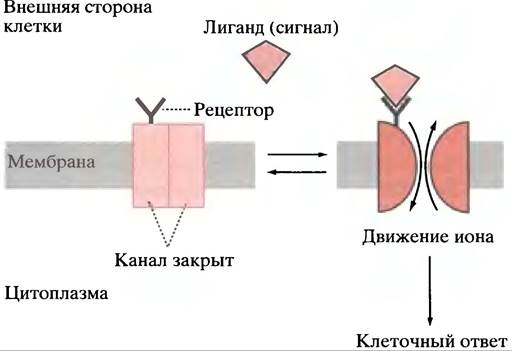
Мы подошли к совершенно особому типу управления, в котором немедленным результатом связывания лиганда с мембранным рецептором является открытие каналов в мембране (рис. 26.23). Для иллюстрации будет использована нейрональная сигнализация.
Рис. 26.23. Лиганд-зависимый канал. Приведены каналы, специфичные для ионов Са2+, Na+, и К+
Каким образом связывание ацетилхолина с мембранным рецептором приводит к нервному импульсу?
Как упоминалось ранее, мотонейрон, подающий сигнал к сокращению произвольной поперечнополосатой мышцы, получает от пресинаптического нейрона ацетилхолин в качестве сигнальной молекулы; он выделяется в синапс и обеспечивает проведение нервного импульса к другому нейрону, который побуждает мышцу сокращаться (см. рис. 26.24).
Нейроны, как и другие животные клетки, содержат высокую концентрацию К+ внутри клетки и низкую - снаружи, в то время как уровень Na+ высок снаружи и низок внутри клетки. Такое распределение ионов является результатом действия ионного насоса Na+/К+- АТРазы в мембране.
В состоянии покоя (когда не происходит передачи нервных импульсов) мембрана клетки более проницаема для К+, чем для Na+. В силу более высокой концентрации внутри клетки К+ выходит наружу, а поскольку мембрана непроницаема для анионов, последние клетку не покидают. Это создает положительный заряд снаружи и отрицательный - внутри, т. е. поляризацию мембраны. Утечка К+- процесс самоограничивающийся. Дальнейшей утечке препятствует образующаяся разность зарядов. Достигается состояние равновесия, при котором потенциал покоя клетки составляет около -70 мВ (отрицательный заряд внутри).
Рецептор ацетилхолина представляет собой лиганд- зависимый Na+/К+-канал. При связывании ацетилхолина канал открывается, позволяя Nа+ двигаться в клетку, а К+ - из нее (см. рис. 26.24). Однако, вследствие гораздо более высоких концентраций, Na+ входит в клетку быстрее, чем К+ выходит из нее, что приводит к уменьшению отрицательного заряда внутри. Т. е. мембрана деполяризуется, причем только в непосредственной близости от ацетилхолиновых рецепторов синапса. Это и есть начальный стимул.
Рис. 26.24. Цепи событий, в результате которых ацетилхолиновая стимуляция мотонейронов приводит к выделению ацетилхолина в нервно-мышечном синапсе, что сопровождается сокращением поперечнополосатой мышцы (упрощенно)
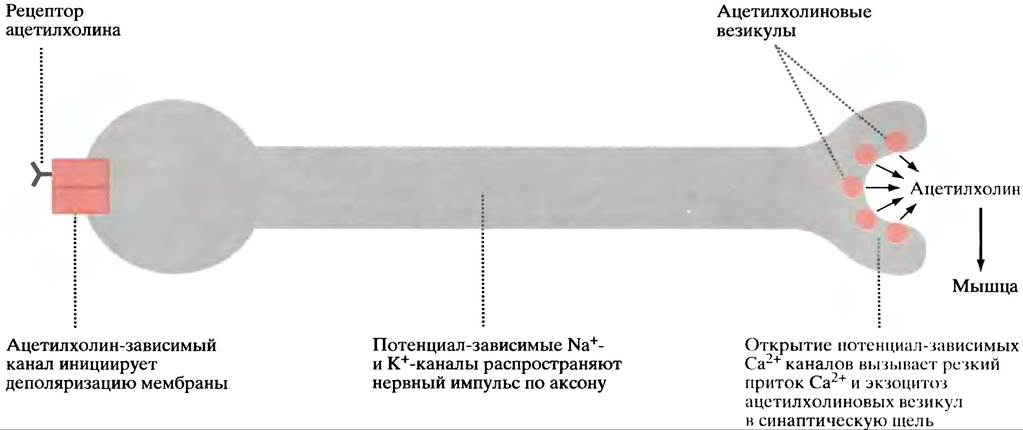
Распространение нервного импульса вдоль аксона происходит за счет вызываемого ацетилхолином повторной деполяризации мембраны, однако в этом участвует другой тип Nа+- и К+-каналов, названный потенциал-зависимым каналом, который открывается при падении потенциала покоя (с -70 до -40 мВ). Изменение потенциала происходит на узко ограниченном участке мембраны и связано с открытием лишь соседних потенциал-зависимых каналов. Каналы открыты очень короткое время, затем они закрываются, и наступает период восстановления. Только после восстановления каналы способны ответить на следующий сигнал. После того как пройдет волна возбуждения, Na+/К+-насос восстанавливает исходную концентрацию ионов.
Подробное знакомство с механизмом нервной проводимости выходит за рамки этого раздела и всей книги. Важно то, что волна деполяризации мембраны проходит по аксону до нервных окончаний. В мембране последних есть потенциал-зависимые Са2+-каналы, которые открываются, когда волна деполяризации их достигнет, позволяя внеклеточному Са2+ войти в клетку. Это приводит к слиянию везикул с ацетилхолином, с клеточной мембраной и высвобождению их путем экзоцитоза (см. рис. 26.24). Са2+-АТРаза выкачивает Са2+, восстанавливая состояние покоя. Выделившийся ацетилхолин связывается с рецепторами мышечных клеток. Дальнейшая последовательность событий описана в главе 28.
Индуцируемый Са2+ экзоцитоз везикул имеет более общее биологическое значение, чем просто участие в выделении нейромедиаторов. Стимулируемый Са2+ экзоцитоз везикул происходит при выделении пищеварительных ферментов из поджелудочной железы; однако здесь выделение Са2+ происходит по фосфоинозитидному пути (см. с. 353).
Оплодотворение яйцеклетки также вызывает индуцируемый Са2+ экзоцитоз везикул, создающий барьер для последующего проникновения спермы.
Другим важным процессом, в котором участвует лиганд-зависимое управление порами, является зрение.
Зрение: процесс, зависимый от контроля открываемой лигандом поры
В основе зрения лежит превращение светового сигнала в химические изменения, приводящие к образованию импульсов в зрительном нерве, несущем сигналы в мозг.
Свет поглощается сетчаткой позвоночных, имеющей два типа клеток: палочки - для восприятия чернобелого и сумеречного света - и колбочки для цветного и яркого света. В палочках есть три сегмента. В средней части расположен обычный комплекс органелл. Один конец образует синапс с биполярной клеткой, которая соединена со зрительным нервом. Другой конец - цилиндрический (палочкообразный) сегмент, в котором есть «батарея» мембранных дисков (около 2000), погруженная в цитоплазму (рис. 26.25). Диски содержат световоспринимающий аппарат.
Рис. 26.25. Структура палочки
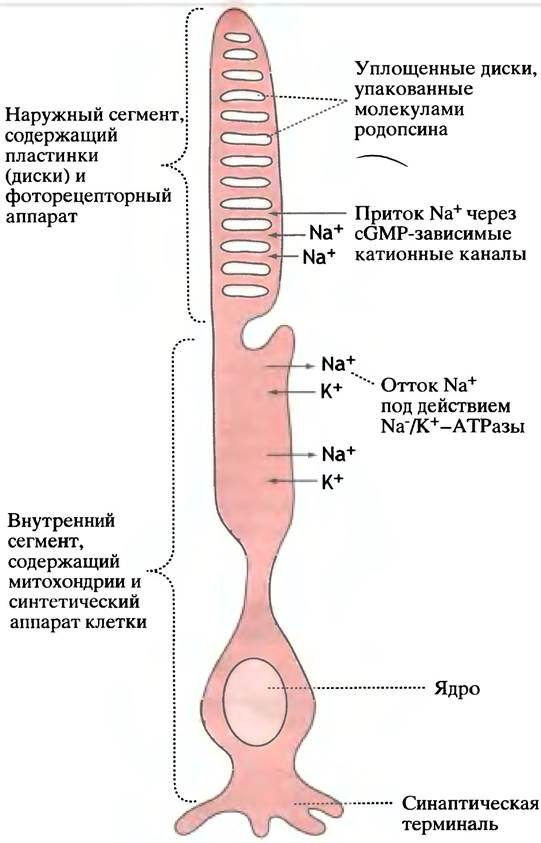
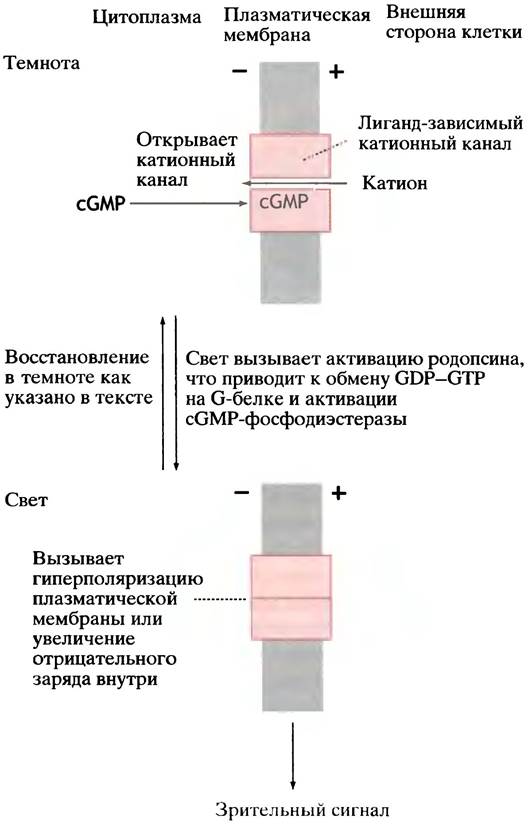
Рис. 26.26. Процесс зрения (упрощенное изображение). Действие света на родопсин приводит к активации сGМР-фосфодиэстеразы. Снижение уровня сGМР влечет за собой закрытие катионного канала, гиперполяризацию клеточной мембраны и передачу импульса по зрительному нерву
Передача светового сигнала
Детали процесса восприятия света сложны; мы познакомимся лишь с основными принципами (рис. 26.26).
В темноте гуанилатциклаза обеспечивает в клетках колбочек довольно высокий уровень сGМР. В клеточной мембране есть лиганд-зависимые катионные каналы, которые сGМР поддерживает в открытом состоянии.
Постоянный приток Na+ в темноте определяется более низким потенциалом на клеточной мембране; равновесие между поступающим и выходящим из клетки Nа+
устанавливает потенциал на уровне -30 мВ (что отличается от ситуации в нейроне, где в состоянии покоя Nа+-каналы закрыты и мембранный потенциал -70 мВ).
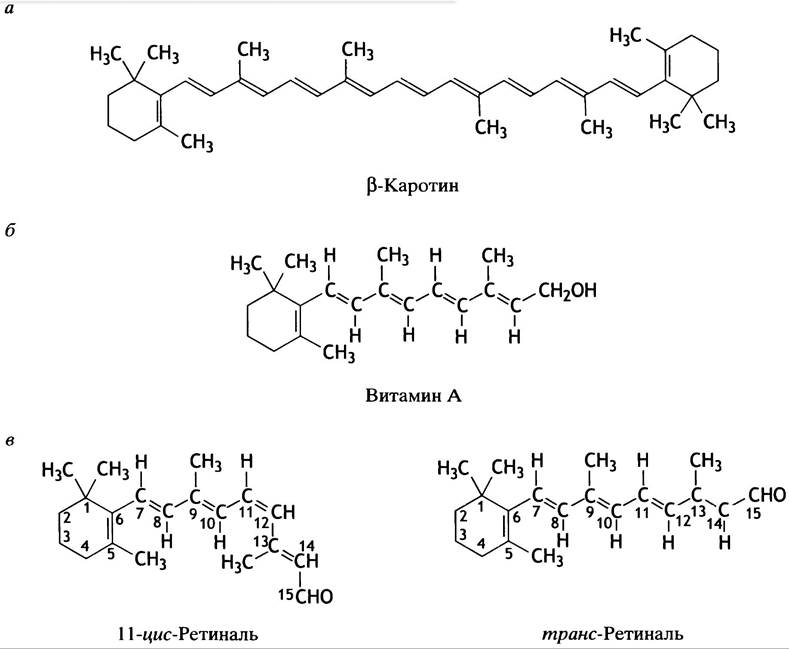
Рецептором, воспринимающим световые фотоны в дисках палочек, является родопсин - комплекс белка опсина и 11 -цис-ретиналя. Свет вызывает активацию родопсина за счет конформационного изменения зрительного пигмента, который полностью становится транс-ретиналем. Посмотрите на структуру, приведенную на рис. 26.27, и обратите внимание на сходство молекулы ретиналя с витамином А и β-каротином.
Рис. 26.27. Структуры β-каротина, витамина А и ретиналя. а - Структура β-каротина - основного пигмента фотосинтеза у растений и предшественника витамина А у животных; б - структура витамина А; в - структура 11 -цис-ретиналя и транс-ретиналя
Активация родопсина запускает цепь реакций с участием тримерного G-белка (и гидролиза GТР, играющего «обычную» роль молекулярных часов). Все это в конце концов приводит к активации фермента, гидролизующего GТР - сGМР-фосфодиэстеразы. Она похожа по действию на сАМР-фосфодиэстеразу (см. рис. 26.9, б).
Снижение уровня сGМР приводит к закрытию Na+ каналов и гиперполяризации мембраны. Таким образом зрительный сигнал поступает в зрительный нерв.
Восстановление клетки после поглощения фотона света - сложный процесс. Он включает: 1) инактивацию родопсина; 2) снижение уровня Са2+ в клетке и стимуляцию синтеза сGМР; 3) сложный кругооборот превращений молекулы родопсина. В конечном итоге уровень сGМР на свету падает, Na+-каналы закрываются и гиперполяризация клеточной мембраны ведет к поступлению зрительного сигнала в зрительный нерв. При освещении уровень сGМР восстанавливается, Na+-каналы открываются - и мы готовы к восприятию следующего фотона.
Вопросы к главе 26
1. Какие классы сигнальных молекул осуществляют сообщение между клетками?
2. Используя простую схему, сравните действие на клетки внешних сигнальных молекул, растворимых и нерастворимых в липидах.
3. Как регулируется образование сАМР? Опишите роль GТР в этом процессе. Какое отношение имеет GТР к холере?
4. Как действует сАМР в качестве вторичного посредника?
5. Каким образом оксид азота осуществляет свое регуляторное действие?
6. сАМР и сGМР - не единственные вторичные посредники. Опишите другую подобную систему.
7. Существуют важные ген-активирующие регуляторные пути, в которых низкомолекулярные вторичные посредники не участвуют. Опишите такой путь.
8. Если белок имеет SH2-домен, то какова его возможная роль?
9. Объясните, каким образом аномальные компоненты клеточных сигнальных путей могут способствовать развитию рака.
10. Опишите путь регулирования активности генов интерфероном.
11. Сделайте общее сравнение механизма активации трех типов рецепторов: А - адренорецептора, активирующего аденилатциклазу; Б — рецептора EGF Ras-пути; В - рецептора интерферона.
12. Что представляет собой потенциал-зависимый Са2+-канал? Поясните на примере.
13. Что такое лиганд-зависимый канал? Приведите пример подобного канала, участвующего в зрительном процессе.