БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ОТВЕТЫ НА ВОПРОСЫ
Глава 1
1. Количество АТР, которое может быть синтезировано при использовании 5000 кДж свободной энергии составляет 5000/55, что соответствует 90,91 моль. Количество образовавшейся динатриевой соли АТР в этом случае составит 551 • 91 г в день, или 50 141 г (72 % веса тела человека). Синтез такого количества АТР возможен потому, что АТР в нашем организме непрерывно распадается до ADP и Pi, и вновь синтезируется.
2. Значение ∆G°′ (-55 кДж • моль-1) относится к стандартным условиям, когда АТР, ADP и Рi. присутствуют в концентрации 1,0 М. В клетке концентрации этих веществ значительно ниже, и фактическое значение ∆G для синтеза АТР будет отличаться от ∆G°′:
![]()
3. АТР и ADP являются высокоэнергетическими соеди нениями фосфорного ангидрида, в то время как АМР - фосфорный эфир с низкой энергией. Значительная экзоэргоничность гидролиза АТР и ADP обусловлена рядом факторов. Во-первых, высвобождение фосфата снижает напряжение, вызванное электростатическим отталкиванием отрицательно заряженных фосфатных групп. Высвобожденные фосфат-ионы расходятся. Во-вторых, экзоэргоническому характеру гидролиза способствует большая, чем у фосфатных групп, резонансная стабилизация свободного фосфат-иона. Гидролиз АМР вызывает незначительное увеличение резонансной стабилизации
4. Очень незначительную, поскольку форма этой кривой зависит от времени, выбранного для измерения активности. При более высоких температурах вероятность инактивации фермента возрастает; при любой заданной температуре количество инактивированного фермента пропорционально времени инкубации фермента при этой температуре. При исследовании термостабильности фермента правильнее инкубировать фермент одинаковое время при различных температурах и после охлаждения измерять активность в каждом образце при нормальной температуре инкубации.
5. А. Неполярные молекулы не могут образовывать водородные связи с молекулами воды. Поэтому молекулы воды, окружающие молекулу бензола, организуются в более высокоупорядоченную структуру, образуя водородные связи между собой. Такое увеличение упорядоченности понижает энтропию и увеличивает энергию системы; поэтому при соприкосновении с водой молекулы бензола вынуждены минимизировать поверхность взаимодействия Бензол-Вода сначала путем формирования сферических глобул, а затем - отдельного слоя. Результат известен как гидрофобное взаимодействие. Б. Полярные группы глюкозы могут образовывать водородные связи с водой. В. Ионы Na+ и Сl-гидратируются, и в результате снижения ионного притяжения свободная энергия уменьшается. Такое разделение ионов характеризуется понижением энтропии.
6. Фермент AMP-киназа переносит фосфатную группу от АТР на АМР в реакции АТР + АМР —> 2ADP. Гидролиз не происходит, поэтому существенных изменений ∆G°′ в реакции не наблюдается.
7. В клетке РРi будет гидролизоваться до 2Рi, поскольку в полностью очищенном ферменте нет неорганической пирофосфатазы. В первом случае ∆G°′ общей реакции соответствует -32,2-33,4 + 10 кДж • моль-1 = -55,6 кДж • моль-1. Для полностью очищенного фермента ∆G°′ = -22,2 кДж • моль-1.
8. Ионные связи, водородные связи и Ван-дер-Ваальсовы силы со средними энергиями 20, 12-29, и 4-8 кДж • моль-1 соответственно. Значение энергии активации формирования слабых связей очень небольшое, и поэтому такие связи могут легко образовываться без участия катализатора и также легко разрушаться, что приводит к гибкости структур, стабилизируемых слабыми связями. Установлено, что для ассоциации молекул необходимо большое количество слабых связей с малым радиусом действия. Такие связи и являются основой биологической специфичности.
9. А.
Б.
![]()
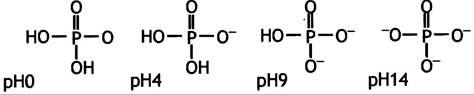
Приемлемым значением рKa будет 7,2.
pH = 7,2 + lg[Nа2НРO4]/[NаН2РO4] = 7,2 + lg 1 = 7,2
В. Гистидин со значением рКа 6.5.
10. Значение ∆G°′ в реакции определяет, может ли реакция протекать, но ничего не говорит о скорости, с которой она будет протекать (если вообще будет). Скорость реакции определяется энергией активации и скоростью образования переходного состояния.
11. Ферменты катализируют химические реакции по ряду причин:
✵ их активные центры фиксируют переходное состояние субстрата прочнее, чем исходный субстрат, понижая тем самым энергию активации;
✵ в активных центрах формируется предпочтительная ориентация реагирующих молекул;
✵ ферменты могут осуществлять общий кислотноосновный катализ реакций;
✵ ферменты способствуют правильной пространственной ориентации металлсодержащих групп, что облегчает протекание реакций.
Глава 2
1. Это полипептидная цепь, образованная большим количеством аминокислот, соединенных пептидными (-CO-NH-) связями.
2. Полипептидная цепь белка свернута в определенную, обычно компактную глобулу, точная укладка которой (фолдинг) зависит от нековалентных и ковалентных (дисульфидных) связей между боковыми группами аминокислот. При высокой температуре эти связи разрушаются, вызывая тем самым разупорядочивание полипептидных цепей белка и превращение их в запутанную нерастворимую массу, лишенную биологической активности. Это и есть денатурация белка.
3. Все примеры даны на с. 38 и 39.
4. А. Около 4; Б. Около 10,5-12,5; В. Около 6,0.
5. Суммарный заряд этой молекулы зависит от содержания аспарагиновой и глутаминовой кислот, а также лизина, аргинина и гистидина. Карбоксильные и аминогруппы прочих аминокислот задействованы в образовании пептидных связей (исключая две концевые).
6. Первичная, вторичная, третичная и четвертичная (см. рис. 2.2).
7. α-Спираль, β-складчатый слой и неупорядоченная спираль, или область соединительной петли. α-Спираль и β-слой удовлетворяют потенциалу водородных связей основной полипептидной цепи (см. рис. 2.3 и 2.4). Неупорядоченная спираль не имеет определенной структуры. Она обычно находится на поверхности белка, где возможно образование водородных связей с водой.
8. См. структуру волокон коллагена, приведенную на рис. 2.8.
9. Десмозиновая группа, показанная на рис. 2.9.
Глава 3
1. Наличие двух гидрофобных хвостов вместо одного.
2. Нет.
3. Только путем экзоцитоза, эндоцитоза или при помощи специальных транспортных механизмов (см. главу 22).
4. Он действует в качестве буфера текучести мембран, предотвращающего чрезмерную ассоциацию полярных липидов.
5.
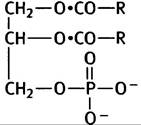
6. Лецитин (холин), кефалин (этаноламин), фосфатидилсерин (серин).
7. Холин заменен на галактозу и олигосахарид соответственно.
8. Образуемый цис-ненасыщенными жирнокислотными хвостами и фосфолипидными мембранами изгиб предотвращает плотную упаковку хвостов жирных кислот липидного бислоя, что делает мембрану более текучей.
9. Из-за наличия окружающей липидные мембраны гидратной оболочки. Ее удаление энергетически невыгодно.
10. Для облегченной диффузии необходимы мембранные белки, позволяющие растворам пересекать мембрану в любом направлении согласно градиенту их концентрации. Для этого процесса энергия не требуется. Примером может служить транспорт анионов в красных клетках крови, который позволяет ионам Сl- и НСO3- проходить через мембрану в любом направлении.
11. Если концентрацию снаружи обозначить С1, а концентрацию внутри обозначить С2, то:
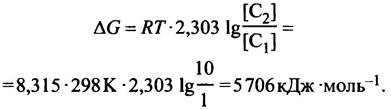
Глава 4
1. Пепсин в виде пепсиногена, химотрипсин в виде химотрипсиногена, трипсин в виде трипсиногена, эла- стаза в виде проэластазы, карбоксипептидаза в виде прокарбоксипептидазы.
2. • Протеолитические ферменты потенциально опасны тем, что они могут атаковать белки, выстилающие протоки пищеварительных желез.
✵ В тонком кишечнике отсутствуют компоненты, атакуемые амилазой, поэтому амилаза сразу синтезируется в форме активного фермента.
✵ Муцины защищают клетки от протеолитической атаки.
3. В желудке кислое значение pH вызывает конформационные перестройки (изменения) в пепсиногене. Они активируют саморасщепление молекулы с отщеплением от пепсиногена пептида, поддерживающего фермент в неактивном состоянии. Образовавшийся пепсин сразу же начинает активировать собственный синтез из пепсиногена, т. е. происходит автокаталитическая каскадная активация. В тонком кишечнике энтеропептидаза (фермент, вырабатываемый клетками кишечной стенки) активирует переход трипсиногена в трипсин, а тот в свою очередь, активирует остальные зимогены.
4. Панкреатит, или воспаление поджелудочной железы, вызванное протеолитическим повреждением пакреатических клеток.
5. Потому что клетки кишечника способны всасывать только мономеры (и моноацилглицерины). Липиды, белки, полисахариды и дисахариды всасываться не могут.
6. Молоко содержит лактозу, гидролиз которой до глюкозы и галактозы катализирует фермент лактаза. В зрелом возрасте многие люди теряют способность синтезировать этот фермент. Лактоза не всасывается и подвергается брожению в толстом кишечнике. Благодаря осмотическому эффекту лактоза способствует поступлению воды в кишечник, вызывая понос.
7. ТАГ, или триацилглицерин - сложный эфир холестерина и жирных кислот.
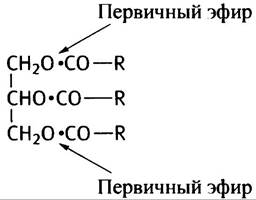
8. Липид (субстрат) эмульгируется движением кишечника и при помощи моноацилглицерина и свободных жирных кислот (образовавшихся при первоначальном переваривании вместе с солями желчных кислот) таким образом, чтобы липаза могла атаковать эмульгированную поверхность субстрата. Продукты переваривания вместе с солями желчных кислот (свободные жирные кислоты и моноацилглицерин) переносятся клетками кишечника в виде дискообразных смешанных мицелл, обладающих высокой емкостью для этих продуктов. Вероятно, на поверхности клетки мицеллы разрушаются.
9. Свободные жирные кислоты и моноацилглицерин ресинтезируются в триацилглицерины, которые включаются в состав липопротеиновых частиц - хиломикронов. ТАГ, холестерин и его эфиры образуют гидрофобное ядро хиломикронов, окруженное оболочкой из фосфолипидов и некоторых белков. Хиломикроны всасываются при помощи экзоцитоза в лимфу и в конечном счете высвобождаются в виде эмульсии в кровь через грудной проток.
Глава 5
1. Хранению глюкозы в свободном виде мешает ее осмотическое давление. Осмотическое давление раствора связано с количеством растворенных частиц. При полимеризации тысяч молекул глюкозы в единую молекулу гликогена осмотическое давление понижается.
2. Запасы гликогена в печени истощаются после 24-часового голодания, а запаса ТАГ обычно хватает на несколько недель. Триглицериды являются более мощным источником энергии, поскольку они более восстановлены и не гидратированы. Кстати говоря, если бы энергия, содержащаяся в липидах, запасалась в виде гликогена, то масса тела была бы значительно большей.
3. Да, потому, что глюкоза может превращаться в ацетил-СоА.
Нет, потому, что ацетил-СоА не может превратиться в пируват.
Не существуют, поскольку в нашем организме нет специальных запасных белков, сохраняющих аминокислоты (исключение составляет молоко).
4. • Печень поддерживает гомеостаз глюкозы в организме, длительное время сохраняя глюкозу в виде гликогена. При голодании печень высвобождает глюкозу для поддержания постоянного уровня сахара в крови. Это необходимо для нормального функционирования мозга.
✵ При длительном голодании печень синтезирует глюкозу для энергообеспечения мозга. Печень преобразует липиды в кетоновые тела, которые мозг (и другие ткани) могут использовать для частичного покрытия энергетических расходов;
✵ В печени синтезируются жиры, предназначенные для экспорта в другие ткани.
5. Нет.
6. Жировые клетки сохраняют жир длительное время. При голодании жировые клетки высвобождают жирные кислоты.
7. Эритроциты полностью зависят от глюкозы, которую в процессе гликолиза перерабатывают в лактат. Вместе с потерей митохондрий при созревании красные кровяные клетки теряют способность синтезировать АТР иным путем, кроме гликолиза.
8. Когда содержание глюкозы в крови высоко, выделяется инсулин. Его выделение служит сигналом для запаса тканями питательных веществ. По мере понижения уровня содержания глюкозы в крови снижается уровень инсулина и повышается уровень глюкагона. Значение уровня глюкагона служит сигналом для высвобождения глюкозы печенью и жирных кислот адипоцитами. Глюкоза и жирные кислоты используются тканями. Захват глюкозы клетками мозга не зависит от уровня инсулина. Он может происходить даже при голодании, когда уровень инсулина чрезвычайно низок.
Кроме того, адреналин может вызывать интенсивную мобилизацию глюкозы и жирных кислот с целью преодоления экстремальной ситуации.
Глава 6
1. Глюкозо-1 -фосфат + UTP —> UDP-глюкоза + РРi,
PPi + Н2O —> 2Рi,
UDPG + гликоген(n) —> UDP + гликоген(n + 1).
Гидролиз РРi делает полную реакцию сильно экзоэргоничной.
2. Реакция образования глюкозо-1-фосфата из неорганического пирофосфата никогда не протекает в клетке, потому что ее субстрат (неорганический пирофосфат) немедленно разрушается. Эта реакция обратна происходящей в клетке, однако в соответствии с правилами систематической номенклатуры, фермент назван по прямой реакции (см. рис. 6.3).
3. Печень и в меньшей степени почки, поскольку именно в этих тканях сосредоточен фермент глюкозо-6-фосфатаза.
4. Глюкоза + АТР —> глюкозо-6-фосфат + ADP. Глюкокиназа имеет гораздо большую Км для глюкозы, чем гексокиназа. При голодании печень возвращает глюкозу в кровь. Это необходимо прежде всего для снабжения глюкозой мозга и эритроцитов. Сразу после захвата клетками мозга и печени глюкоза фосфорилируется. Более низкое сродство глюкокиназы к глюкозе (по сравнению с гексокиназой) приводит к отсутствию конкуренции за сахар крови между мозгом и печенью. Печень эффективно усваивает глюкозу только при ее высоком уровне в крови. Поскольку глюкокиназа не ингибируется глюкозо-6-фосфатом подобно гексокиназе, фосфат может захватывать глюкозу и синтезировать гликоген даже при высоком уровне внутриклеточного глюкозо-6-фосфата.
5. Предотвращение детской галактоземии диетой, лишенной галактозы, возможно потому, что потребности таких больных в галактозе удовлетворяются за счет обратимой эпимеризации UDP-глюкозы в UDP-галактозу. Поэтому исключение галактозы из диеты не предотвращает синтез гликолипидов и гликопротеинов, содержащих галактозу.
6. В капиллярах липопротеинлипаза отщепляет жирные кислоты из ТАГ, и они немедленно поглощаются окружающими клетками.
7. ЛПОНП - липопротеины очень низкой плотности. Они похожи на хиломикроны и переносят холестерин и триацилглицерины от печени к периферическим тканям.
8. Холестерин переносится из печени к периферическим тканям в ЛПОНП. ЛПОНП по мере потери ТАГ превращаются сначала в ЛППП, а потом - в ЛПНП. Последние захватываются периферическими тканями. Однако некоторые из ЛППП и ЛПНП снова поступают в печень. ЛППП и ЛПНП получают холестерин от периферических тканей от ЛПВП, что создает обратный поток холестерина от тканей к печени.
9. Путем превращения в соли желчных кислот в печени.
10. Фермент ЛХАТ переносит остатки жирных кислот от лецитина на холестерин.
11. ТАГ не освобождаются; гормонзависимая липаза, активируемая глюкагоном (или адреналином в критических ситуациях), отщепляет свободные жирные кислоты, которые переносятся кровью к тканям в комплексе с сывороточным альбумином.
Глава 7
1. Гликолиз, цикл лимонной кислоты и электронтранспортная цепь. Эти три этапа окисления глюкозы протекают в цитоплазме, матриксе митохондрий и внутренней митохондриальной мембране соответственно.
2. Структуры приведены на с. 100.
АН2 + NAD+ <-> А + NADH + Н+
В + NADH + Н+ <-> ВН2 + NAD+
3. FAD - переносчик водорода, имеющий следующее строение: циклическая структура изоаллоксазина - рибит-фосфат - фосфат - рибоза - аденин. FAD - производное рибофлавина, представляющее собой простетическую группу, ковалентно прикрепленную к ферменту, и восстанавливающуюся до FADH2.
4. При аэробном гликолизе глюкоза расщепляется до пирувата. Образующийся NADH реокисляется митохондриями. При анаэробном гликолизе скорость гликолиза превышает способность митохондрий к реокислению NADH. Это может происходить, например, при экстремальной ситуации («бегство» или «борьба»). Если накапливающийся NADH не будет быстро окислен, то из-за дефицита NAD+ произойдет торможение гликолиза и выработки АТР. В критической ситуации NADH реокисляется в ходе восстановления пирувата в лактат.

5. ∆G гидролиза равна -31 кДж • моль-1 по сравнению с 20 кДж • моль-1 для эфиров карбоксильной группы; следовательно, тиоловые эфиры являются высокоэнергетическими соединениями.
6. Пируват + СоАSН + NAD+ —> Ацетил-S-СоА + NADH+ + Н+ + СO2
∆G°′ = -33,5 кДж • моль-1.
7. Ацетильная группа поступает в цикл лимонной кислоты.
8. NAD и FADH2 реокисляются электронтранспортной цепью с образованием Н2O и генерацией АТР.
9. Согласно уравнению Нернста, значения ∆G°′ и Е°′ связаны между собой следующим образом: ∆G°′ = -nF∆E°′, где F - число Фарадея = 96,5 кДж • моль-1, а Е°′- разница между редокс-потенциалами донора и акцептора электронов. В данном примере ∆E°′ = -1,035 В (-0,219 - 0,816 В). Поэтому ∆G°′ = -2 (96,5 кДж • моль-1); (-1,035 В) = -3(-1,035) = 194,06 кДж • моль-1.
10. Расщепление жирных кислот до ацетил-СоА.
11. А. Да. Глюкоза превращается в пируват, а пируват- дегидрогеназа преобразует его до ацетил-СоА. Последний может использоваться для синтеза липидов. Б. Нет. Жирные кислоты расщепляются до ацетил-СоА. Для синтеза глюкозы необходим пируват. Реакция, катализируемая пируватдегидрогеназой, необратима. Поэтому у животных ацетил-СоА (а тем более жирные кислоты) не могут превращаться в глюкозу. В. Да, но не путем обращения пируватдегидрогеназной реакции (см. подпись к рис. 7.11).
Глава 8
1. Превращение С6-молекулы в две С3-молекулы происходит при альдозном расщеплении, которое катализирует фермент альдолаза. Для этого необходима структура типа:
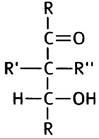
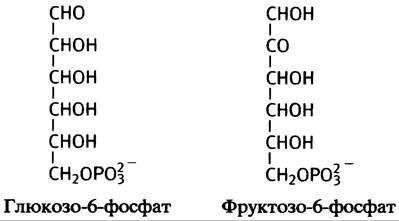
При изомеризации глюкозо-6-фосфата во фруктозо- 6-фосфат образуется альдольная структура, которая может подвергаться такому расщеплению:
2. Процесс синтеза ATP, когда на ADP переносится высоко энергетическая фосфорильная группа, ковалентно связанная с субстратом. Примером может служить окисление глицеральдегид-3-фосфата (см. с. 112).
3. Пируваткиназа катализирует обратную реакцию, но по номенклатуре киназам всегда дают названия по реакции, в которой используется АТР. Эта реакция необратима, потому что ее продукт, енолпируват, спонтанно изомеризуется в кето-форму и этой реакции отвечает большое отрицательное значение ∆G°′.
4. 3 и 2 молекулы соответственно. При фосфоролизе гликогена с использованием Рi образуется глюкозо- 1-фосфат, который изомеризуется в глюкозо-6-фосфат. Для образования глюкозо-6-фосафата из глюкозы требуется затратить молекулу АТР.
5. Потому, что цитоплазматический NADH не может непосредственно проникать в митохондрии; значит, электроны должны транспортироваться посредством одного из двух альтернативных челночных механизмов (шунтов). Малат-аспартатный шунт (см. рис. 8.9) восстанавливает митохондриальный NAD+, а глицерофосфатный челночный механизм восстанавливает FAD глицерофосфатдегидрогеназы внутренней мембраны митохондрий. Редокс-потенциал первого более отрицателен, следовательно, восстановленные эквиваленты поступают в электронттранспортную цепь на уровне различных дыхательных комплексов. В случае глицерофосфатного шунта выход АТР ниже.
6. При расщеплении сукцинил-СоА из GDP и Pi образуется молекула GTP. При этом высвобождается одна молекула Н2O, которая используется в цикле (и как таковая не появляется), уравнивая суммарный баланс.
7. При окислении образуется β-кетокислота, которая легко декарбоксилируется.
8. Реакция, катализируемая пируваткарбоксилазой, пополняет запас оксалоацетата:
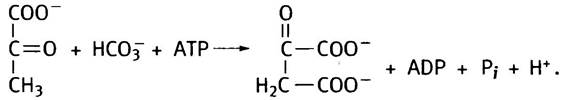
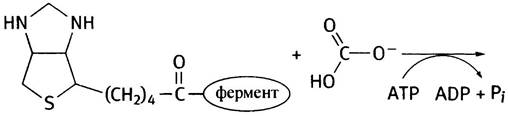
9. Биотин, витамин группы В. При использовании АТР он образует реакционноспособный карбоксибиотин, который может передавать карбоксильную группу субстратам.
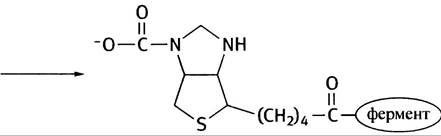
10. Это показано на рис. 8.19.
11. Общее в том, что оба эти вещества - подвижные переносчики электронов. Убихинон соединяет дыхательные комплексы I и II с комплексом III, а цитохром с соединяет комплексы III и IV. Первый локализуется в гидрофобном липидном бислое; последний - в водной фазе на поверхности внутренней мембраны митохондрий.
12. Для перекачивания протонов из матрикса митохондрий через внутреннюю мембрану и генерации электрического и протонного градиентов, которые могут быть использованы для синтеза АТР.
13. У эукариот перенос восстановленных эквивалентов от цитоплазматического NADH к электронтранспортной цепи митохондрий осуществляется при помощи челночных механизмов. В случае глицерофосфатного шунта теряется 1 молекула АТР (из тех, что потенциально могут образоваться при окислении NADH). Поскольку при гликолизе из глюкозы образуются 2 молекулы NADH, это ведет к потере 2 потенциально возможных молекул АТР. У Е. coli такой проблемы не существует. Кроме того, в отличие от клеток эукариот, клетки Е. coli не расходуют энергию для транспорта АТР и ADP через мембрану митохондрий.
Глава 9
1. • Свободные жирные кислоты (из жировой ткани), переносятся сывороточным альбумином крови.
✵ Липопротеинлипаза высвобождает свободные жирные кислоты и триацилглицерины из хиломикронов.
✵ Свободные жирные кислоты могут доставляться из ЛПОНП, образованных в печени; (их высвобождение происходит тем же путем, что и в предыдущем случае.
2. Клетки мозга и эритроциты (эритроциты не имеют митохондрий). См. главу 5.
3. • Активация для образования из жирных кислот ацил-СоА производных;
✵ на внешней мембране митохондрий;
✵ в митохондриальном матриксе;
✵ как производные карнитина (см. рис. 9.1).
4. Реакции, приведенные на рис. 9.2, аналогичны реакциям: сукцинат —> фумарат —> малат —> оксалоацетат цикла лимонной кислоты (как по реакциям, так и по используемым акцепторам электронов).
5. Из 1 молекулы пальмитиновой кислоты образуется 8 молекул ацетил-СоА и происходит восстановление 7 молекул FADH2 и NADH. При окислении NADH и FADH2 образуется соответственно 2,5 и 1,5 молекулы АТР. Если добавить к этому выход АТР в ходе окисления 8 молекул ацетил-СоА (10 АТР на молекулу), то всего образуется 108 молекул АТР (считая GTP из цикла лимонной кислоты за АТР). Из этого количества необходимо вычесть 2 молекулы АТР, использованные в реакции активации. Следовательно, суммарный выход составляет 106 молекул АТР.
6. После 2 раундов β-окисления цис-D3-еноил-СоА изомеризуется в транс-D2-еноил-СоА (см. реакцию на с. 134).
7. В случаях быстрого высвобождения жиров из жировых клеток, как это происходит при голодании или диабете, печень превращает ацетил-СоА в кетоновые тела, которые поступают в кровь. Кетоновые тела преимущественно утилизируются мышцами, способствуя сохранению глюкозы; мозг может покрывать приблизительно половину своих энергетических потребностей за счет кетоновых тел.
8. Синтез ацетоацетата происходит в матриксе митохондрий, а холестерин синтезируется в мембране эндоплазматического ретикулума.
Глава 10
1. Жирные кислоты синтезируются из двухуглеродных фрагментов, донорами которых является трехуглеродная молекула - малонил-СоА. Ацетил-СоА превращается в малонил-СоА путем АТР-зависимого карбоксилирования. Последующее декарбоксилирование имеет большое отрицательное значение ∆G°′. Другими словами, цикл карбоксилирования и декарбоксилирования необходим, чтобы сделать добавление двух углеродных единиц к растущей цепи жирной кислоты необратимой реакцией.
2. Они показаны на рис. 10.1.
3. У эукариот все реакции проходят на одной белковой молекуле, ферментные функции которой осуществляют отдельные домены. Функциональной единицей эукариотической синтазы жирных кислот является димер, объединяющий две молекулы в единое целое. У Е. coli различные реакции катализируются отдельными ферментами. Преимущество эукариот заключается в том, что промежуточные продукты прямо передаются от одного активного центра к другому. У Е. coli продукты должны диффундировать к следующему ферменту, поэтому весь процесс синтеза протекает медленнее.
4. См. структуры на с. 141. NAD+ используется в катаболических реакциях - он принимает электроны в процессах окисления и выработки энергии. NADP+ участвует в процессах восстановительного синтеза. Существование двух этих соединений представляет собой форму метаболической компартментализации, которая облегчает независимое регулирование процессов.
5. Тканями, в которых преимущественно сосредоточен синтез жирных кислот, являются печень, жировые клетки и ткани молочной железы в период лактации.
6. Ацетил-СоА в митохондриях превращается в цитрат, который транспортируется в цитозоль, где цитратлиаза расщепляет его на ацетил-СоА и оксалоацетат. Это ATP-зависимая реакция, что обеспечивает полное расщепление цитрата:
Цитрат + АТР + CoA-SH + Н2 —> ацетил-СоА + оксалоацетат + ADP + Рi.
7. Оксалоацетат восстанавливается в малат NADH-зави- симой малатдегидрогеназой митохондрий. Малат в цитозоле окисляется и декарбоксилируется в пируват малик-ферменТом в NADP+ -зависимой реакции. Такая схема позволяет эффективно переключать восстановительные эквиваленты от NADH к NADPH. Образовавшийся пируват возвращается в митохондрии (см. рис. 10.4). При этом восстанавливается только одна молекула NADPH в расчете на образованную молекулу малонил-СоА, в то время как для реакций восстановления в процессе синтеза жирной кислоты необходимы две. Недостающую молекулу предоставляет глюкозо-6-фосфатдегидрогеназная система, описанная в главе 13.
8. Схема этого процесса показана на рис. 10.5.
9. В синтезе фосфолипидов на основе глицерина возможны два пути. В первом из них фосфатидная кислота присоединяется к спирту типа этаноламина (см. рис. 10.6). Для этого спирт активируется (в синтезе фосфолипидов активированной молекулой всегда является CDP-спирт). Для синтеза некоторых фосфолипидов активируется диацилглицерин (см. рис. 10.6). Это происходит, опять же, путем образования комплекса CDP-диацилглицерин. Ситуация напоминает использование UDP-глюкозы во всех случаях, когда требуется активированный остаток глюкозы.
10. «Эйкозаноиды - биологические регуляторы, светящие из 20 атомов углерода (от греч. еikosi - двадцать). К эйкозаноидам относятся простагландины, тромбоксаны и лейкотриены.
✵ Из полиненасыщенных жирных кислот.
✵ Простагландины вызывают болевую реакцию, воспаление и лихорадку. Тромбоксаны участвуют в агрегации тромбоцитов. Лейкотриены стимулируют сокращение гладких мышц и, вызывая спазм воздухоносных путей, способствуют развитию астмы.
✵ Аспирин ингибирует циклооксигеназу (фермент, участвующий в синтезе простагландинов), поэтому он может подавлять боль и лихорадку, а также препятствовать свертыванию крови.
11. Мевалоновая кислота - первый метаболит, предназначенный только для синтеза холестерина. Структурные аналоги мевалоновой кислоты ингибируют ГМГ-СоА-редуктазу - фермент, ответственный за образование мевалоната.
Глава 11
1. Мозг не может использовать жирные кислоты, он должен получать глюкозу. Это же относится к красным клеткам крови, которые не имеют митохондрий и могут производить энергию только путем гликолиза.
2. Потому что субстратом пируваткиназы является енольная форма пирувата, а кето-енольное равновесие сильно сдвинуто в сторону образования кето- формы; следовательно, фермент не имеет субстрата. Решение этой проблемы лежит в наличии обходного метаболического пути, где на образование фосфоенолпирувата расходуются две высокоэргичные фосфатные группы:
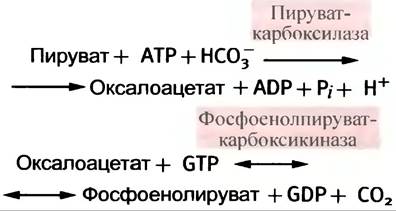
3. Фруктозо-1,6-дифосфатаза и глюкоза-6-фосфатаза, катализирующие образование фруктозо-6-фосфата и глюкозы-6-фосфата соответственно.
4. Нет. Свободная глюкоза образуется только в печени и почках.
5. При нормальном питании (не голодании) повышенная мышечная активность может вызвать образование лактата при анаэробном гликолизе. Он транспортируется кровью в печень, где преобразуется обратно в глюкозу. Высвобождение глюкозы в кровь и ее захват мышцами завершают этот цикл (см. рис. 11.4).
6. Глицеринкиназа необходима для синтеза глюкозы из глицерина (см. рис. 11.5). Освобождение глицерина происходит при голодании, когда поддержание уровня глюкозы в крови становится жизненно важной задачей. Поскольку глюконеогенез протекает в печени, то имеет смысл транспортировать глицерин именно туда, а не метаболизировать его в жировых клетках, которые не могут высвобождать глюкозу в кровь.
7. С помощью глиоксилатного цикла (см. рис. 11.6).
Глава 12
1. Первый - аллостерическая регуляция; второй - ковалентная модификация фермента, основным механизмом которой является фосфорилирование.
2.
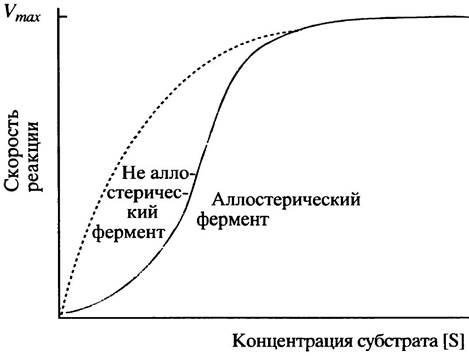
3. Аллостерические эффекторы обычно действуют, изменяя сродство фермента к субстрату. Концентрация субстрата для такого фермента должна быть ниже насыщающей, что, как правило, и бывает. Положительный аллостерический эффектор сдвигает сигмоидную кривую зависимости скорости реакции от концентрации субстрата влево, а отрицательный эффектор - вправо (см. рис. 12.5). Сигмоидная зависимость усиливает влияние аллостерических эффекторов на скорость реакции и, таким образом, увеличивает чувствительность регуляции (см. рис. 12.4).
4. В этих условиях они не оказывают никакого влияния, поскольку изменение сродства фермента к субстрату при насыщающей концентрации субстрата не изменяет скорости реакции.
5. Согласованный и последовательный механизмы показаны на рис. 12.7 и 12.8.
6. Поскольку структура аллостерического эффектора отличается от строения субстрата, различные метаболические системы могут осуществлять регуляторные взаимодействия путем аллостерической регуляции.
7. Внутриклеточная регуляция обычно аллостерическая. Именно она позволяет каждой клетке поддерживать баланс метаболических путей. Правда, аллостерическая регуляция не может определять направление метаболизма в клетке в целом, в зависимости от потребностей всего организма. Это задача внеклеточной системы регуляции (гормонов и т. д.), которая осуществляет управление деятельностью клеток в соответствии с физиологическими потребностями организма.
8. Схема приведена на рис. 12.9. АМР активирует гликогенфосфорилазу и фосфофруктокиназу, в то время как АТР ингибирует ФФК. Высокое молярное отношение ATP/ADPтормозит гликолиз, а понижение уровня АТР (приводящее к увеличению АМР) ускоряет его. При высоком уровне цитрата замедляется поступление метаболитов из гликолиза в цикл лимонной кислоты. Высокий уровень ацетил-СоА может свидетельствовать о недостатке оксалоацетата и, следовательно, о необходимости активации пируваткар- боксилазы для осуществления анаплеротической реакции. В то же время высокий уровень ацетил-СоА указывает на «бесперебойную» поставку пирувата гликолизом, который в данный момент уместно затормозить на уровне ФЕП.
9. Прямая аллостерическая регуляция; фосфорилирование пируватдегидрогеназы (и ее инактивация) под действием киназы; дефосфорилирование протеин- фосфатазой, которая обращает эффект фосфорилирования (см. рис. 12.10).
10. Как показано на рис. 12.11.
11. Высокий уровень глюкозы крови стимулирует выделение инсулина, низкий - выделение глюкагона.
12. Первичным посредником (месенджером) является гормон типа адреналина. При взаимодействии с рецептором клетки он вызывает увеличение внутриклеточного содержания вторичного посредника, который и оказывает влияние на метаболизм. Для двух упомянутых в вопросе гормонов вторичным месенджером является сАМР. Он аллостерически активирует протеинкиназу А (ПКА), которая и осуществляет разнообразные метаболические эффекты.
13. Путем мобилизации переносчиков глюкозы в мембрану клетки (см. рис. 12.17).
14. сАМР запускает каскадную активацию, которая начинается с активации ПКА (см. схему на с. 170).
15. Различия суммированы на рис. 12.22.
16. Разные клетки имеют рецепторы для различных гормонов. Если клетка А имеет рецептор гормона X, то сАМР в этой клетке оказывает эффект, соответствующий гормону X. Клетка В не имеет рецептора гормона X, но имеет рецептор для гормона Y, поэтому сАМР в клетке В вызывает эффекты, свойственные гормону Y, но не гормону X.
17. Фруктозо-2,6-дифосфат. сАМР увеличивает его уровень (см. рис. 12.25).
18. Глюкагон, активируя синтез своего вторичного посредника сАМР, стимулирует глюконеогенез. Одновременно с этим сАМР активирует киназу, которая фосфорилирует пируваткиназу, вызывая ее ингибирование. В мышце адреналин увеличивает образование вторичного посредника сАМР, который стимулирует гликолиз для выработки энергии; поэтому торможение пируваткиназы здесь было бы неуместным.
19. сАМР активирует гормон-чувствительную липазу, которая катализирует гидролиз триглицеридов.
Глава 13
1. Пентозофосфатный путь поставляет рибозо-5-фосфат для синтеза нуклеотидов, образующийся NАDРН используется в синтезе липидов. В пентозофосфатоном пути пентозы претерпевают сложные взаимопревращения с образованием молекул, содержащих от 3 до 7 атомов углерода.
2. В окислительной стадии происходит превращение глюкозо-6-фосфата в рибозо-5-фосфат с выделением СO2 и восстановлением NАDР+.
3. Главными являются трансальдолаза и транскетолаза (см. рис. 13.2), но могут участвовать также ферменты гликолиза.
4. Поскольку трансальдолаза и транскетолаза используют в качестве донора только кетозу, часть рибозо-5-фосфата преобразуется в ксилулозо-5-фосфат. Затем происходят следующие превращения:
1. 2 С5 —> С3 + С7 (транскетолаза),
2. С7 + С3 —> С4 + С6 (трансальдолаза),
3. С5 + С4 —> С3 + С6 (транскетолаза).
2 С5 в реакции 1 - рибозо-5-фосфат и ксилулозо-5- фосфат; конечный С3-компонент - глицеральдегид-3-фосфат, превращающийся в глюкозо- 6- фосфат с потерей Рi. В конечном счете 6 молекул рибозо-5-фосфата преобразуются в 5 молекул глюкозо-6-фосфата и Рi. Таким образом, клетка может производить NADPH без увеличения суммарного содержания рибозо-5-фосфата.
5. В окислительной стадии глюкозо-6-фосфат превращается в рибозо-5-фосфат с выделением СO2. Если учесть, что из 6 молекул глкжозо-6-фосфата образуется 6 молекул рибозо-5-фосфата, из которых может ресинтезироваться 5 молекул глюкозо-6-фосфата, тогда в суммарном уравнении будут фигурировать 6 молекул СO2. Т. е. на бумаге это выглядит как окисление молекулы глюкозы. В действительности же одна молекула глюкозо-6-фосфата не преобразуется в 6 молекул СO2.
6. NADPH требуется для восстановления глутатиона - молекулы, необходимой для защиты эритроцитов. Больные с наследственным дефицитом глюкозо-6-фосфатдегидрогеназы чувствительны к антималярийному препарату памахину, вызывающему гемолитическую анемию.
Глава 14
1. «Световые» реакции включают расщепление воды при использовании энергии света и восстановление NADP+ в NADPH. В ходе «темновых» реакций NADPH используется для восстановления СO2 и воды в углеводы. Термин «темновой» подразумевает, что для протекания таких реакций свет не требуется (это не значит, что они происходят только в темноте). На самом деле наиболее интенсивно темновые реакции протекают при ярком солнечном свете.
2. Это хлорофилл, улавливающий световые фотоны. При возбуждении фотоном один из электронов молекулы хлорофилла переходит на более высокий энергетический уровень. Резонансный перенос энергии позволяет передавать это возбуждение от одной молекулы к другой, пока его не уловят молекулы специального реакционного центра, которые не участвуют в резонансной передаче энергии, а направляют электроны в электронтранспортную цепь (см. рис. 14.4).
3. • Синтез АТР по хемиосмотическому механизму в ходе переноса электронов через bf-комплекс фотосистемы II (см. рис. 14.6).
✵ Синтез АТР в условиях полного восстановления молекул NADP+, когда электроны, транспортируемые переносчиками фотосистемы 1, поступают на bf-комплекс, способствуя образованию большего количества АТР (см. рис. 14.7).
4. Хлорофилл Р680+, который является реакционным центром пигмента фотосистемы II: он возбуждается при резонансной передаче энергии от антенной молекулы хлорофилла и передает электрон феофитину - первому компоненту цепи переноса электронов фотосистемы II. Р680+ характеризуется сильными электронакцепторными свойствами, т. е. является сильным окислителем.
5. Тилакоиды формируются при инвагинации внутренней мембраны хлоропласта (сравните с внутренней мембраной митохондрий), что объясняет кажущуюся противоположную ориентацию протонного насоса.
6. Фермент «Rubisco» (рибулозо-1,5-дифосфаткарбоксилаза) расщепляет рибулозо-1,5-дифосфат на две молекулы 3-фосфоглицерата; в ходе этой реакции происходит фиксация одной молекулы СO2.
7. См. рис. 14.10.
8. Последовательность этих реакций приведена на рис. 14.9.
9. Если СO2 сначала фиксируется ферментом «Rubisco» в молекуле 3-фосфоглицерата, то растение относят к С3-растениям. В реакции, катализируемой этим ферментом, кислород и СO2 конкурируют друг с другом. Однако, при высокой температуре и интенсивном солнечном свете, у С4-растений СO2 первоначально фиксируется пируват-Рi-дикиназой и ФЕП-карбоксилазой в оксалоацетат (см. рис. 14.11), который восстанавливается до малата. Последний поступает в цикл Кальвина. Декарбоксилирование малата под действием малик-фермента приводит к значительному увеличению отношения СO2/O2 (концентрация СO2 в клетках может повышаться в 10-60 раз). Полная схема приведена на рис. 14.11. У различных С4-растений могут встречаться незначительные вариации этой схемы, но основная стратегия избегания оксигенирования под действием рибулозо-5-карбоксилазы остается неизменной.
10. У животных пируваткиназа не может образовывать фосфоенолпируват из пирувата. Однако у растений есть фермент пируват-Рi-дикиназа, который, используя две фосфатные группы АТР, осуществляет такое превращение.
Глава 15
1. Окисление приводит к образованию основания Шиффа, которое гидролизуется в водной среде.
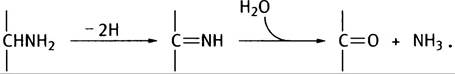
2. Глутаминовая кислота.
3. Трансдезаминирование - наиболее распространенный механизм. Аминогруппа большинства аминокислот переносится на α-кетоглутарат, с образованием глутамата. Последний дезаминируется глутаматде- гидрогеназой:
1. Аланин + α-кетоглутарат —> пируват + глутамат.
2. Глутамат + NAD+ + Н2O —> α-кетоглутарат + NADH + NH4+.
Суммарная реакция:
Аланин + NAD+ + Н2O —> пируват + NADH + NH4+.
4. Пиридоксальфосфат (см. рис. 15.2). Механизм пере- аминирования приведен на рис. 15.3.
5. Удалением Н2O и H2S соответственно (см. рис. 15.4).
6. Глюкогенными аминокислотами являются те, при дезаминировании которых в конечном счете образуется пируват (или фосфоенолпируват). Их превращение в пируват может включать ряд промежуточных стадий, приводящих, например, к образованию промежуточных метаболитов цикла лимонной кислоты. Из кетогенных аминокислот образуется ацетил-СоА. Только лейцин и лизин являются исключительно кетогенными, а некоторые аминокислоты, такие как фенилаланин, являются смешанными. Кетоновые тела образуются из кетогенных аминокислот только в исключительных случаях, например, при голодании. Во всех остальных случаях ацетил-СоА окисляется обычным образом.
7. Фенилаланин обычно не подвергается переаминированию; он превращается в тирозин и после этого метаболизируется (см. рис. 15.5). Если превращение фенилаланина в тирозин нарушено, фенилаланин подвергается переаминированию с образованием фенилпирувата, который вызывает необратимое поражение мозга у детей и ведет к ранней смерти.
8. Тетрагидробиоптерин служит донором восстановительных эквивалентов для образования Н2O из одного атома молекулы кислорода, используемой в реакции гидроксилирования.
9. Активация происходит путем образования 5-аденозилметионина (SAM). SAM имеет структуру иона сульфония, существенно облегчающую отщепление метальной группы. Образование SAM показано на рис. 15.6.
10. См. рис. 15.8.
11. И обильное белковое питание, и голодание характеризуются высокой скоростью дезаминирования аминокислот (в мышцах при голодании белки разрушаются для поддержания синтеза глюкозы), и аминный азот должен быть преобразован в мочевину.
12. • Аммоний превращается в глутамин, который транспортируется в печень и гидролизуется.
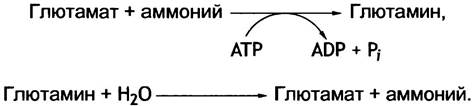
✵ Аминный азот транспортируется из мышц в виде аланина. Аланиновый цикл показан на рис. 15.9.
Глава 16
1. Для разрушения нежелательных молекул и структур, попавших в клетку путем эндоцитоза, а также для завершения жизненного цикла клеточных компонентов.
2. Первичными лизосомами называются пузырьки, образованные аппаратом Гольджи. Они содержат гидролитические ферменты - кислые гидролазы с оптимумом pH 4,5-5,0, который поддерживается при помощи протонного насоса.
3. Объект-мишень находится внутри или эндоцитозного пузырька, или аутофагосомы. Первичная лизосома сливается с этими образованиями в единый пузырек - вторичную лизосому, в которой и происходит переваривание.
4. Существует большая группа наследственных лизосомальных болезней накопления, обусловленных отсутствием определенных гидролитических ферментов, что вызывает перегрузку лизосом веществами, от которых клетка обычно избавляется.
5. При болезни Помпе - наследственном заболевании, характеризующемся недостатком лизосомальной α-1,4-гликозидазы - лизосомы перегружены гликогеном. Однако неясно, почему гликоген удаляется именно таким путем; лизосомы никак не вписываются в хорошо известную схему метаболизма гликогена.
6. Пероксисомы - мембраносвязанные пузырьки цитозоля, содержащие оксидазы. Оксидазы окисляют разнообразные субстраты с использованием кислорода и образованием Н2O2:
R′Н2 + O2 —> R′ + Н2O2.
Пероксид затем используется для окисления других субстратов:
RН2 + Н2O2 —> R + 2Н2O.
В пероксисомах происходит укорочение жирных кислот с очень длинной цепью. Предполагают, что здесь же осуществляется окисление боковой цепи холестерина с образованием солей желчных кислот. При некоторых тяжелых наследственных заболеваниях в ряде тканей обнаружено отсутствие пероксисом.
Глава 17
1. Первичный сигнал, инициирующий свертывание крови, очень мал (в количественном отношении), поэтому для достижения быстрого ответа необходимо каскадное усиление, способствующее многократной амплификации исходного сигнала. На заключительном этапе протромбин активируется и превращается в тромбин-активный протеолитический фермент.
2. Белок фибриноген в мономерном состоянии защищен от спонтанной полимеризации взаимным отталкиванием отрицательно заряженных фибринопептидов (см. рис. 17.2). Удаление фибринопептидов тромбином способствует ассоциации мономеров фибрина (см. рис. 17.3).
3. Между мономерами, входящими в состав полимера, формируются поперечные связи, образованные в ходе ферментативного трансамидирования между боковыми группами глутамина и лизина:
СОNН2 + Н3N+ —> СОNH + NН4+.
4. Витамин К в карбоксилазной реакции является кофактором. В ходе превращения протромбина в тромбин происходит карбоксилирование остатка глутаминовой кислоты и образовавшийся карбоксиглутамат связывает Са2+.
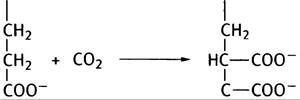
5. Цитохром Р450 участвует в превращении гидрофобных ксенобиотиков в водорастворимые, катализируя следующую реакцию:
АН + O2 + NADPH + Н+ —> АОН + Н2O + NADP+.
6. Для восстановления одного атома кислорода до Н2O.
7. Остаток глюкуронида присоединяется к ОН-группе чужеродной молекулы, делая ее более полярной (см. рис. 17.5).
8. Это АТР-зависимая транспортная система мембран, при помощи которой различные вещества выводятся из клеток. Она транспортирует стероиды в секретирующих клетках коры надпочечников, но все транспортируемые вещества (включая противораковые лекарства, используемые в химиотерапии) являются жирорастворимыми амфипатическими веществами, что свидетельствует о более общем значении этой системы.
9. Нейтрофилы выделяют эластазу в слизь, выстилающую поверхность легочной ткани, которая разрушает эластин — структурный материал легких. Это способствует превращению маленьких альвеол в большие структуры со значительно меньшей поверхностью газообмена. В норме α1-антитрипсин крови диффундирует в легкие и ингибирует эластазу, предотвращая повреждение альвеол. Курение приводит к двум последствиям: 1) оно способствует инактивации α1-антитрипсина в результате преобразования боковой группы метионина в сульфоксид (S —> S = 0); 2) раздражение легкого привлекает нейтрофилы, что увеличивает количество высвобождаемой эластазы.
10. Это молекула кислорода, получившая дополнительный электрон.
O2 + е- —> O2-.
Супероксид - чрезвычайно реакционноспособная молекула, вызывающая повреждение макромолекул.
11. Супероксид опасен, потому что, атакуя молекулы, он инициирует образование других свободных радикалов, вызывающих лавинообразную цепь реакций, нарушающих нормальное протекание жизненно важных процессов. Большинство клеток эукариот содержат супероксиддисмутазу и каталазу, которые катализируют следующие реакции:
2O2- + 2Н+ —> Н2O2 + O2 (дисмутаза),
2Н2O2 —> 2Н2O + O2 (каталаза).
Кроме того, в клетках есть антиоксиданты типа аскорбиновой кислоты и витамина Е. Антиоксиданты являются гасящими агентами. При атаке супероксидом из них образуется свободные радикалы, реакционная способность которых недостаточна для поддержания цепной реакции.
Глава 18
1.5'-фосфорибозил-1-пирофосфат (ФРПФ) - универсальный агент. Он образуется из рибозо-5-фосфата и АТР.
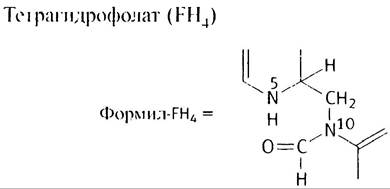
3. Серингироксиметилаза переносит -CH2OH-группу серина на FН4, с выделением глицина и образованием N5, N10-метилен-FH4, который окисляется до N5, N10-метилин-FH4 в NADP-зависимой реакции. Гидролиз последнею приводит к формил-FН4.
4. Она рибоnилирует гуанин и гипоксаптин в процессе реутилизации пуринов.
5. У детей, больных синдромом Леша-Нихана. отсутствует ГТФРТ, поэтому реутилизации пуринов не происходит. Однако в мозге есть прямой путь, приводящий (благодаря повышенному уровню ФРПФ) к избыточному синтезу пуриновых нуклеотидов de novo. У больных отмечен избыток мочевой кислоты, однако использование аллопуринола (тормозящего образование мочевой кислоты) не облегчает выраженности неврологических симптомов, причины которых остаются пока необъясненными. У больных подагрой уровень мочевой кислоты также повышен, но неврологическая симптоматика отсутствует.
6. Аллопуринол превращается в аллоксантин, который ингибирует ксантиноксидазу. Это превращение катализирует сама ксантиноксидаза, следовательно, имеет место суицидное ингибирование (самоинактивация).
7. См. рис. 18.8.
8. Нет Лимидилатсинтаза переносит С1-группу от метилен-FH4 на dUMP и восстанавливает ее до метильной группы. Донорами водорода служит NН4, который превращаемся в FH-2.
9. Он ингибирует восстановление FH2 в FH4. Послсдний необходим для тимидилатсинтетазной реакции, и при его дефиците тормозится образование dTMP, а, следовательно, синтез ДНК и деление клетки.
10. Витамин В12 необходим для метилирования гомоцистеина до метионина, а донором метильных групп служит метил-FН4. Недостаток витамина В12 приводит к тому, что FH4оказывается «пойманным» в виде метилсодержащего соединения, которое не может быть использовано в других фолат-зависимых реакциях.
Глава 19
1. Генетический материал должен быть максимально химически устойчив. ДНК более устойчива, чем РНК. Это обусловлено тем, что 2'-ОН-группа рибозы делает возможной нуклеофильную атаку на фосфодиэфирную связь, снижая тем самым устойчивость РНК по сравнению с ДНК.
2. Линейная структура цепи ДНК ославляла бы гидрофобные поверхности оснований обращенными в воду. За счет гидрофобных сил основания укладываются вместе, изгибая фосфодиэфирную связь (см. рис. 19.3, а).
3. В-ДНК. правозакрученная, 10 пар оснований.
4. У одной цепи ДНК пеночка нуклеотидов 5' —> 3' идеи в одном направлении, а у другой в противоположном. Таким образом, каждый конец линейной молекулы ДНК содержит 5'-конец одной цепи и 3'-конец другой цепи.
5. Направление 5' —> 3' означает, что вы двигаетесь oт концевой 5'-ОН-группы к 3'-OН-группе полинуклеотидной цепи.
6. Приведенная структура показывает одну цепь следующего дуплекса:
5' CATAGCCG 3'
3' GTATCGGC 5'
Спаривание оснований по Уотсону-Крику объясняем комплементарную последовательность. Линейную последовательность одной цепи ДНК условились записывать с 5'-концом, расположенным слева.
7. • ДНК хромосом эукариот, намотанная вокруг октамера гистоновых белков в два оборота (146 пар оснований). Нуклеосомы последовательно соединены линкерной ДНК.
✵ Когда хроматин расщепляется ДНКазой, фрагменты, содержащие 146 пар оснований ДНК. защищены от действия фермента: это наблюдение привело к открытию нуклеосом (см. рис. 19.7).
Глава 20
1. Фрагмент ДНК. репликация которого начинается с одной точки начала репликации.
2. Перед репликативной вилкой образуются положительные сверхвитки.
3. У Е. coli гираза (топоизомераза II) вводит отрицательные сверхвитки. У эукариот топоизомераза I расслабляет положительные сверхвитки.
4. См. рис. 20.6 и 20.7.
5. При наматывании ДНК вокруг нуклеосомы возникают локальные отрицательные сверхвитки, но поскольку связи при этом не нарушаются, суммарной отрицательной сверхспиралилации нет. Локальные отрицательные сверхнитки компенсированы локальными положительными сверхвитками в других местах. Они расслабляются под действием топоизомералы I, оставляющей суммарные отрицательные сверхвитки в ДНК.
6. dATP, dGTP, dCTP и dTTP.
7. Цитозин легко дезаминируется с образованием уранита: если бы уранил был нормальным компонентом ДНК, то было бы невозможно распознавать и скорректировать мутацию, так как спаривание А-U точно такое же, как и А-Т.
8. • Нет. Требуется праймер. ДНК-полимераза не может инициировать синтез новых цепей.
✵ Синтел идет в направлении 5' —> 3'. следовательно, новая цепь, элонгируется в направлении 5' —> 3', и новые нуктеотиды добавляются к свободному 3'-ОН-концу предшествующего нуклеотида.
9. Гидролиз неорганическою пирофосфата: спаривание оснований нуклеотилов.
10. Высокая процессивность означает, что после присоединения к матрице ДНК полимераза III перемешается по ней на большое расстояния, без отсоединения, синтезируя новую цепь. Такой аффект достигается «кольцевым зажимом» кольцом белков, которое собирается позади полимеразы, и цепь ДНК проскальзывает сквозь него (ем. рис. 20.14).
11. Полимераза I фермент, соединяющий фрагменты Оказаки в непрерывную отстающую цепь. Ее активности суммированы на рис. 20.16.
12. Правнльное спаривание входящих нуклеотидтрифосфатов с матрицей имеет первостепенную важность. Полимераза III Е. coli также может исправлять ошибки считывания. Ее 3' —> 5'-экзонуклеазная активность удаляет последний включенный нуклеотид в случае неправильного спаривания оснований.
13. Существует метилзависимая система репарации Е. coli (см. рис. 20.19). У человека также существуют белки, выполняющие аналогичную функцию: при их недостатке повышается риск канцерогенеза.
14. При облучении ДНК ультрафиолетовым светом образуются димеры тмина. Два смежных тиминовых основания связываются ковалентно. Репарация может осуществляться либо прямой светочувствительной системой, которая разрушает связи и восстанавливает отдельные основания, либо молекула подвергается эксцизионной репарации (см. рис. 20.20).
15. Как показано па рис. 20.22. после удаления 3'-праймера фрагмента Оказаки остается нереплицированный участок.
16. С помощью теломерной ДНК. Схема ее синтеза приведена на рис. 20.23.
Глава 21
1. РНК-полимераза использует рибонуклеотиды АТР СТР, GTP и UTP в качестве субстратов; а ДНК-полимераза dATP, dCTP, dGTP и dTTP. РНК-полимераза может инициировать синтез новых цепей: ДНК-полимеразе для этого необходим праймер. Приснится РНК никогда не происходит исправления ошибок считывания.
2. Они приведены на рис. 21.4. Промотор имеет блок. Прибнова и элемент 35.
3. РНК-полимераза неспецифически присоединяется к ДНК, но при взаимодействии с молекулой сигма фактора фермент связывается точно с промотором. Блок Прибнова и элемент 35 способствуют правильной ориентации полимеразы. Фермент синтезирует несколько фосфодиэфирных связей, после чего сигма-фактор отделяется, и полимераза продолжает дальнейшую транскрипцию мРНК.
4. Один из них обусловлен структурой шпилечной G-C петли, показанной на рис. 21.7. В ней внутренней, спаривание оснований G=C в мРНК предотвращает связывание с матричной цепыо ДНК. Последовательности уридиновых нуклеотидов еще более ослабляют связь с ДНК (пара U=A содержит только две водородных связи), облегчая отделение. Второй способ терминации связан с Rho-фактором - хеликазой которая раскручивает гибрид мРНК ДНК. На участке терминации полимераза останавливается (возможно, благодаря повышенному содержанию G-Сна этом участке ДНК); Rho-фактор догоняет ее и отделяет мРНК.
5. Точная последовательность оснований блока Прибнова и элемента -35. расстояние между ними, а также основания в области от +1 до -40.
6. См. puс. 21.10.
7. У эукариот первичный транскрипт содержит нитроны, которые должны быть удалены; 5'-конец копируется; механилм терминации неизвестен: мРНК (за редким исключением) полиаденилирована с 3'-конца.
8. Механизм показан на рис. 21.13. Консенсусная последовательность определяет место сплайсинга, а реакция трансэтерификации сопровождается незначительным изменением свободной энергии. Прерывистые гены могут облегчить эволюцию, способствуя тасованию экзонов. Дифференцированный сплайсина может также приводить к тому, что один и тот же ген определяет синтез различных белков.
9. Полимераза III эукариот присоединяется нс к ДНК, а к белковому комплексу, который собирается на ДНК (рис. 21.19). Кроме того, с этим комплексом может быть связано несколько факторов транскрипции (см. рис. 21.20).
10. Белки «спираль-поворот--спираль», белки «лейциновой молнии», белки типа «цинковых пальцев» и белки гомеодомена.
Глава 22
1. Если бы использовались только 20 кодонов, осталось бы 44 некодирующих триплета. Любая мутация в кодирующей области гена е высокой долей вероятности вызывала бы инактивцию гена, преждевременно внедряя стоп-кодон. При использовании 61 кодона замена основания либо не вызывает изменений (из-за вырожденности генетического кода), либо приводит к замене одной аминокислоты на другую (часто похожую по структуре). Три триплета аминокислоты не кодируют и являются стоп-кодонами.
2. Потому что существует механизм качания (неоднозначного связывания).
3. Последовательность оснований РНК всегда записывают так, что 5'-конец расположен слева. Когда мРНК изображается таким способом, основания антикодона тРНК должны быть приведены антипараллельно, поэтому молекулу тРНК и записывают в перевернутом виде с 5'-концом справа.
4. Проверка правильности присоединения аминокислоты к тРНК. Пауза в катализируемом EF-Tu гидролизе GTP на стадии элонгации дает время неспаренным аминоацил-тРНК покинуть рибосому.
5. Гидролиз GTP до GDP и Рi, приводит к конфирмационным изменениям в G-белках. GTP участвуем в сборке инициаторного комплекса Е. coli, в доставке аминоацил-тРНК к рибосоме с помощью EF-Tu фактора. GTP используется также на этапе транслокации.
6. Для объяснения понадобится рис. 22.11. Приведенный на рисунке «раскачивающийся» механизм (модель I) имеет то преимущество, что при перемещении от одного участка к другому тРНК никогда полностью не отделяется. Это также означает, что пептидильная группа не должна перемещаться относительно рибосомы. На рис. 22.11 приведены два возможных механизма. Модель II объясняет, почему рибосома имеет две субъединицы.
7. Эту несовместимость объясняет рис. 22.13. Механизм нахождения инициирующего кодона AUG предусматривает существование только одного стартового участка. Как показано на рис. 22.9, инициация у прокариот может одновременно осуществляться с нескольких стартовых участков.
8. Шапорины связываются с растущими полипептидами и предотвращают их преждевременное неправильное сворачивание. Высвобождение шаперонов в нужный момент облегчает правильное сворачивание, однако полной ясности в понимании этого процесса пока нет (подробнее см. с. 298).
9. Болезни, вызванные прионами (см. с. 298).
10. См. рис. 22.16.
Глава 23
1. При использовании механизма нормального рецептор-опосредованного эндонитоза (ем. рис. 23.1).
2. Последний должен перенести в клетку РНК-репликазу; (+)-цепыо РНК вируса является мРНК, кодирующая РНК-репликазу.
3. Вирус коровьей оспы реплицируется в цитоплазме: полимераза хозяина находится в ядре.
4. РНК ретровируса копируется в двухцепочечную ДНК, которая внедряется в хромосому хозяина (ем. рис. 23.5).
5. Механизм показан на рис. 23.3.
6. Защитное действие антител при гриппе направлено па белок гемагглютинин. Он постоянно мутирует, но поскольку на молекуле гемагглютинина существует большое количество эпитопов, потеря иммунитета происходит постепенно. Этот антигенный дрейф делает людей восприимчивыми к инфекции, но частичная защита ослабляет течение заболевания. Формирование в результате рекомбинации между двумя различными штаммами совершенно новой» гемагглютинина может привести к возникновению смертельно опасной пандемии.
7. Поверхностные белки вируса специфически связывают нейраминовую (сиадовую) кислоту, которая присутствует и на конце молекулы гликофорина эритроцитов. Поэтому при смешивании с эритроцитами вирусы связываются с ними, вызывая агглютинацию.
8. Вирус связывается с клеткой хозяина при помощи гликопротеина, оканчивающегося нейраминовой кислотой. Фермент, катализирующий разрушение нейраминовой кислоты, необходимой для проникновения в клетку вирусу может быть нужен для: а) облегчения выхода новых вирусных частиц, способных прочно связываться клеточными гликопротеинами; б) для разжижения слизи, содержащей нейраминовую кислоту, что облегчает вирусу путь к поверхности клетки. Разжижение слизи может также помогать распространению вируса при чихании.
9. Бактериофаг может входить в литическую или лизогенную фазы (см. рис. 23.7).
10. А. Маленькая, инфекционная, обнаженная молекула РНК. лишенная оболочки. Б. Нет. У вироидов отсутствуют длинные кодирующие последовательности оснований, которые могли бы содержать информацию об аминокислотной последовательности белка.
Глава 24
1. Панкреатическая ДНКаза разрезает ДНК беспорядочно. Фермент рестрикции разрезает ДНК в строго определенных местах, узнавая короткие последовательности оснований.
2. Адениновые основания ДНК всех прилегающих к гексамеру последовательностей R-штамма Е. coli метилированы, поэтому фермент не распознает их. Чужеродная ДНК такой зашиты не имеет.
3. «Липкими концами» называют концы, образующиеся при зигзагообразных разрезах, которые формируют большинство ферментов рестрикции.
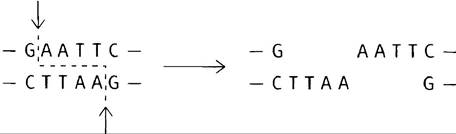
Выступающие концы ДНК будут автоматически «слипаться» в результате спаривания оснований.
4. Клон генов - клонированный участок ДНК, идентичный последовательности ДНК в хромосоме. Клон кДНК означает комплементарную ДНК, которая идентична мРНК гена. Клон генов содержит интроны, а кДНК - нет.
5. Этапы подготовки геномной библиотеки показаны на рис. 24.1.
6. Этапы выделения приведены на рис. 24.2.
7. Нуклеотид, лишенный 3'-ОН-группы. Когда ДНК-полимераза присоединяет дидезоксинуклсотидтрифосфат к вновь синтезируемой ДНК, дальнейший рост цепи ДНК прекращается.
8. Участок ДНК на хромосоме можно амнлифицировать. Процесс включает копирование фрагмента ДНК и многократное копирование копий. Значение этого процесса состоит в том, что, располагая минимальным количеством ДНК (слишком малым для любых исследований), можно наработать необходимое для эксперимента количество интересующего фрагмента. Помимо фермента и субстратов требуются праймеры для копирования фрагмента в обоих направлениях, следовательно, должна быть известна последовательность оснований на концах амплифицируемого фрагмента.
9. Плазмида с удобным участком для встраивания клона кДНК определенного белка, содержащая также соответствующие бактериальной ДНК транскрипционные (промотор) и трансляционные сигналы. ДНК транскрибируется, и мРНК транслируется в бактериальной клетке. Такой плазмидный вектор может быть использован для наработки больших количеств интересующего белка.
10. Рестрикационным анализом называют методический прием для выявления генных дефектов. Если ДНК нарезается ферментами рестрикции, а полученные фрагменты разделяются при помощи гель-электрофореза, то, используя гибридизационные методы, электрофоретические полосы можно визуализировать. При мутациях картина таких полос будет меняться.
Глава 25
1. См. рис. 25.3.
2. Образование многочисленных генов иммуноглобулинов представлено на рис. 25.4.
3. В-лимфоциты (В-клетки) производят антитела (после активации и созревания в плазматические клетки). Для этого В-клеткам необходим контакт с хелперными Т-лимфоцитами (Т-клетками). Цитотоксические Т-клетки (или киллерные клетки) связываются с клетками хозяина, представляющими чужеродный антиген, вызывая их гибель посредством перфорации мембраны или стимуляции апоптоза.
4. Антиген-представляющая клетка - тип фагоцита, который поглощает чужеродный антиген, подвергает его процессингу на фрагменты и выставляет антиген в комплексе с молекулами МНС класса II. Если неактивные хелперные Т-клетки взаимодействуют с комплексом антиген-МНС, то происходит активация Т-клеток (см. рис. 25.4).
5. В обоих случаях это МНС класса I.
6. Теорией клональной селекции называется теория, объясняющая процесс селекции клеток, секретирующих антитела. Каждая В-клетка вырабатывает свое антитело. Для любого антигена есть несколько специфичных В-клеток. но только когда антиген связывается с антителом, фиксированным на мембране В-клетки, та пролиферирует с образованием клопа. Таким образом антиген автоматически выбирает В-клетки, подвергаемые пролиферации.
7. Все антигены, которые связываются в процессе первичною созревания В-клеток в костном мозге или Т-клеток в тимусе, являются аутоантигенами. На них не должно быть иммунною ответа, поэтому на данной стадии развития клетки, реагирующие на аутоантигены, будут уничтожены. После выхода из костного мозга или тимуса связывание с антигеном активирует клетки.
8. Выделение антитела достигается при помощи различною сплайсинга нитронов: у 3'-конца гена иммуноглобулина существует экзон. кодирующий последовательность якорных полипептидов. В начале секреции переключение сплайсинга приводит к их исчезновению.
9. Начало секреции в В-клетках сопровождается соматической мутацией, которая модифицирует вариабельный участок. Поскольку связывание антигена вызывает активную быструю клеточную пролиферацию, такая модификация служит механизмом отбора клеток, производящих «лучшие» антитела.
10. CD4 есть на поверхности хелперных Т-клеток. Он связывается с константным белковым компонентом молекул МНС класса II, поэтому взаимодействует только с В-клетками. хелперпымн Т-клетками и антиген-представляющими клетками, которые содержат белки этого класса. На поверхности цитотоксических Т-клеток сеть белок CD8, который связывается с молекулами МНС класса I: полому Т-киллерные клетки взаимодействуют только с клетками, содержащими этот тип молекул. Белок CD4 является рецептором. с помощью которого вирус СПИДа инфицирует хелперные Т-клетки.
Глава 26
1. Эндокринные гормоны, факторы роста и нейромедиаторы.
2. Действие сигнальных молекул, растворимых и нерастворимых в липидах, представлено на рис. 26.1.
3. Схема регуляции аденилатциклазы - фермента, ответственного за синтез сАМР изображена на рис. 26.11.
Гидролиз GТР играет роль молекулярных часов. При холере токсин необратимо инактивирует GТРазу, в результате чего образование с АМР остается повышенным. Это приводит к потере Nа и воды организмом.
4. сАМР аллостерически активирует протеинкиназу А (ПКА), которая фосфорилирует различные белки-мишени, включая ферменты и факторы транскрипции. Кроме того, существуют гены, содержащие сАМР- чувствительные элементы (СREs). Из этого следует, что сАМР. возможно, оказывает существенное влияние на генную регуляцию.
5. Окид азота NО активирует цитоплазматическую гуанилатциклазу. которая синтезирует сGМР. Последним является вторичным посредником и активирует ИКG.
6. Такой системой является фосфоинозитидный каскад. Он включает рецептор-зависимую активацию мечбраносвязанной фосфолипазы с, высвобождающей инозиттрифосфат IР3 и диацилглицерин ДАГ. IР3 увеличивает концентрацию цитоплазматического Са2+, а ДАГ активирует протеинкиназу ПКС. Таким образом, IP3 и ДАГ являются вторичными посредниками (см. рис. 26.16).
7. Ras-путь имеет рецепторы тирозинкиназного типа и включает фосфорилирование белков-посредников (см. рис. 26.18).
8. Такой белок может связываться с фосфорилированным рецептором тирозинкиназного типа (см. рис. 26.211 и активировать клеточные регуляторные пути.
9. Если рецептор или. например, компонентRas-пути аномально постоянно активен, избыточная экспрессия гена, кодирующего факторы транскрипции, может способствовать неконтролируемому делению клетки (см. рис. 26.22).
10. См. рис. 26.22.
11. • Активация адренорецептора вызывает аллостерическое изменение цитоплазматического домена, связывающегося с гормоном.
✵ Активация рецептора EGF RAS-пути вызывает димеризацию рецептора и активацию аутофосфорилирования остатков тирозина.
✵ Активация рецептора интерферона включат димеризацию рецептора и связывание со специальном тирозинкиназой, которая фосфорилирует рецептор (см. рис. 26.6, 26.17 и 26.22).
12. Такой Са2+ канал, есть, например, в мембране нервного синапса, который высвобождает ацетилхолин для инициации мышечного сокращения. Канат открывается, когда до пего доходит волна деполяризации мембраны нейрона. Резкое изменение концентрации Са2+ вызывает освобождение ацетилхолина (см. рис. 26.24).
13. Лиганд-зависимым называется канал, открывающимся при связывании со специфическим лигандом. В процессе световосприятия катионные каналы мембран палочек отрываются при помощи cGMP. Свет вызывает снижение концентрации cGMP, что приводит к закрытию канала. Возникающая гиперполяризация мембран палочек преобразуется в импульс зрительного нерва.
Глава 27
1. На первой стадии 5-аминолевулинат (ALA) синтаза катализирует реакцию взаимодействия глицина с сукцинид-СоА (см. рис. 27.5), а на второй- ALА-дегидратаза образует пиррол порфобилиноген (см. рис. 27. 6).
2. Повышенная активность ALA-синтазы в печени обнаружена при острой перемежающейся порфирии, хотя взаимосвязь между образованием ALA и неврологическими симпиомами непонятна.
3. Механизм регуляции активности и показан на рис. 27.8.
4. Миоглобин обладаем более высоким средством к кислороду. В отличие от сигмовидной кривой гемоглобина, кривая насыщения миоглобина имеет вид гиперболы (см. рис. 27.11).
5. Согласно принятой модели, гемоглобин существует в состояниях низкого (Т) и высокого (R) сродства к кислороду. Связывание кислорода смещает равновесие в сторону увеличения количества молекул, находящихся в R-состоянии.
6. При связывании кислорода с железом, входящим в состав гема, железо перемешается в плоскость порфиринового кольца. Для того, чтобы это произошло, необходимо некоторое уплощение терапиррола. Железо присоединяется к F8-гистидину белка, вызывая перестройку белковой молекулы, что приводит уплощению тетрациррола. Все эти перемещения влияют на взаимодействие субъединиц, вызывая конфармационный переход тетрамера из Т- в R-форму (см. рис. 27.13).
7. Гемоглобин взрослого человека в дезоксигенированном состоянии имеет полость, в которой 2.3-дифосфотлицерат (ДФГ) связывается с положительно заряженными труппами белков. Связывание ДФГ возможно только в дезоксигенированном состоянии, поэтому оно снижаем средство гемоглобина к кислороду. Фетальный гемоглобин содержит y-субъединицу вместо β-субьединицы, характерной для взрослых. В y-субьединице нет одной из заряженных групп, участвующих в связывании ДФГ. Поэтому ДФГ связывается с фетальным гемоглобином менее прочно, a его сродство к кислороду выше, чем у материнского гемоглобина.
8. Это необходимо для транспорта СО, в виде НCO (см. рис. 27.15).
Глава 28
1. Источником АТР для быстрыхволокон служит ликолиз, а для медленных, окислительный метаболизм. Быстрые волокна обеспечивают мгновенные реакции спасения («бегство» пли «борьба»), по в таких волокнах быстро развивается утомление. Медленно сокращающиеся волокна получают АТР в ходе окислительного метаболизма и могут функционировать значительно дольше без признаков утомления, но для увеличения выработки энергии требуется время. У людей имеются оба типа мышц. Мышцы спины, поддерживающие позу в течение длительных периодов, наносятся в основном к типу медленно сокращающихся, а мышцы глазного яблока к быстро сокращающимся.
2. См. рис. 28.1 и 28.2.
3. Ответ суммирован на рис. 28.7.
4. Стимуляция мышечного рецептора ацетилхолином ведет к высвобождению ионов Са2+ из саркоплазматического ретикулума. С актиновыми филаментами связаны молекулы тропомиозина, которые, в свою очередь, содержат Са2+ -чувствительный тропониновый комплекс. В отсутствие Са2+ тропомиозин блокирует взаимодействие головки миозина с актиновым филаментом. При связывании Са2+ с тропониновым комплексом происходит конформационное изменение, способствующее связыванию миозина с тонким филаментом и развитию сокращения. Са2+ -АТРаза возвращает Са2+ в саркоплазматический ретикулум, и сокращение завершается.
5. В головках миозина гладкой мышцы имеется р-легкая цепь, которая ингибирует связывание головки миозина с актиновым филаментом, препятствуя сокращению. Нейрогенная стимуляция открывает каналы, позволяющие Са2+ входить в клетку. Са2 связывается с регуляторным белком кальмодулином, который активирует киназу легких цепей миозина. Фосфорилирование легкой цепи снимает ингибиторный эффект, и происходит сокращение.
Глава 29
1. В немышечных клетках актин образует филаменты. Актиновые волокна, прикрепленные к клеточной мембране, позволяют небольшим пучкам молекул миозина развивать тянущую силу. Помимо участия в сокращении немышечных клеток актиновые филаменты формируют путь, по которому передвигаются молекулы минимиозина. Последние имеют обычные миозиновые головки, но длинная хвостообразная структура, свойственная миозину мышц, заменена коротким хвостом, к которому могут прикрепляться транспортные пузырьки.
2. Микротрубочки - это полые трубки, образованные при полимеризации субъединиц белка тубулина. Они имеют определенную полярность, и их концы обозначаются соответственно, как (+)- и (-)-конец.
3. Центр организации микротрубочек защищает (-)-конец. (+)-Концы растущих трубочек защищены комплексом тубулин-GТР. GТР медленно гидролизуется, снимая защиту. Если новые субъединицы присоединяются после гидролиза GТР, происходит деполимеризация микротрубочки. Когда микротрубочка достигает своей «мишени», се (+)-конец становится защищенным.
4. Кинезин и динсин - молекулярные двигатели, которые перемещаются по трубочкам и тянут за собой внутриклеточные «грузы». Кинезин и динеин передвигаются по микротрубочке в противоположных направлениях: от (-)- к (+)-концу и от (+)- к (-)-концу соответственно.
5. Микротрубочки не могут сокращаться. Укорочение происходит вследствие деполимеризации микротрубочек. но что вызывает движение хромосом, пока неизвестно.
6. Промежуточными называют филаменты с диаметром 10 нм. Их размеры занимают промежуточное положение между размерами филаментов микротрубочек (20 нм) и актина (6 нм).
7. Промежуточные филаменты служат структурной основой волос, придают жесткость структурам типа нервных волокон и Z-диcкoв саркомеров.