БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 2. СТРУКТУРА БЕЛКОВ
С полным правом можно утверждать, что нет другого вещества с такими удивительными свойствами, как белок. Ничего нельзя понять в биохимии, не оценив всеобъемлющей роли белков в жизни. Если клетке нужно совершить какую-либо работу, почти всегда ее выполняет определенный белок. Жизнь зависит от тысяч белков, которые устроены так, что их молекулы с невероятной точностью распознают другие молекулы и взаимодействуют с ними. Химические реакции в клетке протекают благодаря связыванию ферментов с субстратами, а скорость ферментативных реакций во многих случаях определяется избирательным связыванием аллостерических регуляторов со специфическими участками фермента. Работа такой сложнейшей структуры, как мышца, основана на белок-белковых взаимодействиях. Действие генов управляется белками, которые взаимодействуют с определенными участками ДНК. Точно так же в основе гормонального контроля лежит избирательное взаимодействие гормонов с белковыми рецепторами. Распознавание молекул белками происходит при трансмембранном транспорте, в том числе и при генерации нервных импульсов. Белок-белковые взаимодействия обеспечивают иммунитет путем образования комплексов антиген-антитело. И таким избирательным взаимодействиям нет конца.
Данная глава посвящена химическому строению белков - гигантских молекул, которые выполняют широкий спектр функций.
Первичная структура белков
Белки представляют собой полипептидные цепи. Их молекулы могут состоять из нескольких цепей, но пока ограничимся одноцепочечными белками. Полипептидная цепь состоит из большого числа соединенных между собой аминокислот. Природа использует в белках 20 аминокислот; если обозначить их буквами, то полипептидную цепь можно представить, как слово из сотен таких букв. Самая длинная из известных полипептидных цепей содержит около 5000 аминокислот, однако большинство белковых цепей имеет менее 2000 аминокислотных звеньев. В принципе аминокислотный «алфавит» допускает существование практически бесконечного множества различных белков - «слов».
Это означает, что эволюционный отбор не ограничен числом белковых структур. Вероятно, именно поэтому белки были избраны носителями столь большого числа биологических функций. Будь число возможных цепей ограниченным, из них нельзя было бы отобрать в ходе эволюции оптимальные, поскольку шанс добиться нужного результата при случайной сборке цепи крайне мал.
Ниже показана структура α-аминокислоты, которая в нейтральных водных растворах находится в виде цвиттер-иона.
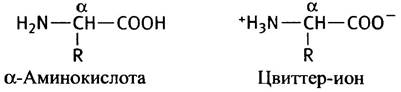
Каждая из аминокислот, за исключением пролина, содержит общий фрагмент Н2N-СН-СООН, так что различаются они только боковой группой R, прикрепленной к α-углеродному атому. Все аминокислоты в белках имеют L-конфигурацию (кроме глицина, в молекуле которого нет асимметрического атома).
Две аминокислоты можно соединить вместе, если отщепить от них молекулу воды (в клетке это достигается не столь простым способом). При этом образуется дипептид, его строение показано ниже (для простоты - в неионизированном состоянии). Связь-СО-NН-называют пептидной связью.
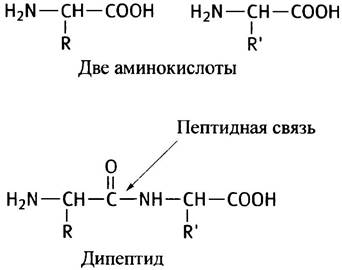
В дипептиде есть концевые амино- и карбоксильная группы; поэтому к нему можно присоединять всё новые аминокислоты, переходя таким образом к полипептиду.
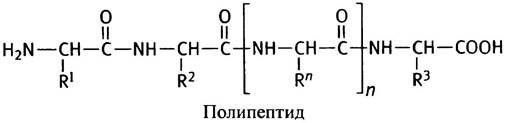
Хотя четкого разграничения не существует, короткие цепи принято называть пептидами, или олигопептидами (олиго- значит несколько), а под полипептидом понимают обычно цепь из восьмидесяти и более аминокислот. Белки могут состоять из нескольких полипептидов, которые в этом случае называют субъединицами. Субъединицы могут быть связаны в мультимерном белке как исключительно слабыми связями, так и посредством прочных ковалентных непептидных связей.
Немного терминологии. Участок цепи, на котором находится концевая NН3+-группа, называют N-концевым, а противоположный ему - С-концевым. Собственно, цепь без аминокислотных радикалов именуют полипептидным скелетом.
![]()
Аминокислоту, включенную в белок, именуют аминокислотным остатком, а аминокислотные радикалы R - боковыми цепями аминокислот, боковыми цепями белка или просто боковыми цепями.
Порядок расположения аминокислот в полипептиде называют аминокислотной последовательностью. Процедуру установления этой последовательности называют секвенированием. Секвенирование играет очень важную роль в химии белка. Аминокислотная последовательность составляет первичную структуру белка. Сэнгер в Кембридже первым определил аминокислотную последовательность белка (инсулина) и был за это удостоен в 1958 г. Нобелевской премии. Впоследствии Эдману, используя чисто химический подход, удалось автоматизировать эту работу. Современным автоматам для этого требуется всего 0,001 мкг белка. Кроме того, есть приборы - аминокислотные анализаторы для определения аминокислотного состава белка. Последний при этом предварительно подвергают полному кислотному гидролизу.
Что такое нативный белок?
Изображение на бумаге первичной структуры белка создает впечатление, что его молекула имеет вытянутую, нитевидную структуру. Это заблуждение, что можно доказать на примере яичного альбумина - бесцветного водорастворимого белка из куриного яйца. Его можно очистить и получить в виде острых кристаллов. Способность к кристаллизации определяется компактной трехмерной структурой молекул. Для процесса кристаллизации необходимо, чтобы все молекулы имели одинаковую форму. Полипептидная цепь в глобулярных белках в естественном состоянии свернута в компактную сферическую структуру - глобулу; в отличие от фибриллярных белков, длинные цепи которых вытянуты вдоль одной оси, они имеют небольшое осевое отношение. Нет четкого определения, что такое глобулярные белки, но очевидно, что их трехмерная структура - плотная укладка полипептидной цепи — обычно нарушается при нагревании. Белок с исходной, природной укладкой цепи называют нативным, белок с развернутой, беспорядочной укладкой цепи - денатурированным, а превращение нативного белка в денатурированный — денатурацией.
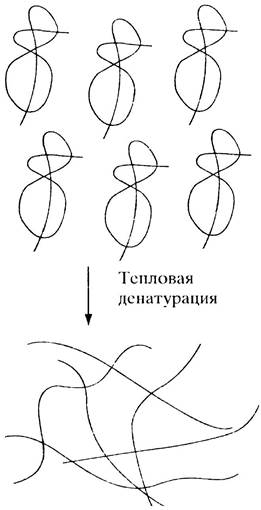
Когда яйцо варят, прозрачный яичный белок сначала мутнеет, а затем превращается в нерастворимую белую массу. Что это такое? Отдельные, определенным образом сложенные белковые цепи при нагревании раскручиваются и беспорядочно, и необратимо переплетаются между собой (рис. 2.1). Это явление свидетельствует о том, что укладка цепи в нативном белке осуществляется в значительной мере благодаря слабым нековалентным связям, поскольку ковалентные связи не разорвались бы при умеренном нагревании. Сама же полипептидная цепь в этих условиях остается интактной. Тепловая денатурация — общее свойство белков.
Рис. 2.1. Денатурация яичного альбумина (гипотетическая схема)
Биологическая активность белков, например, ферментов, почти всегда нарушается при нагревании (хотя известны немногие термостабильные белки). По этой причине нагревание смертельно для клетки.
Теперь, получив представление о первичной структуре белков, мы можем перейти к обсуждению трехмерной укладки полипептидных цепей.
Каковы основные факторы, определяющие трехмерную структуру белка?
Как уже отмечалось, большинство белков свернуто в глобулы. Такие глобулы устойчивы в водных системах благодаря тому, что их полярные группы находятся на поверхности в контакте с водой, а неполярные обращены вглубь молекулы таким образом, что их соприкосновение с водой сведено к минимуму. Если какие- либо группы в глубине глобулы потенциально могут образовать ионные и водородные связи, но реально лишены партнеров, - это дестабилизирует упаковку. Таким образом, ионизованная группа, которая находится в гидрофобном окружении, будет дестабилизировать молекулу белка.
На первый взгляд, проблемы образования функционально-активного глобулярного белка могут показаться неразрешимыми. Ведь сотни аминокислотных остатков должны быть уложены в плотно упакованную глобулярную структуру с полярными группами на поверхности и гидрофобными внутри. Более того, в случае ферментов снаружи должны еще располагаться карманы, идеально соответствующие по форме молекулам субстратов, а также аллостерическим регуляторам активности белков (см. главу 12).
Теперь вы понимаете, почему так медленно - в масштабе миллионов лет - действует эволюция, главной задачей которой, если вдуматься, как раз и является конструирование новых белков. Бесконечно мал шанс случайно набрести на такую аминокислотную последовательность, которая не только удовлетворила бы условиям устойчивой упаковки цепи, но и обеспечила выполнение функциональных задач. Поэтому не следует удивляться, встретив белки с различной функцией, но сходные по структуре настолько, что может навести на мысль об их происхождении от общего предка или друг от друга. Похоже, что эволюция, столкнувшись с необходимостью решить определенную задачу, предпочитает не конструировать для этого белки de novo, а приспособить уже хорошо отлаженные структуры, адаптируя их для новых целей.
Прежде чем перейти к укладке цепей в белках, нам следует побольше узнать о строении тех 20 аминокислот, которые являются их строительными блоками.
Структура 20 белковых аминокислот
Изучение структуры 20 различных аминокислот будет более познавательным, если помнить, для чего предназначены их боковые группы. Именно различия в форме, размерах и полярности позволяют аминокислотам служить теми строительными блоками, которые использует эволюция, чтобы удовлетворить многочисленные и жесткие требования к структуре белков. Нетрудно представить, как это происходит: вот здесь нужна маленькая гидрофобная группа, чтобы заполнить полость возле соседней группы, тут нужна сильная полярная группа, а там более слабая. Когда в игре участвуют 20 разных игроков, у великого тренера - эволюции - есть возможность гибкого конструирования.
В разных организмах было обнаружено множество аминокислот, не входящих в состав белков (так называемые небелковые аминокислоты), однако все известные организмы для строительства своих белков используют одни и те же 20 аминокислот. Ф. Крик назвал их «магической двадцаткой». Только они шифруются генетическим кодом. (Если это вам ни о чем не говорит, подождите до следующих глав.) Начнем с алифатических гидрофобных цепей, представленных в порядке увеличения их размера.
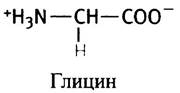
В глицине роль боковой группы играет атом водорода. Это самая маленькая аминокислота; ее остаток в белке не имеет ярко выраженных гидрофобных или гидрофильных свойств. Далее следуют алифатические неполярные боковые цепи по мере увеличения их гидрофобности, причем последние три цепи являются разветвленными.
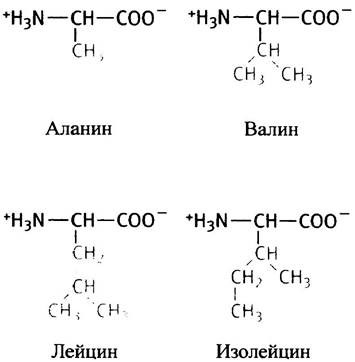
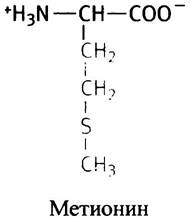
Особняком среди гидрофобных алифатических аминокислот стоит метионин. Не потому, что в его боковую цепь входит атом серы, а из-за того, что его концевая метальная группа играет важную роль в метаболизме.
Далее мы переходим к действительно крупным боковым цепям ароматических аминокислот:
Заметим, что гидроксильная группа в тирозине может участвовать в образовании водородных связей, поэтому тирозин нельзя однозначно классифицировать как гидрофобную аминокислоту.
Гидрофильные аминокислоты
Все ионизированные группы гидрофильны, а потому к гидрофильным аминокислотам, безусловно, относятся и те, которые содержат в боковой цепи карбоксильную или аминогруппы. Обе эти группы при физиологических значениях pH ионизированы. Аспарагиновая и глутаминовая кислоты - кислые аминокислоты, лизин и аргинин - сильно основные, а гистидин - слабо основная аминокислота. Кольцевую структуру в молекуле гистидина называют имидазольным кольцом.
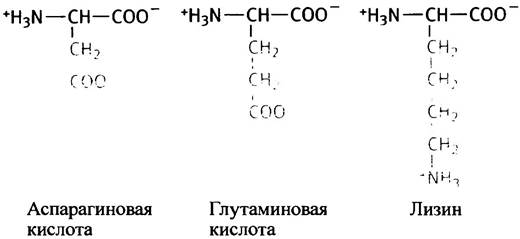
Обе кислые аминокислоты - аспарагиновая и глутаминовая - в белках представлены и своими амидами - аспарагином и глутамином.
К гидрофильным относятся также гидроксилсодержащие аминокислоты: серин и треонин.
Аминокислоты, используемые для особых целей
Цистеин похож на серин, но содержит тиольную группу -SН вместо гидроксильной -ОН. Его специфическая роль в белках двояка: благодаря цистеину в активные центры белков могут быть введены тиольные группы; кроме того, два остатка цистеина в белках могут быть соединены ковалентной связью -S-S-.
Пролин примечателен тем, что его остаток вызывает излом пептидной цепи. В отличие от других аминокислот, свободный пролин содержит не амино-, а иминогруппу.
Ионизация аминокислот
Как уже упоминалось, свободные аминокислоты в водных растворах находятся в виде цвиттер-ионов, в которых α-амино- и α-карбоксильные группы ионизированы, поскольку у первых рКа 8-10, а у вторых рКа 2.
В пептидной цепи все эти диссоциирующие группы блокированы (кроме концевых), поскольку участвуют в образовании пептидных связей. Поэтому ионный статус белков практически полностью определяется диссоциацией групп в боковых цепях аспарагиновой и глутаминовой кислот, лизина, аргинина и гистидина.
Ниже показаны заряженные аминокислотные остатки в составе пептидной цепи:
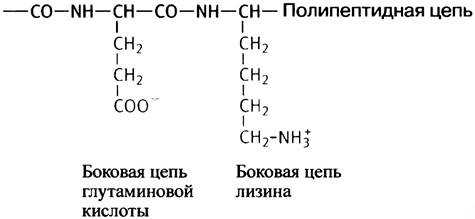
Карбоксильные группы в боковых цепях аспарагиновой и глутаминовой кислот имеют рКа ~4 и при pH 7,4 практически полностью диссоциированы; при этом их боковые группы заряжены отрицательно. Аминогруппы в боковых цепях основных аминокислот лизина (рКа 10,5) и аргинина (рКа 12,5) при физиологических значениях pH также полностью ионизированы (NН3+). Третья основная аминокислота - гистидин с имидазольным кольцом в качестве боковой группы имеет рКа 6,04, достаточно близкое к физиологическим значениям pH. Благодаря этому имидазол часто входит в активный центр ферментов, которые катализируют реакции, связанные с переносом ионов водорода. В ходе этих реакций имидазольный остаток - в зависимости от своего ионного состояния - может выступать как донор или акцептор протона.
Распределение заряженных остатков аминокислот в полипептидной цепи сильно влияет на ее конформацию, ибо близкорасположенные одноименные заряды, как известно, отталкиваются, а разноименные - притягиваются. Для регуляции ферментативной активности в клетке часто используется фосфорилирование, в ходе которого в молекулу белка вводится сильный отрицательный заряд, вызывающий изменение ее конформации.
Уровни структурной организации белка: от первичной структуры к четвертичной
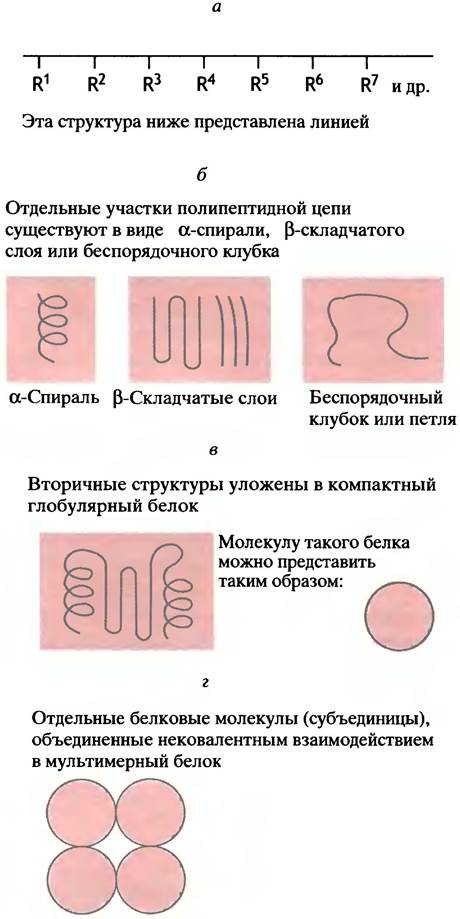
Последовательность аминокислот, ковалентно связанных в полипептидную цепь, как вы уже знаете, называется первичной структурой белка (рис. 2.2, а). Сама по себе первичная структура ничего не говорит о том, как полипептидная цепь уложена в трехмерном пространстве.
Полипептидная цепь принимает специфическую конформацию, известную как вторичная структура белка (см. рис. 2.2, б), которая, в свою очередь, укладывается в компактное образование, именуемое третичной структурой (см. рис. 2.2, в). Такое образование, сформированное первичной, вторичной и третичной структурами, может представлять собой либо самостоятельный белок, либо же в качестве мономера (субъединицы) ассоциироваться с такими же или другими мономерами, образуя сложный мультимерный белок. Под четвертичной структурой понимают расположение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка (см. рис. 2.2, г).
Рис. 2.2. Схематическое изображение первичной(а), вторичной (б), третичной(в) и четвертичной (г) структуры белков
Приняв эту терминологию, мы далее более подробно рассмотрим различные уровни организации белковой структуры.
Вторичная структура белков
Здесь речь пойдет об организации не столько боковых цепей, сколько собственно полипептидного скелета. Мы уже говорили о том, что в водорастворимых глобулярных белках полярные боковые группы должны быть по возможности расположены снаружи глобулы, а гидрофобные - внутри нее. Но как быть с полипептидным скелетом? Как его ни скручивай в компактную форму, все равно часть скелета окажется погруженной в центральную, т. е. гидрофобную область. Проблема здесь в том, что этот скелет, т. е. собственно пептидная цепь, содержит множество С=O- и N-Н- групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. До тех пор, пока это потенциальное связывание не произойдет (с выделением свободной энергии), структура будет неустойчивой. Кто же может послужить партнерами этим многочисленным группам? Ответ простой: аналогичные группы из той же или соседней полипептидной цепи.
Еще раз подчеркнем, что речь пока не идет об упаковке боковых аминокислотных групп, которая приобретает значение главным образом на уровне третичной структуры. Пока мы ограничиваемся обсуждением проблемы, как удовлетворить потребность С=O- и N-Н- групп полипептидной цепи в партнерах для образования водородных связей. Существуют два главных типа структур, позволяющих это осуществить: α-спираль, в которую цепь свертывается, как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны; они встречаются
на периферии белковых глобул (где расположены гидрофильные боковые группы аминокислот) и в их внутренней области (где расположены гидрофобные боковые группы).
α-Спираль
Термин α-спираль был введен Л. Полингом, открывшим укладку пептидной цепи в виде правосторонней спирали в белке α-кератине. Для L-аминокислот правосторонняя спираль устойчивей левосторонней. Вы можете составить представление о правосторонней спирали, вообразив траекторию точки на краю головки завертываемого шурупа; форма такой спирали приведена на рис. 2.3, а.
Рис. 2.3. Схематическое изображение укладки полипептидной цепи в виде α-спирали
а - Примерное расположение водородных связей (штриховые линии) между С=O- и N-Н-группами (боковые группы не показаны); б - вид с торца α-спирали. Проекции боковых групп R ориентированы произвольно, а сами они размещены вдоль цепи на равных расстояниях друг от друга (3,6 остатка на виток, или через 100° на проекции 360°/100° - 3,6)
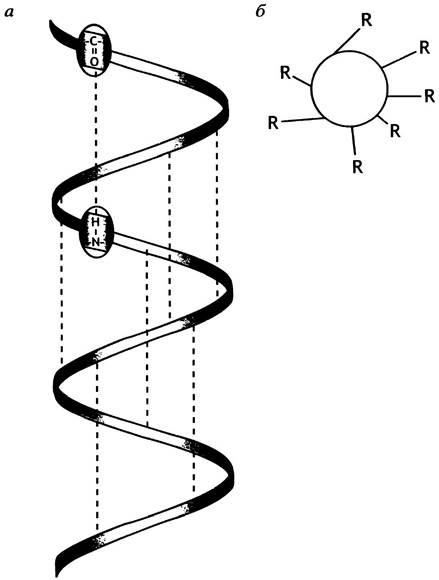
Естественно предположить, что в подобной спирали на один виток приходится целое число аминокислотных остатков. От этой заманчивой идеи пришлось, однако, отказаться, когда Полинг показал, что в действительности на один виток α-спирали приходится 3,6 аминокислотных остатков. Это означает, что группа С=O- одной пептидной связи образует водородную связь с группой N-H другой пептидной связи, отстоящей от первой на- четыре аминокислотных остатка. И С=O-, и N-H- связи направлены параллельно оси спирали и попарно противостоят друг другу; такое расположение оптимально для образования водородной связи и, следовательно, для стабилизации α-спирали. В поперечном сечении α-спираль выглядит диском, от которого наружу смотрят боковые цепи аминокислот (рис. 2.3, б). Ван-дер-ваальсовы радиусы атомов таковы, что внутри спирали нет пустого пространства; это способствует устойчивости α-спирали. Не вся полипептидная цепь в глобулярном белке спирализована. В среднем отдельные спиральные участки включают 10 аминокислотных остатков, но в разных белках длина спиралей может сильно отличаться от этой величины.
Аминокислоты различаются по частоте встречаемости спиральных участков. Особую роль здесь играет пролин, остаток которого служит своего рода терминатором для α-спиралей. Во всех других случаях полипептидная цепь может свободно вращаться вокруг двух простых связей на каждый аминокислотный остаток. Заметим, что свободное вращение относительно самой пептидной связи СО-NH не происходит, так как благодаря электронному сопряжению она по своим свойствам близка к двойной, представляя собой гибрид двух структур: а) где связь между атомами углерода и кислорода двойная; б) где эта связь одинарная.
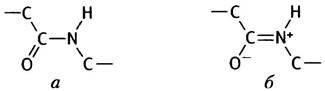
Пептидная группа с участием N-атома пролина не содержит водорода, необходимого для образования водородной связи, а главное, в этом месте поворотная изомерия ограничена, и пептидная цепь не может принять конформацию, соответствующую α-спирали.
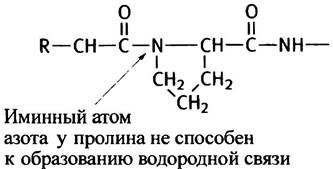
Прежде чем обсудить, какую роль α-спирали играют в структуре белков, следует познакомиться с альтернативным типом упорядочения полипептидных цепей -
β-складчатым слоем. Обычно структура белка представляет собой комбинацию обоих типов укладки, которые занимают разные участки полипептидной цепи.
β-Складчатый слой
Это тоже стабильная структура, в которой полярные группы полипептидной связи попарно соединены водородными связями, что придает ей стабильность даже в гидрофобной центральной части белковой глобулы.
Принцип организации здесь предельно прост. Полипептидная цепь находится в растянутом состоянии (или β-форме - по названию белка β-кератина, в котором она впервые была обнаружена), а ее С=O- и N-H- группы связаны водородными связями с такими же группами соседней, параллельно ориентированной полипептидной цепи (рис. 2.4). Обе цепи могут быть независимыми или представлять фрагменты одной, общей для них цепи.
Рис. 2.4. Структура β-складчатого слоя
а - Водородные связи между однонаправленными полипептидными цепями в параллельном β-складчатом слое. Боковые группы R, прикрепленные к остаткам -СН-, расположены выше и ниже плоскости бумаги; б - водородные связи между противоположно направленными полипептидными цепями в антипараллельном β-складчатом слое. Такой слой может образоваться в пределах одной полипептидной цепи, уложенной в складки
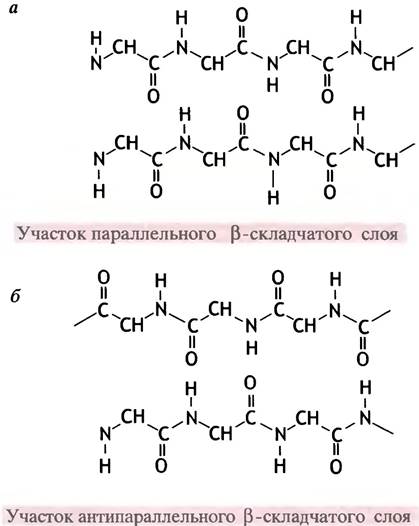
Когда такую структуру образуют несколько параллельных цепей, термин слой (англ. sheet) становится вполне оправданным. Складчатым же (англ. pleated)
его называют потому, что α-углеродные атомы аминокислотных остатков расположены попеременно по обе стороны центральной плоскости слоя. Образующие складчатый слой полипептидные цепи могут быть направлены в одном и том же или в противоположном направлениях, в первом случае складчатый слой называют параллельным, а во втором - антипараллельным. Антипараллельная β-структура обычно возникает, когда пептидная цепь поворачивает вспять, образуя так называемую шпильку. Место поворота называют β-изгибом (англ. β-turn).
Беспорядочный клубок, или петли полипептидной цепи
Беспорядочный клубок на самом деле вовсе не беспорядочный и не клубок. Так стали называть участки полипептидной цепи, которые по конформации нельзя отнести ни к α-спирали, ни к β-складчатому слою. Более правильный термин — соединительные петли. Их структура в основном определяется взаимодействиями боковых цепей входящих в них аминокислотных остатков; в молекулах любого конкретного белка она фиксирована, а не беспорядочна, как можно ожидать из названия. Да и слово «клубок» здесь не слишком уместно, поскольку речь идет не о произвольной конформации. В соединительных петлях не все пептидные С=O- и N-Н- группы могут участвовать в образовании водородных связей, поэтому участки полипептидной цепи чаще находятся на поверхности белковой глобулы, в области ее контакта с водой.
Третичная структура белков
Итак, эволюция располагает 20 аминокислотами для конструирования белков. Последовательность аминокислотных звеньев в полипептидной цепи характерна и постоянна для каждого белка, определяя его первичную структуру. Полипептидная цепь может свертываться в виде α-спирали или β-складчатого слоя, либо находится в менее упорядоченных петлях, причем только в α-спирали и β-структуре пептидные связи участвуют в образовании водородных связей. Все эти три типа укладки распределены вдоль полипептидной цепи, занимая отдельные ее участки и составляя вторичную структуру белка. Дальнейшая укладка вторичных структур в компактную структуру глобулярного белка носит название третичной структуры.
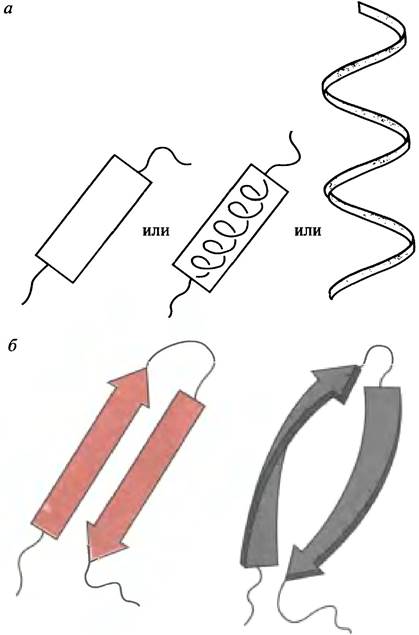
Чтобы упростить изображения белковых молекул, используют условные обозначения вторичных структур. Так, α-спираль изображают в виде цилиндра (иногда
с вписанной в него спиралью) или в виде свернутой в спираль ленты (рис. 2.5, а), а участки цепи, входящие в β-складчатые слои, - в виде стрел, указывающих направления хода пептидных цепей (рис. 2.5, б). Иногда их изображают несколько скрученными, чтобы отразить таким образом реальное слабое правостороннее скручивание цепи в β-структуре. В обоих случаях условное обозначение относится к некоторому фиксированному участку полипептидной цепи. В категорию петель попадают участки цепи, которые разделяют спирали и складчатые слои: их обозначают простой линией.
Рис. 2.5. Символы, применяемые для изображения участков а-спирали (а) и β-складчатых листков (б). Справа показано их правостороннее искривление, характерное для антипараллельных слоев. Промежуточные петли и неупорядоченные участки цепи изображаются простой линией
Как строятся белки из α-спиралей, β-складчатых слоев и соединительных петель?
В принципе для построения белков может быть использована любая комбинация спиралей, складчатых слоев и петель, однако при этом не должно возникать затруднений, связанных с упаковкой боковых цепей аминокислот и обусловленных их притяжением или отталкиванием. Кроме того, на упаковку белковой молекулы может влиять расположение на ее поверхности боковых полярных групп аминокислотных остатков, образующих соединительную петлю. В целом должны выполняться следующие требования: усилено образование водородных связей и сведены к минимуму контакты гидрофобных групп с полярными группами и водой. Этим требованиям, однако, могут удовлетворить лишь немногие аминокислотные последовательности из бесчисленного множества возможных.
Трехмерное строение довольно большого числа белков было установлено на основании данных о дифракции рентгеновских лучей. При этом выяснилось, что некоторые структурные мотивы предпочтительнее, поэтому число основных конструкций белков может быть ограниченным.
Трехмерные белковые структуры вряд ли интересны для биохимика, ими не занимающегося, однако их знание часто бывает необходимо, например, при обсуждении бихимических механизмов какого-нибудь процесса. Некоторые из этих структур представлены на рис. 2.6.
Рис. 2.6. Строение различных белков: а - Миоглобин, в центре которого расположен гем, выделенный красным цветом; б - стафиллококковая нуклеаза; в — триозофосфат-изомераза (под ней показано расположение в цепи α-спиралей и β-складчатых слоев); г - пируваткиназа
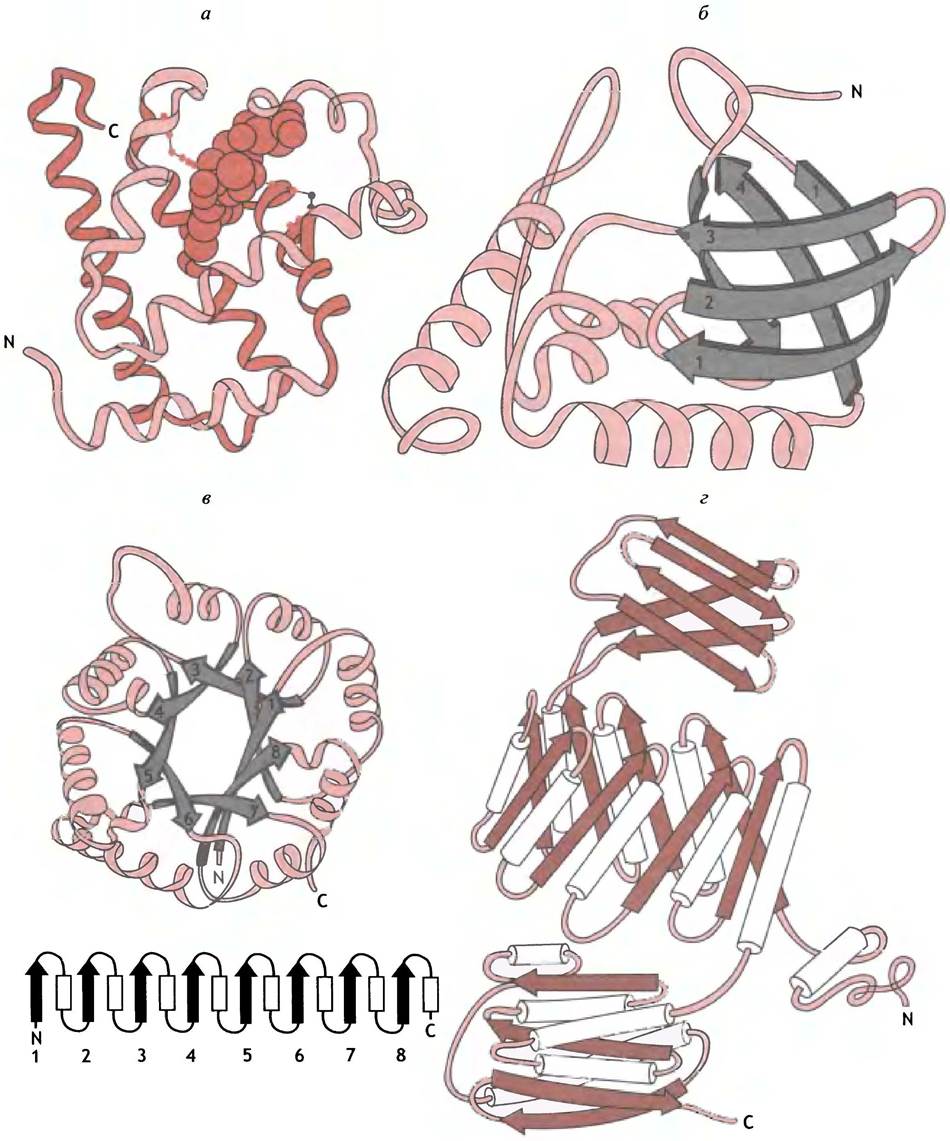
Миоглобин (см. рис. 2.6, а) содержит только α-спирали, соединенные петлями, и гем, погруженный в глубокую щель. В молекуле стафилококковой нуклеазы - фермента, гидролизующего нуклеиновые кислоты (см. рис. 2.6, б), видна комбинация антипараллельных β-складчатых слоев (1- 4) и трех α-спиралей. Еще один структурный мотив -так называемая α/β-бочка, центральная часть которой образована β-участками (1-4), расположенными наподобие клепок в деревянной бочке (за исключением того, что они наклонены), а периферия заполнена α-спиралями. Этот мотив иллюстрирует структура триозофосфатизомеразы (см. рис. 2.6, в). Еще один мотив упаковки, образованный чередующимися спиралями и участками β-структуры, прослеживается в структуре пируваткиназы (см. рис. 2.6, г).
Какие силы поддерживают третичную структуру?
Мы уже говорили о том, что элементы вторичной структуры - α-спирали и β-складчатые слои - стабилизируются водородными связями. Теперь обсудим, что же скрепляет эти элементы в единую третичную структуру. Разумеется, определенный вклад вносят ионные и водородные связи между боковыми цепями аминокислотных остатков, однако главную роль играют гидрофобные силы, которые определяют локализацию гидрофобных цепей в центральной части молекулы, уменьшая, таким образом, площадь их контакта с водой и увеличивая ван-дер-ваальсово взаимодействие. В большинстве глобулярных белков одних слабых взаимодействий достаточно для поддержания третичной структуры.
Какое отношение к третичной структуре имеют ковалентные S-S- связи?
Ранее упоминалось об особых функциях остатков цистеина. Одна из них состоит в том, что тиольные группы этих остатков участвуют в образовании активных центров ферментов, например, гликолитического фермента - глицеральдегид-3-фосфатдегидрогеназы (см. с. 112). Однако у цистеина есть и другая функция. Третичная структура белков своим существованием обязана в основном слабым взаимодействиям между боковыми цепями. Этого достаточно для защиты белков от повреждающих воздействий внутри клетки, однако внеклеточным белкам - инсулину в крови, пищеварительным ферментам и т. п. - нужна дополнительная защита от более жесткого внеклеточного окружения. И это достигается попарным связыванием пространственно сближенных остатков цистеина с образованием ковалентных дисульфидных связей, которые действуют подобно стальным скобам, скрепляющим бревенчатые конструкции. Даже небольшого числа таких связей достаточно для того, чтобы весьма эффективно стабилизировать белковую структуру; например, в инсулине их всего три. Дисульфидные связи, или S-S-мостики, как их иначе называют, не разрушаются при умеренном нагревании, а содержащие их белки часто отличаются большей термоустойчивостью.
Простой опыт помогает понять, как образуются дисульфидные связи. Если оставить на воздухе нейтральный раствор цистеина, то через несколько часов поверхность жидкости покроется слоем белых нерастворимых кристаллов. Протекающую при этом химическую реакцию можно представить в виде уравнения:
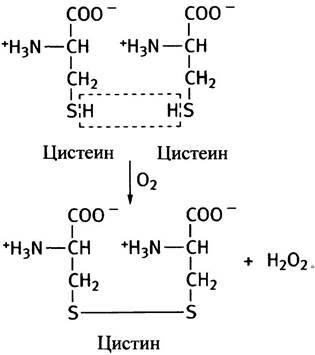
Точно так же происходит образование дисульфидных связей между остатками цистеина в белках.
Предельно наглядно стабилизирующая роль S-S-мостиков прослеживается на примере кератина - основного белка волос. Пучки кератиновых полипептидов прошиты множеством S-S-мостиков, придающих волосу жесткость. При так называемом химическом перманенте S-S-связи разрушают восстановителем, придают волосам иную конфигурацию, а затем вновь замыкают S-S-связи, используя подходящий окислитель. Количество S-S-связей после этих процедур может остаться таким же, как прежде, однако теперь они образуются между теми остатками цистеина, которые оказались сближенными при механическом изменении конфигурации волоса.
Четвертичная структура белков
Третичная структура завершает описание строения молекулы белка. Есть, однако, довольно много белков, молекулы которых представляют собой комплексы, образованные из нескольких белковых молекул, соединенных нековалентными связями. Такие комплексы называют олигомерными, мультимерными или субъединичными белками. Их состав и стехиометрия постоянны. Это доказывает, что объединяющиеся белковые субъединицы «узнают» друг друга благодаря присутствию на их поверхности комплементарных по форме участков. К числу таких олигомерных белков относится, например, гемоглобин (см. главу 27) или аллостерически регулируемые ферменты (см. с. 158). Укладку субъединиц в функционально активном белковом комплексе называют четвертичной структурой белка (см. рис. 2.2, г).
Мембранные белки
До сих пор речь шла о глобулярных белках, у которых структура глобулы обеспечивает водорастворимость молекулы в целом. Многие же белки, пронизывающие биологические мембраны, устроены иначе: они состоят из двух экспонированных на поверхности мембраны «водорастворимых» частей, которые соединены спиральным тяжем, расположенным внутри мембраны (см. с. 61). Недостаток такой конструкции очевиден: контакты полярных групп белка с внутренним углеводородным слоем мембраны делают молекулу нестабильной.
Белковые конъюгаты
Очень многие белки - не сложнее вышеописанных. Для нормального функционирования им достаточно правильно уложенной полипептидной цепи и, в крайнем случае, таких кофакторов, как ионы металлов или нековалентно связанные коферменты. Однако некоторые дополнительные компоненты могут быть присоединены к белкам ковалентно. Их называют простетическими группами, их активный комплекс - холоферментом, а его белковую часть - апоферментом. Примерами таких структур могут служить цитохромы, содержащие в качестве простетической группы гем, либо дегидрогеназы, содержащие флавинадениндинуклеотид (FAD).
Белки, ковалентно связанные с углеводными компонентами, относят к гликопротеинам. К ним, в частности, принадлежат многие белки плазматических мембран, к молекулам которых с внешней стороны прикреплены олигосахариды (см. с. 61). Их остатки замешают атом водорода в гидроксильной группе серина или треонина (О-гликозиды), а также амидный протон в боковой цепи аспарагина (N-гликозиды). Строение таких N-гликозидов схематически показано ниже:
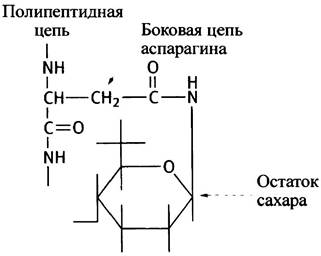
Гликопротеинами являются секреторные белки, многие белки крови. Назначение углеводных компонентов в гликопротеинах не всегда понятно. Иногда они, по-видимому, обеспечивают стабильность белка, в других случаях - его долговечность. Так, разрушение углеводных компонентов белков сыворотки крови или эритроцитарных мембран служит сигналом для клеток печени к поглощению и уничтожению соответствующих белков. Напротив, гликозилирование белков защищает их от действия протеиназ. В некоторых случаях углеводные компоненты используются для распознавания, поскольку разнообразные комбинации моносахаридов в углеводных цепях позволяют создавать уникальные «метки». Такие «метки» используются, например, аппаратом Гольджи при сортировке белков (см. главу 22).
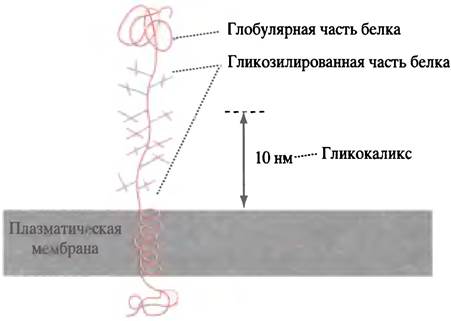
В случае гликопротеинов муцина (слизи), защищающих ткани от повреждения, О-гликозиды способствуют формированию растянутой конформации полипептидной цепи, которая необходима для поддержания сеточной структуры муцинов даже в очень разбавленных растворах. Поддержание белковой цепи в растянутом виде, по-видимому, является функцией О-гликозидов и в других случаях. У рецепторов липопротеинов низкой плотности в молекулах можно различить область, ответственную за связь с мембраной, и собственно рецепторный домен, вынесенный за ее пределы. Обе эти части рецептора соединены длинным пептидным тяжем, покрытым множеством О-гликозидных остатков (рис. 2.7). Существует обширное семейство протеогликанов, в которых углеводные компоненты богаты аминосахарами, сульфосахарами и карбоксильными производными сахаров. Считается, что эти вещества выполняют важную роль в формировании межклеточного матрикса, однако эта проблема лежит вне рамок данной книги.
Рис. 2.7. Строение белка-рецептора липопротеинов низкой плотности (ЛПНП). Гликозилированный участок полипептидной цепи представляет собой тяж, поддерживающий функционально активную белковую глобулу на расстоянии более 10 нм от поверхности плазматической мембраны
Белковые модули, или домены
У белков, образованных одной полипептидной цепью, нативная структура обычно представляет собой компактное образование, каждая часть которого не может существовать сама по себе, сохраняя структуру, присущую ей в исходной глобуле. Но так бывает далеко не всегда, особенно если белок содержит более 200 аминокислотных остатков. В трехмерной структуре больших белков иногда обнаруживается не одна, а несколько в той или иной степени независимо образованных компактных областей, соединенных малоструктурированными полипептидными участками. Такое впечатление, что эти компактные области, если бы их удалось выделить по отдельности в нативном виде, сохранили бы свою упаковку неизменной. Действительно, в некоторых случаях так и получалось. На основании этого было введено понятие белковых модулей, или доменов, под которыми понимают фрагменты полипептидной цепи, сходные по своим свойствам с самостоятельными глобулярными белками. Считается, что домену всегда должен соответствовать непрерывный отрезок полипептида, поэтому исключается ситуация, когда цепь выходит из компактного домена, а потом, как-то извернувшись, возвращается в него обратно. Домен должен быть автономен. Здесь уместна аналогия с отдельными частями симфонии: они являются законченными произведениями и могут исполняться по отдельности, но, тем не менее, подчинены общему замыслу, и только в его рамках проясняется их истинное значение и взаимосвязь. Что реально представляют собой домены, видно на рис. 2.6, г, где представлена структура фермента пируваткиназы, в которой легко обнаруживаются три компактные области.
Чем интересны домены?
Доменная структура часто ассоциируется с возможностью представить функциональную активность белка как совокупность отдельных элементарных процессов. Пожалуй, наиболее ярким примером здесь может служить фермент млекопитающих - синтаза жирных кислот, единственная полипептидная цепь которой содержит все необходимое для катализа семи реакций. Поскольку у бактерий каждая из этих реакций катализируется отдельным ферментом, то вполне возможно, что домены синтазы некогда объединились в один белок в результате слияния генов. Многие ферменты, выполняющие сходные функции, связывают по меньшей мере два субстрата. Типичным примером служат никотинамидаденинди- нуклеотиддегидрогеназы, или (NAD+) -дегидрогеназы, катализирующие реакцию:
АН2 + NAD+ <-> А + NADH + Н+
Все они связывают NAD+, но окисляемые субстраты для них различны.
Оказалось, что в молекулах дегидрогеназ есть два домена, один из них связывает NAD+ и сходен по строению у всех ферментов этого семейства, тогда как другой связывает окисляемые субстраты АН2 и отличается по структуре у разных дегидрогеназ. Эти данные можно истолковать двояко. Можно предположить, что существует уникальная белковая структура, способная эффективно связывать NAD+, и в ходе эволюции каждый раз отыскивается единственно верное решение (это называют конвергентной эволюцией). Альтернативная гипотеза состоит в том, что однажды найденную удачную конструкцию NАD+-связывающего модуля эволюция использует вновь и вновь, занимаясь чем-то вроде тасования готовых модулей.
Идея модульной конструкции ферментов и других белков допускает частое появление и быструю эволюцию новых функциональных белков. Это чем-то напоминает сборку электронного устройства путем перебора готовых универсальных микросхем разного назначения, вставляемых в общую материнскую плату. Поскольку речь идет о микросхемах, а не о триодах или сопротивлениях, вполне возможно получить разумно действующую схему. Точно так же самые разные функции могут возникнуть у новых белков, которые образуются в результате ассоциации разных доменов из уже существующих молекул.
Все это может показаться чистой фантазией, основанной на сходстве между родственными по функции белками, тем более что существует иное толкование конвергентной эволюции. В главе 21 будет рассказано о том, что домены иногда кодируются отдельными фрагментами генов, именуемыми экзонами.
Это создает некую материальную основу для размышлений о «перетасовке» экзонов, а вместе с ними и доменов, как о возможном механизме эволюции белков. Во всяком случае, подобный механизм мог бы действовать куда быстрее, чем случайные точечные мутации.
Белки волос и соединительных тканей
Удивительно, что белки составляют основу таких нерастворимых в воде и прочных материалов, как рога, копыта, шерсть, кожа и сухожилия. К подобным белкам предъявляются различные биологические требования. Волос - это всего лишь длинное, достаточно прочное и нерастворимое волокно. Его основой является структурный белок - α-кератин. Сухожилия, связывающие мышцы с костями, должны быть прочнее стали и лишены эластичности. Эти свойства обеспечивает другой структурный белок - коллаген. Совсем иные механические свойства должны быть у кожи, стенок артерий или у легочных альвеол. Здесь требуется не только прочность, но также эластичность и упругость, т. е. способность обратимо изменять форму под воздействием нагрузки. Неудивительно, что ответственный за эти свойства белок называется эластин.
Далее мы рассмотрим структуру кератина, коллагена и эластина. Общей особенностью этих белков является участие ковалентных непептидных связей в формировании их пространственной структуры. Вспомним, что у обычных белков главный вклад в стабилизацию трехмерной структуры вносят слабые взаимодействия. Однако их явно недостаточно для образования свойственных этим белкам уникальных структур.
α-Кератины волос, шерсти, рогов и копыт
Кератины волос и шерсти образуют так называемые промежуточные филаменты. Они состоят из длинных полипептидных цепей с крупными доменами, образованными α-спиралями и содержащими повторяющиеся последовательности из семи аминокислотных остатков (гептапептиды). Так выглядит центральная часть полипептидной цепи, а домены на ее концах не обладают какой-либо предпочтительной регулярной структурой, и она может различаться у разных кератинов. Две одинаково направленных цепи кератина образуют супер-спираль, в которой остатки неполярных аминокислот защищены от воды, будучи обращенными внутрь. Такая структура дополнительно стабилизируется многочисленными дисульфидными связями, образованными остатками цистеина соседних цепей. Суперспиральные димеры, в свою очередь, объединяются с образованием тетрамеров, подобных четырехжильному канату. Есть данные, свидетельствующие о том, что в промежуточных филаментах тетрамеры могут агрегировать, образуя октамерные структуры.
Структура коллагенов
Коллаген образуется вне клеток из секретируемого ими белка - проколлагена, который превращается в собственно коллаген в результате воздействия соответствующих ферментов. Молекула проколлагена представляет собой тройную суперспираль, образованную тремя скрученными вместе спирализованными полипептидами (рис. 2.8).
Рис. 2.8. Модели фибриллярных белков
а - Укладка фибрилл в коллагеновых волокнах (цветом выделены сшивки между остатками лизина, которые есть и в тройной спирали); б - структура сшивок между близлежащими лизиновыми остатками. Структура разных типов коллагена зависит от выполняемых ими функций
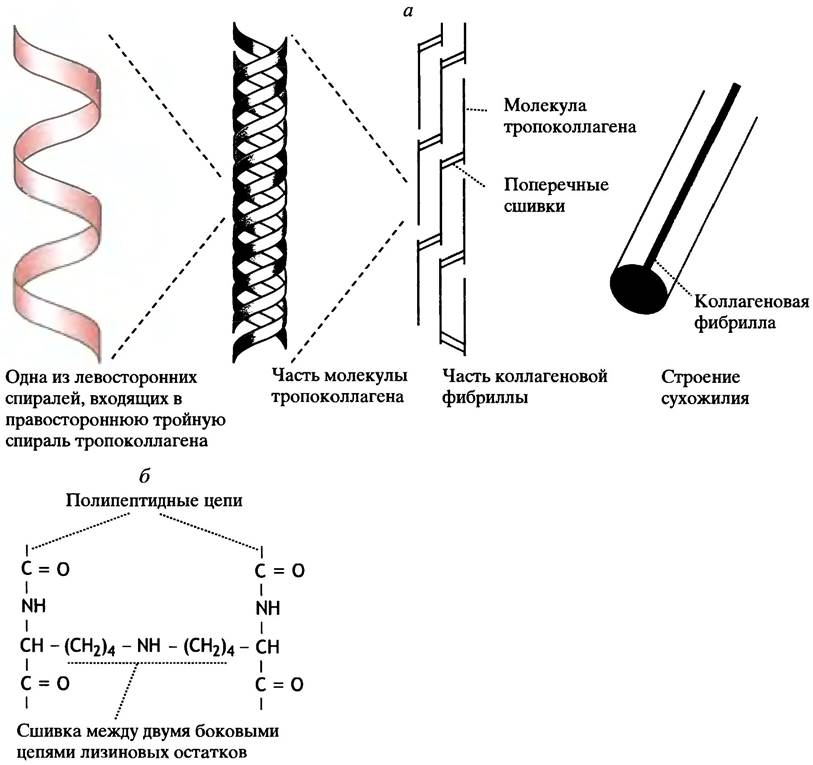
Превращения проколлагена начинаются с отщепления концевых пептидов. После этого белок, называемый теперь уже тропоколлагеном, упаковывается в коллагеновые волокна. Каждый из трех полипептидов в молекуле тропоколлагена находится в виде левосторонней спирали (напомним, что обычная для белков α-спираль - правосторонняя). Примерно треть аминокислотных остатков в тропоколлагене представлена пролином, а каждый третий остаток - глицином.
В ходе образования коллагена многие остатки Пронина и лизина гидроксилируются, превращаясь соответственно в гидроксипролин и гидроксилизин. Заметим, что этих аминокислот нет в «магической двадцатке», и они оказываются включенными в белок не в ходе его матричного синтеза, а в результате химического посттрансляционного превращения входящих в его состав аминокислот. Гидроксилирование пролина требует в качестве кофактора аскорбиновую кислоту (витамин С), которая нужна для поддержания в восстановленном состоянии иона Fе2+ в активном центре фермента пролил-гидроксилазы. Вот почему при недостатке витамина С нарушается образование соединительных тканей, это вызывает заболевание - цингу.

Конструкция коллагеновой суперспирали - прекрасный пример того, как эффективно использует эволюция возможности белковой инженерии. Три спирально навитые друг на друга молекулы тропоколлагена ковалентно связаны между собой, образуя очень прочную структуру. Такая ассоциация невозможна в обычной белковой спирали, поскольку ей препятствовали бы объемные боковые цепи. В коллагене спирали более вытянуты - на один виток приходится три остатка. Поскольку каждый третий из них - глицин, у которого боковой цепи нет, спирали в этих точках максимально приближены друг к другу. Дополнительная стабилизация осуществляется благодаря участию гидроксилированных остатков лизина и пролина в образовании водородных связей.
Молекулы тропоколлагена содержат около 1000 аминокислотных остатков. Они собираются в коллагеновые фибриллы, стыкуясь «голова к хвосту» (см. рис. 2.8, а). Пустоты в этой структуре при необходимости могут служить местом первоначального отложения кристаллов гидроксиапатита Са5(ОН)(РO4)3, играющего важную роль в минерализации костей. Для приобретения необходимых механических свойств, например, в сухожилиях, коллаген подвергается ферментативной модификации. При этом в концевых частях тропоколлагеновых цепей ковалентно сшиваются остатки лизина (см. рис. 2.8, б). Таким образом, сухожилия представляют собой пучки параллельно ориентированных фибрилл зрелого (т. е. прошедшего все этапы посттрансляционной модификации) коллагена. В отличие от сухожилий, в коже коллагеновые фибриллы образуют подобие неупорядоченной двумерной сетки. Известно несколько типов коллагенов, различающихся структурой полипептидных цепей. Эти различия определяются как содержанием гидроксипролина и гидроксилизина, так и степенью их гликозилирования. Генетически обусловленные нарушения созревания коллагена приводят к тяжелым наследственным заболеваниям - коллагенозам.
Структура эластина
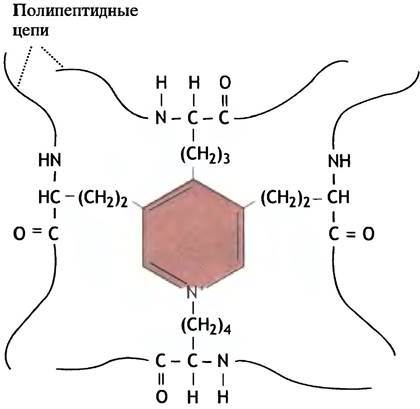
Эластин по своему строению совершенно отличен от коллагена или α-кератина. Он содержит обычные α-спирали, но благодаря некоторым особенностям строения молекулы обладает упругостью большей, чем у резины. Эластин образует поперечно-сшитую сеть, которая своими необычными механическими свойствами обязана уникальному способу ковалентного связывания боковых цепей лизина: четыре сближенных лизиновых остатка формируют так называемую десмозиновую структуру (рис. 2.9), объединяющую в один узел четыре участка пептидных цепей.
Рис. 2.9. Десмозиновая сшивка между четырьмя полипептидными цепями эластина. Такие сшивки возникают в результате ферментативной модификации четырех лизиновых остатков
Тайна укладки белка
Как белки укладываются во вторичную и третичную структуру? Это тема главы 21, однако здесь стоит подчеркнуть, что аминокислотная последовательность лишь определяет, какая трехмерная структура возможна для полипептидной цепи, но отнюдь не диктует, каким образом возникает эта структура. Последнее - одна из величайших нерешенных проблем современной биологии. Известно, что «плохая» последовательность препятствует образованию «хорошей» структуры, но пока неизвестно, как «хорошая» последовательность приводит к образованию «хорошей» структуры.
В процессе биосинтеза белка в клетке укладка полипептидных цепей в глобулы занимает время порядка нескольких минут. Если бы при такой укладке случайным образом перебирались все мыслимые конформации цепи, это потребовало бы миллионы лет. Более того, некоторые из этих конформаций могут быть метастабильными, и их переход в правильную конформацию был бы сопряжен с преодолением значительного энергетического барьера. Природа сумела решить эту сложнейшую проблему.
Вопросы к главе 2
1. Что такое первичная структура белка?
2. Что такое денатурация белка?
3. Изобразите структуру аминокислоты, у которой боковая цепь:
а) атом водорода;
б) алифатическая гидрофобная;
в) ароматическая гидрофобная;
г) кислая;
д) основная.
4. Приведите примерные значения рКа функциональных групп боковых цепей:
а) кислых аминокислот;
б) основных аминокислот;
в) гистидина.
5. От каких аминокислотных остатков зависит суммарный заряд белковой молекулы, содержащей все 20 аминокислот?
6. Опишите четыре уровня организации молекулы белка.
7. Какую функциональную роль в структуре белка играют α-спирали и β-слои?
8. Каким образом белкам, которые так чувствительны к различного рода воздействиям, удается образовать сухожилия, невероятно прочные при растяжении?
9. Какие свойства эластина определяют его эластичность?