Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Молекулярная генетика
Индукция и репрессия; регуляция белкового синтеза
Мы уже знаем, что живые клетки обладают сложными системами управления, обеспечивающими высокую эффективность использования материальных и энергетических ресурсов. Из предыдущих глав мы узнали также, что активация и ингибирование ферментативной активности метаболитами позволяют направлять эти промежуточные вещества по необходимым путям в сложной сети клеточных реакций. В этом разделе мы рассмотрим другой уровень регуляции, принципиально отличающийся от указанных выше. Активация и ингибирование влияют на каталитическую активность уже имеющихся в клетке ферментов, но не изменяют количества последних. Таким образом, эти способы регуляции действуют на уровне ферментов. Напротив, рассматриваемые здесь механизмы регуляции — индукция и репрессия — изменяют скорости синтеза белков (и, следовательно, количества содержащихся в клетке ферментов) и осуществляются на уровне гена. По-видимому, сходство между этими двумя типами регуляции сводится лишь к их чувствительности по отношению к низкомолекулярным соединениям.
Здесь основное внимание мы будем уделять регуляции белкового синтеза на генетическом уровне в бактериях, поскольку именно в этих организмах лучше всего изучены молекулярные механизмы этих процессов. Аналогичные механизмы оперируют и в клетках высших растений и животных, однако последние располагают также гораздо менее изученной системой регуляции, направляющей дифференцировку клеток в процессе развития организма.
Прежде чем углубиться в детали механизмов индукции и репрессии, полезно попытаться оценить роль регуляции белкового синтеза в жизни микроорганизмов. В гл. 1 мы уже упоминали, что бактерии представляют собой изолированные, самостоятельно существующие клетки, и поэтому они практически не влияют па внешнее окружение. Отсюда следует, что бактерии должны обладать очень высокой способностью к адаптации; возможность эффективно функционировать в самых различных условиях может оказаться решающей для их выживания.
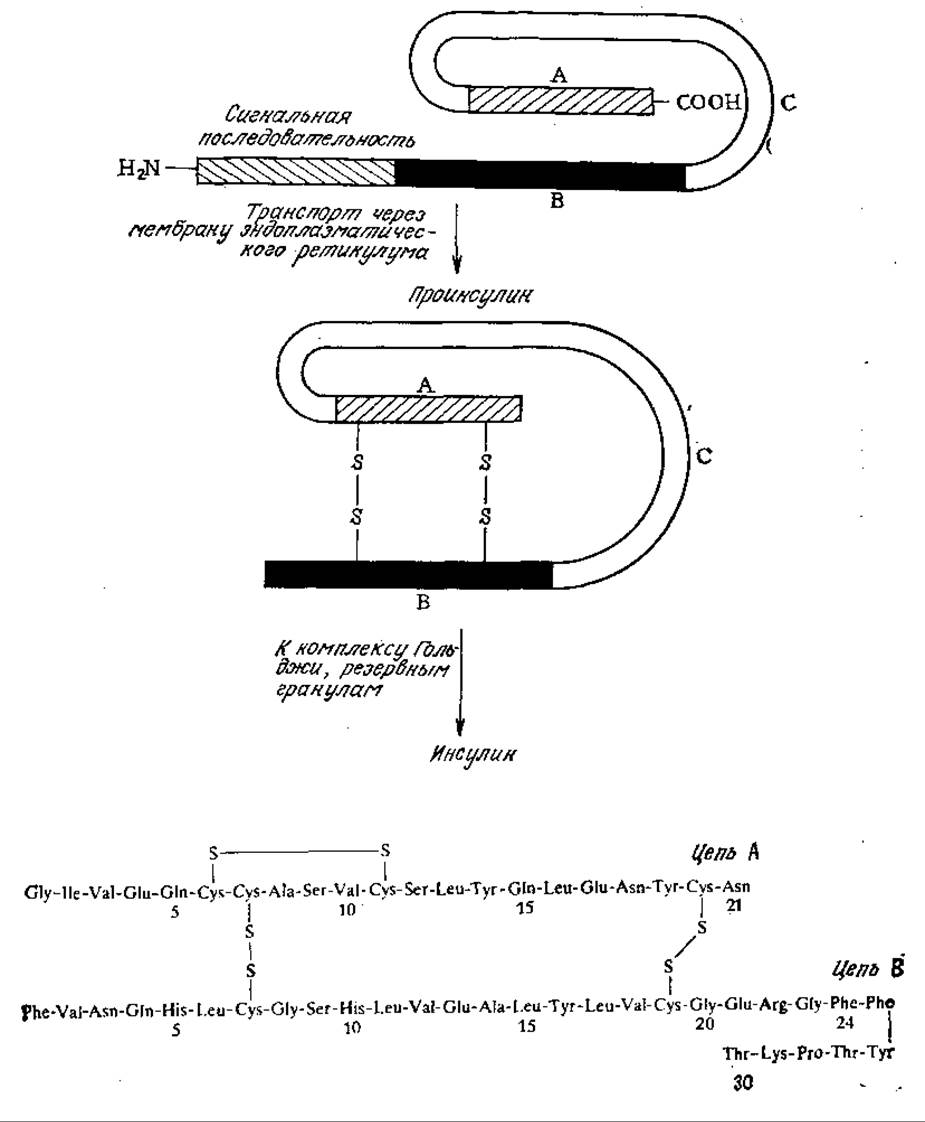
РИС. 6.8. Активная форма инсулина образуется в результате нескольких посттрансляционных превращений, в том числе в результате отщепления сигнальной последовательности, образования дисульфидных связей и отщепления цепи С. На рисунке приведена аминокислотная последовательность цепей А и В инсулина человека.
Многие бактерии и в самом деле обладают высокой приспособляемостью. Они могут синтезировать ферментные системы, способные эффективно утилизировать самые различные питательные вещества. Примером особенно универсального в этом отношении микроорганизма может служить бактерия Pseudomonas multivorans, которая в качестве единственного источника углерода может использовать более 90 различных соединений, в том числе углеводы и их производные, жирные кислоты, дикарбоновые и другие органические кислоты, первичные спирты, аминокислоты и другие азотсодержащие соединения и даже циклические соединения, например фенол. Обычно для усвоения каждого питательного вещества необходим свой фермент. Следовательно, бактерия должна нести генетическую информацию о структуре всех необходимых ферментов. Вся содержащаяся в хромосомах клетки генетическая информация называется генотипом клетки.
Однако такой бактерии не нужны одновременно все ферменты, способные усваивать любые питательные вещества, а синтез лишних белков связан с непроизводительными затратами энергии и промежуточных метаболитов. Поэтому в данной среде в целях максимальной эффективности в бактериях претерпевает экспрессию (т. е. выражается в синтезе конкретных белков) только часть всей генетической информации. Под фенотипом понимают внешний облик организма. Учитывая изложенные выше факторы, можно сказать, что данный фенотип обусловливается сочетанием генотипа организма и условий среды (его окружения). Конститутивные ферменты синтезируются независимо от состава и условий среды.
Напротив, скорость биосинтеза индуцибельных ферментов зависит от окружения клетки. Типичным примером такой зависимости может служить синтез ß-галактозидазы. Этот фермент катализирует гидролиз дисахарида лактозы на составляющие его моносахариды глюкозу и галактозу. Указанная реакция необходима, если клетка вынуждена использовать лактозу в качестве питательного вещества, поскольку в последующих реакциях могут использоваться только моносахариды. Клетка бактерии Е. coli регулирует синтез ß-галактозидазы в соответствии с потребностью в этом ферменте. С появлением в среде лактозы клетка начинает синтез фермента; этот процесс ускоряется по мере повышения концентрации лактозы вплоть до максимально возможного, полностью индуцированного уровня (рис. 6.9). Таким образом, в конечном счете именно субстрат индуцирует образование фермента.
Аналогичная ситуация складывается в случае репрессибельных ферментов. Например, Е. coli может синтезировать любые ферменты, необходимые для синтеза всех 20 аминокислот из более простых предшественников; в то же время если в питательной среде содержатся нужные аминокислоты, то соответствующие ферменты не образуются в клетке в сколько-нибудь значительных количествах. В этом случае конечный продукт пути биосинтеза подавляет синтез ферментов, катализирующих отдельные стадии этого же пути. Это явление также изображено на рис. 6.9, где в качестве примера приведен синтез гистидина.
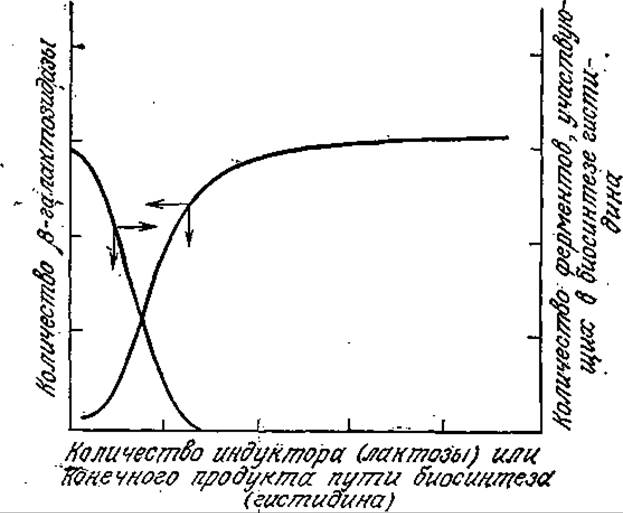
РИС. 6.9. Концентрация ß-галактозидазы в клетке возрастает по мере повышения концентрации индуктора (лактозы) в питательной среде. Повышение в среде концентрации репрессора (гистидина) уменьшает содержание в клетке ферментов, катализирующих биосинтез репрессора, (Уотсон Дж., Молекулярная биология гена. — М.: Мир, 1978.)
На рис. 6.10 приведены модели процессов индукции и репрессии, разработанные Моно с сотрудниками во Франции и отражающие внутреннее сходство этих двух процессов. В обеих случаях экспрессия гена регулируется на уровне транскрипции и ген-регулятор продуцирует белок, взаимодействующий со специфической последовательностью ДНК, называемой оператором. Если белок-модулятор связан с последовательностью оператора, то РНК-полимераза не взаимодействует с промотором; в результате блокируется процесс транскрипции и структурный ген не экспрессируется.
В модели индукции (рис. 6.10, а) регуляторный ген продуцирует молекулу репрессора, который может предотвращать синтез фермента. Если в среде присутствует индуктор, то он связывается с репрессором с образованием неактивного комплекса, не влияющего на последующую транскрипцию ДНК.
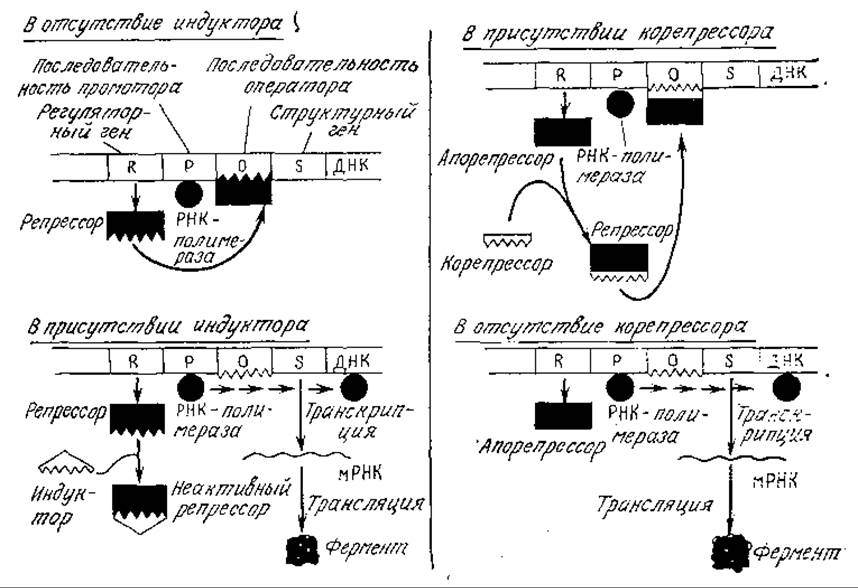
РИС. 6.10. Слева: индуктор (например, галактоза) инактивирует репрессор таким образом, что последний не связывается с соответствующей последовательностью оператора и не блокирует транскрипцию структурного гена (например, гена ß-галактозидазы). Справа: корепрессор (например, гистидин) взаимодействует с апорепрессором, образуя активный репрессор, который, связываясь с оператором, может блокировать экспрессию структурного гена; таким путем регулируется синтез репрессибельных ферментов. [Воспроизведено из работы: Demain A. L., Theoretical and Applied Aspects of Enzyme Regulation and Biosynthesis in Microbial Cells, in Enzyme Engineering, Wingard L. B., Jr. (ed.), Interscience, New York, 1972.]
В модели репрессии (рис. 6.10,6) регуляторный ген должен образовывать комплекс с другой молекулой, в результате чего к возникает репрессор. В отсутствие корепрессора (в приведенном здесь примере гистидина) белковый синтез не останавливается.
Подобные регулируемые промоторы могут одновременно контролировать синтез нескольких ферментов. При индуцировании синтеза ß-галактозидазы, например, одновременно стимулируется и синтез двух других белков, одним из которых является галактозидпермеаза, участвующая в активном транспорте ß-гaлактозидов. Здесь налицо логическая связь между функциями этих двух белков, поэтому координация их биосинтеза представляется вполне оправданной. Группа регулируемых совместно генов называется опероном; в частности, только что упомянутую систему называют lас-опероном. Количественный математический анализ регуляторных свойств lас-промотора-оператора мы рассмотрим позднее, в разд. 7.5.3.
Хотя в нашем обсуждении основное внимание уделяется регуляции синтеза ферментов в бактериях, аналогичные механизмы используются для контроля синтеза других белков в бактериях и в клетках высших растений и животных. В общем случае следует всегда иметь в виду, что синтезируемый клеткой набор белков и связанные с этим биологические и каталитические активности могут изменяться и часто действительно изменяются в ответ на изменения состава и условий среды. Эта способность к адаптации обусловливает целый ряд проблем при анализе кинетики клеточных реакций и при расчете биореакторов; такие проблемы совершенно нетипичны для технологических процессов с использованием синтетических катализаторов.
Существует несколько вариантов контроля на генетическом уровне. Рассмотреть здесь все эти варианты не представляется возможным, однако следует упомянуть о катаболитной репрессии. Если бактерии Е. coli культивируют в среде, содержащей глюкозу, и другой источник углерода, труднее включающийся в схему метаболизма, например лактозу, то преимущественно усваивается глюкоза. В этих условиях лактоза не индуцирует синтез ß-галактозидазы. В быстро растущей на глюкозе клетке ингибируется образование циклического АМР. Концентрация цикло-АМР (рис. 2.8) оказывает влияние на активность промотора lac-оперона таким образом, что при низких внутриклеточных концентрациях цикло-АМР индукция блокируется или ослабляется. Поскольку продукты катаболизма глюкозы снижают концентрацию цикло-АМР, то такой способ регуляции называют катаболитной репрессией.
Следует подчеркнуть, что катаболитная репрессия может осуществляться и в отсутствие глюкозы. Обычно бактерия, растущая на смеси источников углерода, селективно утилизирует наиболее выгодный (т. е. обеспечивающий наивысшую скорость роста) из них и катаболически подавляет утилизацию менее выгодных питательных веществ. Что же произойдет, когда истощится первый источник углерода? (См. гл. 7, разделы, посвященные кинетике процессов брожения.)
Катаболитная репрессия играет важную роль и в синтезе продуктов метаболизма. При быстром росте клеток часто не синтезируются ферменты, необходимые для образования вторичных метаболитов. Отсюда следует, что перед технологом-биохимиком может возникнуть очень интересная и важная задача обеспечения минимальной катаболитной репрессии и максимального накопления вторичных метаболитов. Пути решения этой задачи мы обсудим в гл. 7, 9 и 10.
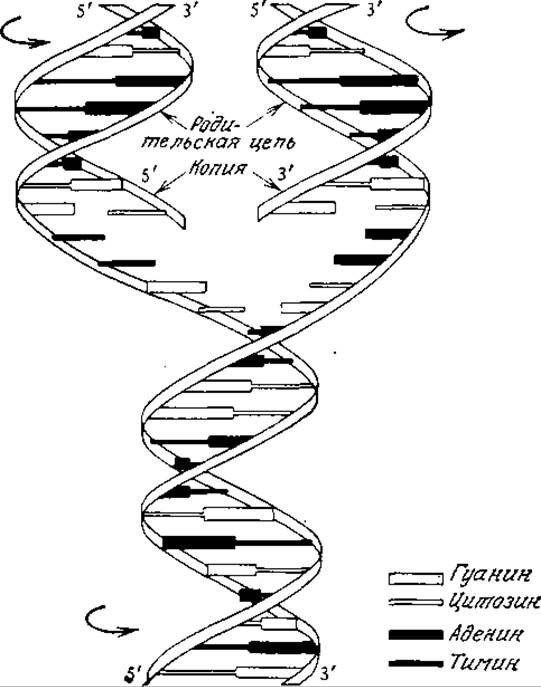
РИС. 6.11. Упрощенная схема репликации ДНК. По мере разделения родительских цепей на каждой из них формируется комплементарная цепь, в результате чего образуются две идентичные родительской дочерние молекулы. Заметьте, что каждая дочерняя молекула содержит одну цепь родительской ДНК. (Лёви А., Сикевиц Ф., Структура и функция клетки. — М.: Мир, 1971.)