Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Рост и самовоспроизведение изолированной клетки
Методы эксперимента; цитометрия в потоке и синхронные культуры
Читатель, интересующийся методами экспериментального» изучения клеточного цикла во всех деталях, может найти соответствующие сведения в монографии Митчисона [25]; мы же вкратце опишем только принципы основных методик. Наиболее очевидный подход, заключающийся в наблюдении жизненного цикла изолированной клетки, имеет весьма лимитированные возможности. Этот подход требует много времени, а получаемая таким путем информация ограничена, поскольку проводить измерения на одной клетке крайне затруднительно. Поэтому такой подход имеет существенное значение только в особых случаях.
Очевидно, любые биохимические анализы проще выполнять, когда в распоряжении экспериментатора имеется множество клеток. К сожалению, популяция клеток в суспензии с очень большой степенью вероятности будет гетерогенной в том смысле, что различные клетки будут находиться в разных периодах клеточного цикла; одни клетки только что выйдут из стадии деления, другие, зрелые клетки вплотную подойдут к процессу деления, а третьи будут занимать какое-либо промежуточное положение. Обычными методами в такой популяции можно определить лишь некоторые усредненные характеристики, но не свойства отдельных клеток.
Для быстрой оценки некоторых свойств индивидуальных клеток в гетерогенной популяции можно использовать методы цитометрии в потоке. В этих методах пробу клеток разбавляют и иногда обрабатывают тем или иным способом, чтобы ввести метку в определенные биохимические компоненты клетки. Затем пробу (разбавленную суспензию клеток) пропускают через ячейку, в которой измеряют характеристики индивидуальных клеток по мере их прохождения. К числу таких характеристик может относиться полный объем индивидуальной клетки, определяемый по рассеянию света или по изменению удельного сопротивления потока. Рассеяние света дает также ценную информацию о морфологии изолированой клетки и ее внутренней структуре. Для проточной цитометрии разработано большое число различных флуоресцентных маркеров, позволяющих определять общее содержание клеточной ДНК, двухцепочечной ДНК, белков, определенных ферментов, компонентов клеточной оболочки. Применяющиеся для этих целей приборы и устройства мы рассмотрим в разд. 10.3.2.
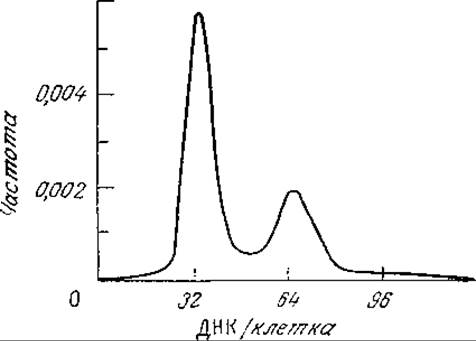
РИС. 6.30. Зависимость относительного содержания ДНК от относительного числа клеток в популяции пекарских дрожжей (Saccharomyces сеrеvisiae). Относительную интенсивность флуоресценции ДНК индивидуальных клеток, окрашенных йодистым пропидием, измеряли методом проточной цитометрии в популяции 105 клеток.
Для измерения в потоке одной характеристики индивидуальной клетки требуется всего лишь около 1 мкс, поэтому анализ, например, 105 клеток длится только несколько минут. Полученные таким способом данные обычно изображают в виде частотного распределения измеренного параметра индивидуальных клеток, т. е. в виде зависимости относительного числа клеток (частоты в пробе) от интенсивности рассеяния света или флуоресценции одной клетки. В качестве примера на рис. 6.30 приведены экспериментальные результаты оценки содержания ДНК в одной клетке среди популяции Saccharomyces cerevisiae, выросшей в проточном реакторе (см. гл. 7). Ценность таких данных заключается в том, что они непосредственно характеризуют гетерогенность популяции клеток. К тому же часто удается связать форму кривой частотного распределения с важными параметрами или характеристиками роста и деления индивидуальной клетки.
Остроумные методики синхронизации культур позволяют применять и обычные методы биохимического анализа для изучения клеточного цикла. Современные методики селекции синхронных культур позволяют получать популяции клеток, находящихся на одной стадии клеточного цикла. Для этого клетки иммобилизуют на твердом носителе, а только что возникшие дочерние клетки смывают по мере их образования. Таким образом, в любой данный момент с колонки смываются клетки только одного возраста, т. е. синхронные. В другом методе суспензию клеток центрифугируют в градиенте плотности; находящиеся на различных стадиях жизненного цикла клетки различаются размерами и плотностью и поэтому разделяются. Затем зону определенной плотности, представляющую собой гомогенную популяцию, помещают в питательный раствор и выращивают.
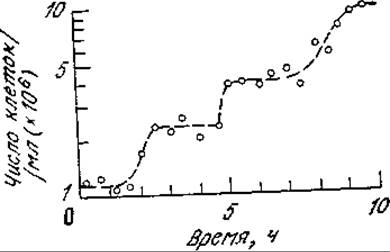
РИС. 6.31. Рост синхронной культуры дрожжей Schizosaccharomyces pombe сопровождается ступенчатым ростом числа клеток. (Воспроизведено из работы: Mitchison J. М., Vincent W. S., A Method of Making Synchronous Cell Cultures by Density Gradient Centrifugation, in Cell Synchrony, Cameron I. L., Padilla G. M. (eds.), p. 328, Academic Press, New York, 1966.)
Если мы затем проследим за изменением концентрации клеток во времени, то мы вправе ожидать ступенчатого увеличения числа клеток, поскольку число клеток должно удваиваться в каждом клеточном цикле. Приведенные на рис. 6.31 экспериментальные результаты могут служить иллюстрацией такого поведения синхронной популяции. Оказывается, что по меньшей мере в первых двух циклах популяция клеток остается гомогенной и синхронизированной; в любой момент цикла все клетки находятся примерно на одной и той же стадии развития. Как мы уже отмечали в гл. 1, гомогенные популяции являются очень удобным объектом для экспериментального исследования, поскольку они обеспечивают резкое (в миллионы раз) повышение интенсивности сигнала, отражающего характеристики индивидуальных клеток. Таким путем можно детально изучить многие особенности клеточного цикла.
Другой часто применяемый подход к получению синхронных культур называют индуцированной синхронизацией. В этом подходе популяцию вынуждают расти синхронно путем периодического изменения условий окружения. Однако поскольку такие изменения могут сопровождаться нарушением нормального метаболизма клеток, то для изучения физиологии клеток предпочтительнее методы селекции синхронных культур.
Обратите особое внимание на то, что, согласно приведенным на рис. 6.31 данным, по мере роста популяции синхронность постепенно исчезает; первоначально ступенчатая зависимость числа клеток от времени затем сменяется более плавной кривой. Причина этого кроется в потере популяцией гомогенности; тенденция к гетерогенности обусловлена стохастической природой роста и размножения клеток. Дело в том, что продолжительность клеточного цикла не является строго фиксированной, определенной величиной для всех клеток одного типа. Так, две первоначально идентичные дочерние клетки могут делиться не одновременно. В то же время продолжительность среднего жизненного цикла для популяций, состоящих из миллиардов клеток, представляет собой строго определенную величину, которая имеет большое значение при проектировании и конструировании реакторов (гл. 7).
В следующих двух разделах мы изучим картины клеточного роста и синтеза высокомолекулярных соединений в хорошо исследованной прокариоте Е. coli и эукариотическом организме Saccharomyces cerevisiae. Основное внимание в каждом из этих разделов мы будем уделять связи между репликацией ДНК и делением клетки. Очевидно, что делению родительской клетки на две дочерних должен предшествовать синтез геномов, содержащих в себе всю генетическую информацию. Следовательно, мы вправе ожидать тесной связи между процессами репликации ДНК и деления клетки; в противном случае данный вид. был бы нежизнеспособен.