Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Применение реакций, катализируемых ферментами
Применение гидролитических ферментов
Гидролиз крахмала и целлюлозы
Находящие широкое применение амилазы представляют собой ферменты, которые гидролизуют гликозидные связи в крахмале и родственных полимерах глюкозы. Чтобы понять различие между двумя основными типами амилаз, мы должны вспомнить, что крахмал состоит из линейных полимеров глюкозы, называемых амилозой, и разветвленного полимера (амилопектина). Последний значительно более растворим по сравнению с амилозой и способен резко повышать вязкость растворов крахмала. При обработке а-амилазой вязкость растворов снижается за счет неупорядоченного разрыва любых а-1,4-гликозидных связей; по этой причине а-амилазу часто называют разжижающим крахмал ферментом*. Напротив, ß-амилаза может атаковать а-1,4-связи только на невосстанавливающих концевых участках полимерной цепи, поэтому при гидролизе линейных полимеров этим ферментом всегда образуется мальтоза. По этой причине ß-амилазу называют также осахаривающим ферментом. При обработке крахмала ß-амилазой в конечном итоге образуется смесь мальтозы и декстринов, представляющих собой фрагменты молекул крахмала с концевыми 1,6-связями. Эти связи ß-амилаза не гидролизует.
* По-видимому, а-амилаза неспецифично разрывает гликозидные связи только в субстратах с достаточно длинной полимерной цепью; в случае более коротких олигомеров наблюдается известная специфичность.
Другой осахаривающий фермент, амилоглюкозидаза (имеющая много других названий, в том числе глюкоамилаза), атакует прежде всего невосстанавливающие концевые а-1,4-связи крахмала, гликогена, декстринов и мальтозы; амилоглюкозидаза гидролизует также а-1,6-связи, но со значительно меньшей скоростью. Если целью процесса является получение глюкозы, а не мальтозы, то применяют смесь ферментов или последовательную обработку а-амилазой и глюкоамилазой; такие процессы применяются на спиртоводочных заводах (в отличие от пивоваренных предприятий), в производстве концентрированных растворов глюкозы (кукурузной патоки) и кристаллической глюкозы. Подсчитано, что в 1971 г. в США таким методом было1 получено 0,61 млрд, кг глюкозы. Использование амилаз в производстве глюкозы и других областях (табл. 4.3) обусловливает очень большую практическую значимость этих ферментов. Относительные количества а- и ß-амилаз, применяемые в каждом конкретном случае, определяются конечной целью процесса.
Амилазы получают из самых различных источников. Это и неудивительно, поскольку крахмал представляет собой обычную форму резервного углевода для самых различных форм жизни. Амилазы продуцируются рядом бактерий и плесеней; в качестве примера практически важного фермента можно привести амилазу из Clostridium acetobutylicum — микроорганизма, участвующего в микробиологическом превращении полисахаридов в бутанол и ацетон. Препараты амилазы, используемые человеком для пищевых целей, обычно получают из зерновых культур, в первую очередь из ячменя, пшеницы, ржи, овса, кукурузы, сорго и риса. В амилазах зерна отношение осахаривающей и разжижающей ферментативных активностей зависит не только от типа растения, но и от состояния зерен, в первую очередь от того, проросли ли зерна или нет. В производстве солода (размягченных проросших зерен ячменя), применяемого в пивоварении, непроросшие зерна ячменя хранят в условиях высокой влажности и соответствующей температуры, способствующих их быстрому прорастанию, причем одновременно в них возрастает содержание а-амилазы. Затем проросшие зерна медленно высушивают в печи; в сухом препарате амилазная активность не проявляется, но ферменты не подвергаются необратимой инактивации. Обладающий огромной гидролитической активностью высушенный и измельченный солод используют затем для превращения крахмала в сахара, которые впоследствии могут быть переработаны путем дрожжевого брожения.
Таблица 4.3. Области наиболее широкого применения амилазных ферментовa
Производство |
Применение |
Производство глюкозы и патоки |
Крупномасштабное производство сахаров путем полного или частичного гидролиза крахмала амилоглюкозидазой или а-амилазой |
Пивоварение |
Превращение размолотых зерен крахмала в мальтозу (субстрат дисахаридной природы, пригодный для дальнейшего дрожжевого брожения) |
Хлебопечение |
Заквашивание теста: превращение части крахмала в дисахариды, образующие при последующем ферментативном распаде Диоксид углерода |
Производство фруктовых соков |
Осветление путем гидролиза нерастворимых фракций крахмала |
Бумажная промышленность |
Снижение вязкости раствора крахмала под действием а-амилазы, предшествующее нанесению раствора на целлюлозную основу (бумага с регулируемой массой) |
Текстильная промышленность |
Шлихтование: а-амилаза снижает вязкость растворов крахмала, применяющихся затем для усиления волокон основы |
Расшлихтовка: обработка а- и ß-амилазами удаляет шлихт из тканого материала; это обеспечивает равномерность последующего окрашивания и необходимую текстуру ткани |
|
Кондитерская промышленность |
Производство кондитерских изделий необходимой консистенции |
а Из работы: Weiser Н. Н., Practical Food Microbiology and Technology, p. 37, Avi Publishing Co., Westport, Conn., 1962.
Другие перечисленные в табл. 4.1 карбогидразы также расщепляют гликозидные связи. Сообщалось, например, что комбинированное применение пуллуланазы, которая селективно расщепляет 1,6-гликозидные связи боковых цепей, и амилазы повышает выход глюкозы из крахмала. В производстве мороженого обычно используют лактазу, расщепляющую лактозу на более сладкие моносахариды глюкозу и галактозу. Родственный фермент инвертаза гидролизует сахарозу и полисахариды, содержащие ß-D-фруктофуранозильные связи. Свое название этот фермент получил после того, как было установлено, что гидролиз сахарозы в растворах и образование глюкозо-фруктозного раствора сопровождается изменением направления вращения плоскости поляризации света. Частично или полностью гидролизованный раствор сахарозы обладает двумя ценными для кондитерской промышленности качествами — он несколько более сладок, чем исходный раствор, и не кристаллизуется при упаривании до значительно более высоких концентраций.
Изучению ферментативного гидролиза целлюлозы посвящено очень много работ, проводившихся в различных странах. Прежде чем приступить к изложению этой темы, следует подчеркнуть, что ферментные препараты, используемые для деполимеризации целлюлозы и обычно называемые целлюлазой, представляют собой сложную смесь многих ферментов. Более того, природа входящих в состав целлюлазы ферментов и их относительные количества зависят от типа микроорганизма, из которого была выделена целлюлаза, а в некоторых случаях и от процесса получения ферментного препарата. Как мы уже упоминали в гл. 2 при обсуждении структуры лигноцеллюлозы, вся биомасса и промышленные отходы различных производств различаются по ряду свойств, в том числе по степени кристалличности и удельной поверхности, а также по химическому составу. Некоторые методы предварительной обработки позволяют модифицировать эти субстраты и тем самым снизить их устойчивость к гидролизу. Таким образом, скорость гидролиза целлюлозных материалов и выходы продуктов в каждом конкретном процессе зависят от совокупности нескольких факторов: во-первых, от природы и свойств субстрата, во-вторых, от результатов предварительной обработки и, в-третьих, от степени активности и специфичности индивидуальных ферментов, входящих в состав целлюлазы.
В настоящее время наиболее тщательно изучены и охарактеризованы целлюлазные системы, продуцируемые грибами Trichoderma. Как показано на рис. 4.1, в состав этих систем входят три типа ферментов, действующих на различные субстраты и образующих различные продукты реакции. На этом же рисунке указаны пути ингибирования индивидуальных ферментов по принципу обратной связи. Кинетика каждой стадии этой сложной системы реакций подчиняется уравнению Михаэлиса — Ментен со строго конкурентным или неконкурентным ингибированием. Целлюлазы с различными свойствами и активностями продуцируют и многие другие микроорганизмы, в том числе плесени Fusarium solani, Aspergillus niger, Penicillium funicolsum, Sporotrichum pulverulentum, Cellulomonas sp., Clostridium thermocellum и Clostridium thermosaccharolyticum.
В табл. 4.4 приведены дополнительные сведения о целлюлазной системе из Т. viride. Обратите внимание на то, что для определения специфических активностей применяются различные «стандартные» субстраты. Немаловажны и размеры молекул ферментов, сравнимые с размерами микрофибрилл природной целлюлозы. Скорость гидролиза зависит главным образом от степени кристалличности целлюлозы. Соответствующие выражения, описывающие кинетику гидролиза с учетом степени кристалличности, мы опишем ниже, в примере 4.1; сейчас же вкратце обсудим химические и физические методы предварительной обработки лигноцеллюлозных материалов.
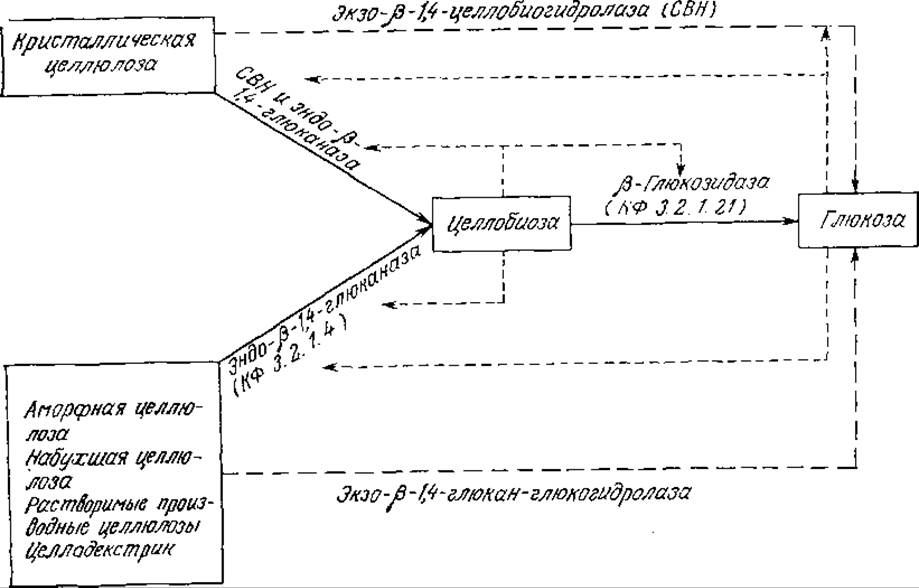
РИС. 4.1. Схема взаимодействия субстратов, деллюлаз и продуктов реакции в ходе биологической деградации целлюлозы (→ основная реакция; → побочная реакция; → эффекты ингибирования). [Воспроизведено из статьи: Lee Y. Н., Fan L. Т., Properties and Mode of Action of Cellulase, in Advances in Biochemical Engineering, Fiechter A. (ed.), 17, 101 (1980).]
Изучение методов химической обработки древесины дает представление о влиянии лигнина на устойчивость целлюлозных материалов к ферментативному гидролизу. В бумажной промышленности для растворения лигнинов и пектинов измельченную древесину подвергают сульфитной варке (обработке водным раствором гидросульфита, содержащим свободный SО2) или сульфатной варке (обработке водным раствором NaOH и Na2S) при повышенных температуре и давлении (крафт-процесс). Путем такой обработки четырех различных пород древесины в различных условиях были получены целлюлозные массы с различным содержанием лигнина, которые затем были обработаны серной кислотой для гидролиза веществ целлюлозной природы. Результаты этого эксперимента (рис. 4.2) наглядно показывают, что способность целлюлозы к гидролизу в первую очередь зависит от количества оставшегося лигнина. Для разрушения лигнина применяют и другие методы, в том числе обработку газообразным SO2, минеральными кислотами и специфическими ферментами, которые продуцируются рядом грибов, например Sporotrichum pulverulentum и Pleurotus ostreatus.
Структуру целлюлозы, в том числе такие ее характеристики, как степень кристалличности, удельная поверхность, степень полимеризации, можно изменить с помощью предварительной обработки, например путем размола на шаровой или роликовой мельнице, у-облучения, пиролиза, обработки кислыми или щелочными реагентами. В качестве примера рассмотрим кинетику изменения степени кристалличности целлюлозы при кислотной обработке древесины; сведения об изменении других свойств целлюлозы читатель может найти в приведенной в конце главы литературе.
Таблица 4.4. Свойства различных типов ферментов в целлюлазной системе Т. viride
Типы ферментов |
|||
Свойства ферментов |
Эндо-ß-1,4-глюканаза |
Экзо-β-1,4-целлобиогидролаза |
ß-Глюкозидаза (целлобиаза) |
Стандартный субстрат |
Карбоксиметилцеллюлоза (КМЦ) |
Авицельа |
Целлобиоза |
Ингибиторы |
Целлобиоза |
Глюкоза (целлобиоза) |
? |
Ориентировочная молекулярная масса |
12 500—52 000 |
46 000 |
76 000 |
Расчетный диаметр сферической молекулы, Å |
34—64 |
62 |
76 |
а Выпускаемая промышленностью кристаллическая целлюлоза, прошедшая стадию кислотной обработки.
Как показано на рис. 4.3, а, влияние предварительной обработки на кристалличность лучше всего контролировать методом рентгеноструктурного анализа. Последний позволяет определить параметр, называемый индексом кристалличности (CrІ) и рассчитываемый по эмпирическим формулам; в нашем случае (рис. 4.3, а) эта формула имеет следующий вид:
![]()
где І(am) (am — аморфный) и 1(002) — интенсивности дифракции при 20 = 18,5 и 22,5° соответственно. Значения CrІ не являются точной мерой содержания кристаллической фракции; тем не менее индекс CrІ удобен для оценки изменения степени кристалличности и средних размеров кристаллитов в различных целлюлозных материалах. Приведенные на рис. 4.3, а экспериментальные данные наглядно показывают, что при многократной обработке на роликовой мельнице степень кристалличности целлюлозы снижается.
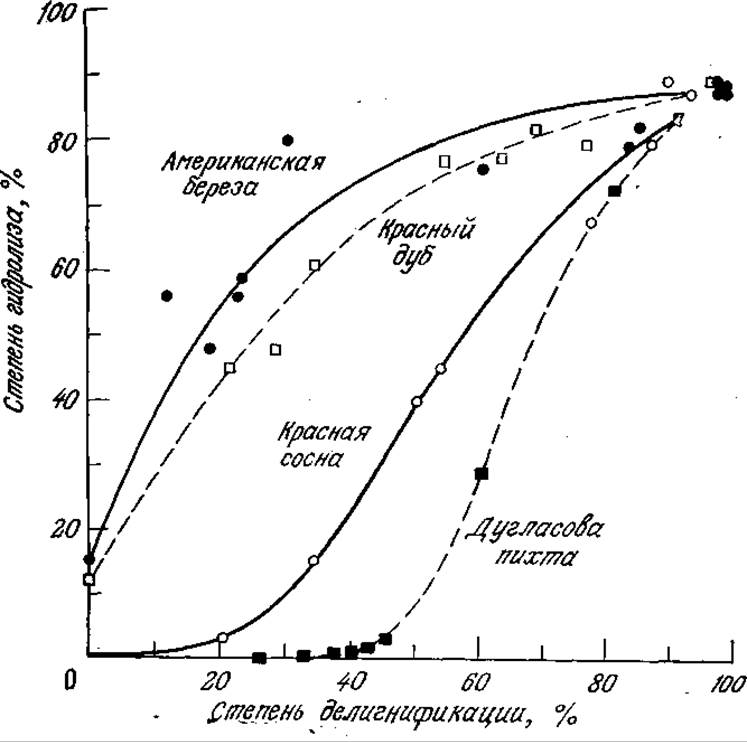
РИС. 4.2. Результаты экспериментального изучения влияния степени делигнификации на гидролизуемость целлюлозы из четырех различных пород древесины. [Воспроизведено с разрешения из статьи: Baker А. J., Effect of Lignin on the in vitro Digestibility of Wood Pulp, J. Anim. Sci., 37, 768 (1973).]
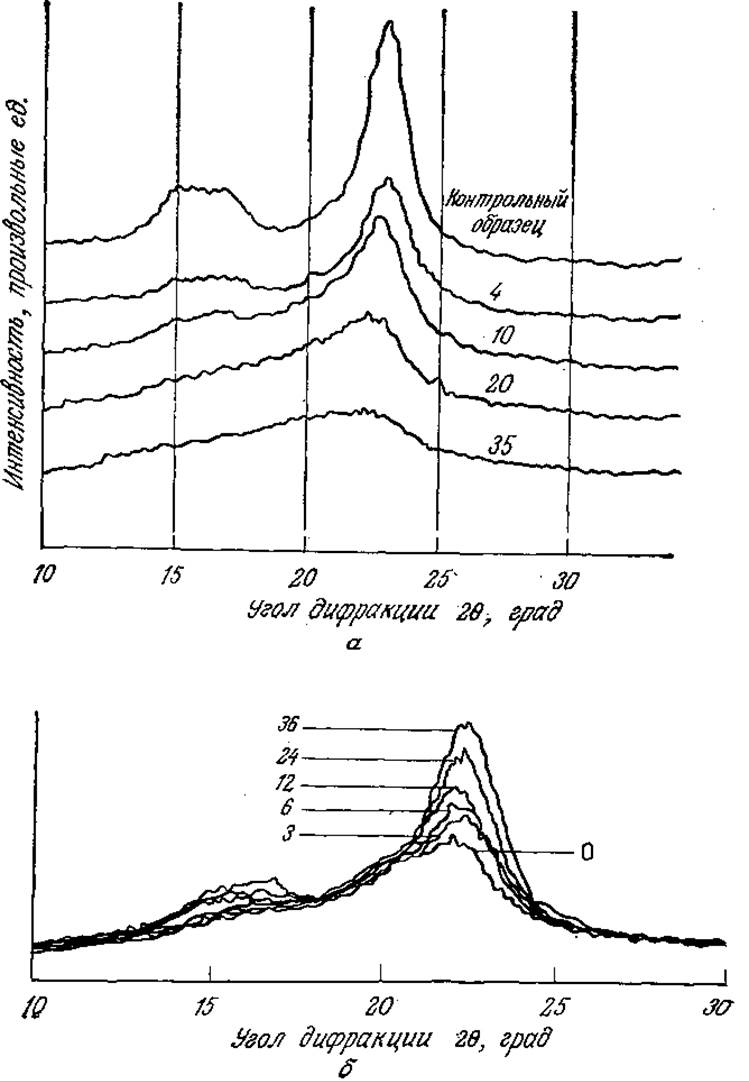
РИС. 4.3. Изменение характера дифракции рентгеновского излучения целлюлозой типа авицель после многократных пропусканий через двухроликовую мельницу (на кривых указано число пропусканий) (а); после обработки целлюлазой из Т. reesei (на кривых указано время инкубирования в часах) (б). Для расчета индекса кристалличности CrI использовались интенсивности при углах дифракции 20 = 18,5 и 22,5°. [Воспроизведено с разрешения: а) из статьи Ryu D. D. Y., Lee S. В., Tassinari Т., Масу С., Effect of Compression Milling on Cellulose Structure and on Enzymatic Hydrolysis Kinetics; Biotech. Bioeng, 24, 1047 (1982); б) из статьи: Lee S. В., Kim I. H., Ryu D. D. Y., Taguchi H., Structural Properties of Cellulose and Cellulase Reaction Mechanism; Biotech. Bioeng., 25, 33 (1983).]
Ранее, при обсуждении структуры целлюлозы и активности целлюлазных ферментных систем, мы уже упоминали, что скорость гидролиза аморфных и паракристаллических участков целлюлозы должна быть выше скорости гидролиза кристаллической целлюлозы. Отсюда следует, что снижение степени кристалличности целлюлозы должно сопровождаться повышением скорости ее ферментативного гидролиза. Действительно, такая зависимость была обнаружена, в частности, при изучении гидролиза тех же целлюлозных материалов, которые исследовались в эксперименте, изображенном на рис. 4.3, а, под действием суммарного препарата целлюлаз из Trichoderma reesei MCG-77 (табл. 4.5). В табл. 4.5 приведены кажущиеся средние значения параметров в обычном уравнении Михаэлиса — Ментен; их определяли, допустив, что при измерении начальной скорости реакции целлобиоза в смеси отсутствовала.
Расчеты изменения скорости ферментативного гидролиза целлюлозных материалов во времени осложняются тем обстоятельством, что в ходе таких процессов меняется также относительное содержание кристаллической и аморфной фракций субстрата (рис. 4.3,6). В приведенном ниже примере мы рассмотрим модифицирование принципов моделирования, изложенных в гл. 3, в применении к системам такого рода.
Таблица 4.5. Влияние числа пропусканий через роликовую мельницу на кристаллическую структуру целлюлозы типа авицель и средние кинетические параметры ее гидролиза под действием целлюлазы из Т. reeseia
Число пропусканий |
СrI, % |
Размер кристаллитов, А |
vappmax. мкг/(мл∙мнн) |
Каррm. мг/мл |
vаррmах/Каррm, ч-1 |
0 |
81 |
38 |
|||
4 |
71 |
31 |
19,6 |
31,3 |
0,038 |
10 |
61 |
21 |
22,2 |
20,0 |
0,067 |
20 |
37 |
10 |
23,1 |
14,8 |
0,110 |
35 |
17 |
7 |
19,3 |
7,7 |
0,150 |
а Данные из статьи: Ryu D. D. У., Lee S. В., Tassinari T., Масу C., Effect of Compression Milling on Cellulose Structure and on Enzymatic Hydrolysis Kinetics, Biotech. Bioeng., 24, 1047 (1982).
Пример 4.1. Влияние степени кристалличности целлюлозы на скорость ее ферментативного гидролиза*. Для изучения гидролиза целлюлозы ферментными системами типа целлюлазы разработано несколько математических моделей кинетики этих процессов. В одной из них наибольшее внимание уделяется влиянию кристалличности; в этом подходе принимается, что ферменты целлюлазы (их сумма обозначается здесь символом Е) адсорбируются на целлюлозе в состоянии Е*:
![]()
Допуская, что адсорбция фермента носит равновесный характер и что концентрация фермента в растворе достаточно низка (на практике е0 < 0,5 мг белка в 1 мл реакционной смеси), получим
![]()
* Ryu D. D. Y., Lee S. B., Tassinari T., Масу C., Effect of Compression Milling on Cellulose Structure and on Enzymatic Hydrolysis Kinetics, Biotech. Bioeng., 24, 1047 (1982).
Описание модели завершается еще двумя допущениями, согласно которым адсорбированный фермент катализирует гидролиз аморфной (Sa) и кристаллической (Se) целлюлозы в соответствии со следующими уравнениями параллельно осуществляющихся реакций:
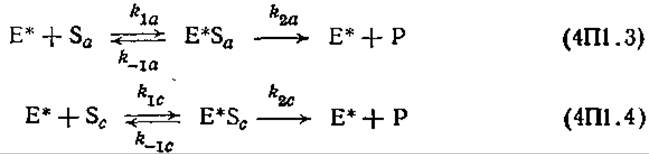
причем адсорбированная и свободная целлюлазы связываются с инертным материалом целлюлозного субстрата, а также с продуктом реакции соответственно:

Применив ко всем фермент-субстратным комплексам приближение квазистационарного состояния и суммируя концентрации всех форм фермента, получим следующее выражение для начальной скорости гидролиза чистой целлюлозы (sх = 0) при низкой концентрации фермента и в отсутствие продукта реакции (р = 0):
![]()
Здесь s (s = sa + sc) — общая концентрация целлюлозы. Зависимость кажущихся максимальной скорости и константы Михаэлиса от начального индекса кристалличности CrI0 [CrI0 = sc0/(sa0 + sc0)] и констант скоростей элементарных реакций можно выразить следующим образом:
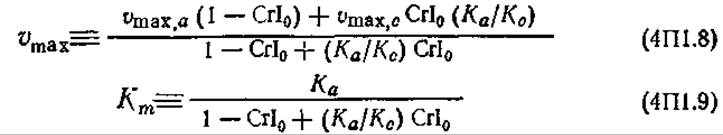
где
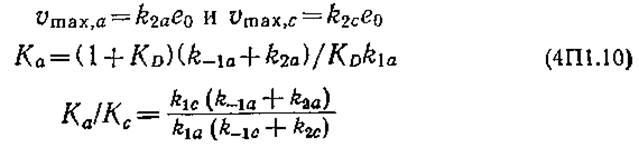
Выражения (4П1.8) и (4П1.9) свидетельствуют о зависимости начальной скорости реакции от начальной кристалличности субстрата СrI0, причем константа скорости реакции псевдопервого порядка vmахарр/Kmарр и величина, обратная кажущейся константе Михаэлиса, 1/Кmарр, линейно зависят от СrI0; это дает возможность проверить соответствие описанной модели экспериментальным данным. Построенные на основе результатов эксперимента
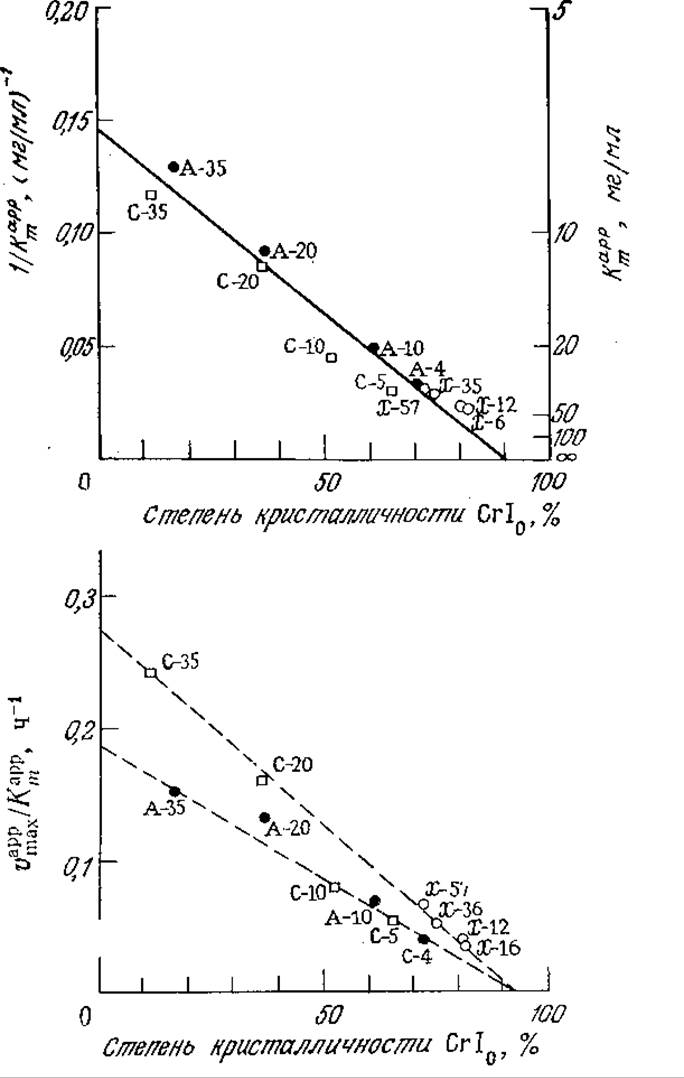
РИС. 4П1.1. Экспериментальное определение зависимости кажущихся кинетических параметров vmaxapp и Kmарр от начальной степени кристалличности субстрата CrI0 для авицеля (А, O), хлопка (X, О) и целлюлозы типа солка-флок (С, □). Цифры указывают число предварительных пропусканий субстрата через роликовую мельницу. Характер дифракции рентгеновского излучения субстратами представлен на рис. 4.3,а. [Воспроизведено из статьи: Ryu D. D. Y., Lee S. В., Tassinari Т., Масу С., Effect of Compression Milling on Cellulose Structure and on Enzyme Hydrolysis Kinetics, Biotech. Bioeng., 24, 1047
Применение реакций, катализируемых ферментами графики зависимостей указанных кинетических параметров от начальной степени кристалличности субстрата для ряда образцов целлюлозы приведены на рис. 4П1.1. Большинство данных хорошо согласуется с описанной моделью; наибольшее отклонение обнаружено в случае константы скорости реакции псевдопервого порядка для целлюлозы типа солка-флок.
Эти результаты весьма поучительны в том отношении, что они могут служить примером вывода полезных математических выражений для интерпретации кинетических данных на базе обоснованной гипотезы о природе происходящих в системе превращений. Приведенное выше выражение для начальной скорости несколько громоздко, однако уже из механизма процесса очевидно, что начальная скорость гидролиза должна зависеть от всех параметров, входящих в состав этого уравнения. Более того, соответствующее выражение для зависимости скорости реакции гидролиза целлюлозы в реакторе периодического действия от времени будет, очевидно, еще сложнее, поскольку в нем необходимо учитывать и ингибирование процесса продуктом реакции [см. уравнение (4.П1.6)]. Наконец, при расчете изменения концентрации субстрата во времени следует учитывать и тот факт, что субстрат представляет собой смесь кристаллической и аморфной форм, гидролизующихся с различными скоростями. Следовательно, описывающее кинетику гидролиза выражение должно отражать два параллельных процесса с двумя различными субстратами, причем эти процессы взаимосвязаны, поскольку относительные количества аморфной и кристаллической целлюлозы также не постоянны во времени, о чем свидетельствует изменение индекса кристалличности.
Этот пример иллюстрирует только некоторые из тех многочисленных затруднений, которые встречаются при моделировании биологических субстратов и катализаторов. Как мы еще не раз увидим в последующих главах и разделах, общий принцип создания моделей подобных сложных систем сводится к выбору такой биохимической или механистической схемы и соответствующих математических выражений, которые отражали бы изменение только ключевых переменных, представляющих основной интерес в конкретном анализе. Так, в нашем примере мы рассматривали некоторый идеализированный субстрат целлюлозной природы. Такое допущение позволяет оценить влияние кристалличности на ход гидролиза, определить соответствующие кинетические параметры и рассчитать закономерность изменения кристалличности субстрата в реакторе периодического действия. Все приведенные экспериментальные данные были получены с использованием одного и того же целлюлазного ферментного комплекса, поэтому описанная модель вообще не учитывает влияние индивидуальных ферментов, входящих в состав комплекса, и их относительное содержание в комплексе. Очевидно, при сравнении с данными, полученными в ходе изучения целлюлаз из других источников, возникнет необходимость в учете относительного содержания различных ферментов в комплексе и их активностей. В идеальном варианте в результате ряда тщательных экспериментальных исследований и разработки соответствующих математических моделей типа рассмотренной выше мы в конце концов смогли бы получить разностороннюю информацию о происходящих в системе целлюлоза — целлюлаза превращениях и на этой основе разработать некоторую общую модель, которая более полно отражала бы свойства субстратов и ферментов этой системы.
В завершение этого обзора, посвященного проблеме использования целлюлозы, следует упомянуть, что существуют и другие физические и химические методы деградации целлюлозы. Так, в последние годы были разработаны усовершенствованные процессы кислотного гидролиза целлюлозы, отличающиеся применением более высоких температур и сокращенным временем обработки и позволяющие получать необходимые продукты деградации при минимальном количестве побочных веществ. Другой многообещающий метод переработки целлюлозы базируется на ее пиролитической деградации. Изучаются, разрабатываются или уже применяются также методы переработки лигноцеллюлозы, основанные на шнековой экструзии, обработке гетерогенными катализаторами, газификации в псевдоожиженном слое и на самом старом способе переработки путем сжигания.