Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Стехиометрия и энергетика метаболических превращений
Организация и регуляция метаболизма
Регуляция метаболизма на ферментативном уровне
Аллостерические ферменты регулируют распределение потоков веществ по различным путям метаболизма. Роль регуляторных сигналов, которые управляют активностями этих ферментов, выполняют концентрации ATP, NADH, NADPH, а также некоторых ключевых соединений-предшественников и промежуточных веществ. Влияние некоторых из этих сигналов на разделение потоков в точках разветвления в общих чертах показано на рис. 5.24. Здесь мы рассмотрим некоторые наиболее показательные примеры регуляции метаболизма, а также осуществляющийся иногда координированный контроль нескольких путей метаболизма.
Очевидно, что концентрация АТР в клетке должна поддерживаться на необходимом уровне. Мерой энергетического состояния клетки может служить аденилатный энергетический заряд [4], определяемый как отношение концентрации АТР к сумме концентраций AMP, ADP и АТР:
![]()
В большинстве клеток энергетический заряд изменяется в пределах от 0,87 до 0,94.
Чтобы понять, как достигается столь высокая степень постоянства концентрации АТР, рассмотрим сначала путь ЭМП (рис. 5.25). Первичным регуляторным ферментом здесь служит фосфофруктокиназа, которая активируется ADP и ингибируется АТР. Таким образом, этот фермент замедляет поток метаболитов по пути ЭМП, если энергетический заряд высок, и наоборот. Аналогично действует пируваткиназа, активируемая АМР. Вспомним, что фосфорилирование глюкозы, а также реакции фруктозо-6-фосфата и фосфоенолпирувата представляют собой единственные три необратимые реакции пути ЭМП. Теперь мы можем понять причину этого явления: на первой стадии образуется ионизированное производное, прочно удерживаемое внутри клеточной оболочки, а две другие необратимые стадии представляют собой регуляторные пункты.
Энергетический заряд влияет и на активность цикла ТКК. Изоцитратдегидрогеназа активируется ADP и ингибируется АТР. Поскольку одна из основных функций метаболических путей ЭПМ и ТКК заключается в фосфорилировании ADP, что приводит к повышению энергетического заряда клетки, нетрудно видеть, что основным типом регуляции в схеме на рис. 5.25 являются согласованные и координированные формы ингибирования по принципу обратной связи.
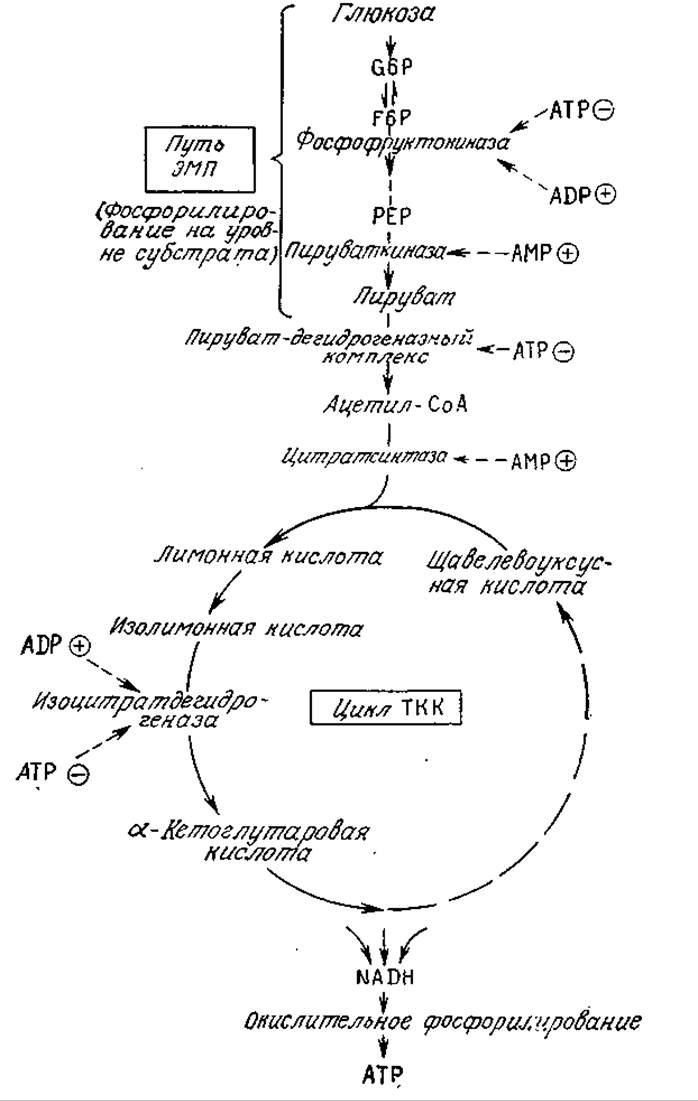
РИС. 5.25. Регуляция метаболического пути ЭМП и цикла ТК.К аденозинфосфатами. Штриховые стрелки указывают аллостерический эффект в отношении данного фермента; знаком ⊕ обозначена активация фермента, знаком ⊖ — его ингибирование.
Для управления поступлением веществ-предшественников и процессами биосинтеза, очевидно, необходимы другие системы регуляции. Цитрат, например, служит аллостерическим модулятором нескольких ферментов. Он повышает ингибиторный эффект АТР в отношении фосфофруктокиназы. Этот факт отражает амфиболическую природу путей ЭМП и ТКК, благодаря которой в любом из них при высоком энергетическом заряде и поступлении достаточного количества питательных веществ могут использоваться соединения с шестью атомами углерода. Цитрат является также мощным активатором первой реакции в биосинтезе жирных кислот [уравнение (5.34)].
Центром регуляции путей биосинтеза обычно являются стадии, следующие непосредственно за точкой разветвления. Примером такой регуляции могут служить реакции биосинтеза аминокислот семейства аспарагиновой кислоты, изображенные на рис. 5.12, где штриховые линии обозначают пути ингибирования по принципу обратной связи. Выгоды разветвленной последовательности реакций с несколькими регулируемыми стадиями очевидны: таким путем в результате ограниченного числа реакций образуется несколько конечных продуктов, причем путь синтеза каждой аминокислоты регулируется независимо. На первый взгляд может показаться, что в этой системе есть один дефект: высокие концентрации лизина и треонина должны, вероятно, замедлять синтез гомосерина и метионина. На самом же деле этого не происходит, поскольку превращение аспартата в аспартил-β-фосфат катализируют три различных фермента. Активность одного из этих ферментов не регулируется, второй ингибируется лизином, а третий ингибируется треонином. Различные ферменты, катализирующие одну и ту же реакцию, называются изозимами или изоферментами. Точно так же превращение полуальдегида аспарагиновой кислоты в гомосерин катализируют два изофермента, один из которых не регулируется, а второй ингибируется треонином. Эти факты помогают понять, как осуществляется действенный и эффективный контроль сети реакций при любом сочетании избыточных концентраций продуктов метаболизма.
Целью того или иного процесса биохимической технологии может быть производство больших количеств определенных метаболитов. В таком случае стремление добиться максимальной производительности в отношении этих соединений, очевидно, вступает в противоречие с системами жизнеобеспечения и регуляции нативного организма. Чтобы заставить клетку продуцировать необходимые метаболиты достаточно эффективно (с точки зрения человека, но не «с точки зрения» клетки), часто пытаются модифицировать регулирующие метаболизм ферменты таким образом, чтобы свойственные нативной клетке системы регуляции не срабатывали и происходило перепроизводство нужных метаболитов. На этой проблеме мы еще остановимся в следующей главе в ходе изучения прикладной генетики. Здесь же нам осталось рассмотреть только стехиометрические и энергетические аспекты сочетания различных метаболических путей, а также суммарную стехиометрию утилизации субстратов, клеточного роста, образования метаболитов и выделения теплоты. В качестве введения к этой теме мы познакомимся с природой конечных продуктов метаболизма, выделяемых клеткой в среду.