Химия и биология белков - Ф. Гауровитц 1953
Роль белков в реакциях иммунитета
Антигены
Впервые появление иммунитета наблюдалось при бактериальной инфекции. Человек, перенесший инфекционное заболевание, становился невосприимчивым к повторному заражению тем же самым микробом. При изучении причин этой невосприимчивости было найдено, что она обусловлена способностью сыворотки специфически агглютинировать или растворять бактерии, вызывающие инфекцию, а также повышать чувствительность этих бактерий к действию фагоцитов. Пытаясь объяснить это явление, Эрлих пришел к выводу, что в иммунной сыворотке должны присутствовать антитела, и назвал антигенами те вещества, которые вызывают появление этих антител.
В 1897 г. Крауз [1] показал, что не только бактерии или клетки, но и некоторые растворимые вещества могут действовать как антигены. Антигены осаждаются соответствующими антителами. Этот феномен, так называемая реакция преципитации, служит самым простым (а некогда и единственным) методом изучения видовой специфичности белков. Огромное значение этого метода в химии белка совершенно очевидно.
Первоначально считали, что белковые антигены существенно отличаются от бактериальных и клеточных антигенов. Впоследствии, однако, было показано, что бактерии или клетки нельзя рассматривать как индивидуальный антиген, ибо они состоят из целого ряда различных веществ, так сказать из «мозаики» веществ, часть которых представляет собой антиген, тогда как другие не обладают антигенным действием. Антигенными свойствами обладает большинство белков, встречающихся в организме животных, растений и бактерий. В отличие от белков углеводы, липиды и другие вещества, как правило, не являются антигенами, т. е. не обладают способностью вызывать образование антител.
Уже давно известно, что некоторые низкомолекулярные вещества, например иод, пикрилхлорид (1-хлоро-2,4,6-тринитробензол) и другие нитросоединения, при парентеральном введении способны вызывать состояние аллергии. Предполагается, что в этом случае аллергия развивается вследствие образования антител не против самих инъицированных веществ, а против их производных. Это предположение основывается на том, что все перечисленные вещества легко соединяются с белками in vitro. Можно думать, что при введении в организм этих веществ они соединяются с белками в месте инъекции и что образовавшийся при этом белковый комплекс и является настоящим антигеном [2]. Аналогичные результаты были получены с липидами, которые также приобретают антигенные свойства после смешивания с белковыми растворами. Низкомолекулярные вещества, являющиеся предшественниками антигенов, называются проантигенами [3]. Большинство исследователей считает, что для превращения проантигенов в антигены необходимы белки.
Поскольку большинство белков переваривается пепсином или трипсином, вполне понятно, что белки теряют свои антигенные свойства при прохождении через пищеварительный канал. Поэтому, чтобы вызвать образование антител, необходимо вводить белки парентерально.
Любой из природных белков обладает антигенной специфичностью. Антитела, возникшие в ответ на введение определенного белка, образуют преципитаты только с этим белком, но не с другими белками. Перекрестная реакция наблюдается только в тех случаях, когда исследуемый антиген очень близок к антигену, применявшемуся для иммунизации. Так, например, антитела, образующиеся при инъекции сывороточных белков лошади, преципитируют также и сывороточные белки осла; яичный альбумин утиных яиц преципитируется антителами, образовавшимися при иммунизации яичным альбумином куриного яйца [4]. С другой стороны, серологические свойства миоглобина резко отличаются от свойств гемоглобина, хотя оба вещества содержат один и тот же гемин [5]. Очевидно, в данном случае специфичность обусловливается белковым компонентом, а не гемином. Гемоглобин человека серологически отличается от гемоглобина быка. Однако при помощи реакции задержки комплемента можно установить наличие некоторого родства между этими двумя веществами [6].
Белки обладают не только видовой, но также и органной специфичностью. Так, например, белки сыворотки отличаются серо- логически от гемоглобина или от мышечных белков того же самого животного. Впрочем, некоторые фракции глобулинов, выделенные дробным осаждением сернокислым аммонием, очень сходны между собой, и при помощи реакции преципитации их удается различить лишь с большим трудом [7]. Ферритин (см. гл. XI) видоспецифичен, но не обладает органной специфичностью [8].
Ландштейнер [2] нашел, что специфичность белков обусловлена не белковой молекулой в целом, а лишь определенными химическими группами этой молекулы. Правильность данного положения была доказана при помощи комплексирования белков с различными химическими группами. Основной метод, использованный Ландштейнером для этой цели, заключается в диазотировании белков различными диазосоединениями. Подобный метод имеет следующие преимущества: 1) практически все вещества обладают способностью образовывать диазопроизводные, и, следовательно, таким способом можно присоединять к белковой молекуле любые желаемые группы; 2) комплексирование диазосоединений с белками происходит при 0° в слегка щелочном растворе (pH 9), т. е. в условиях, при которых большинство белков не денатурируется. При помощи этого метода удалось получить весьма интересные данные; некоторые из этих данных будут изложены ниже.
Для того чтобы определить, обладают ли антитела специфичностью по отношению к оптическим изомерам, Ландштейнер соединял белки с d- и l-винной кислотой. Для получения диазосоединений этих кислот их подвергали конденсации с нитроанилином, затем восстанавливали нитровинноанилиновую кислоту в соответствующее аминосоединение и диазотировали это последнее:
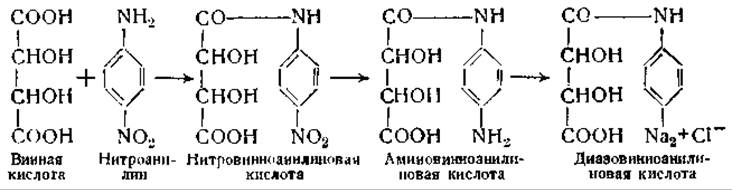
Полученные диазосоединения легко соединяются с находящимися в белке молекулами тирозина и гистидина, образуя окрашенные азобелки:
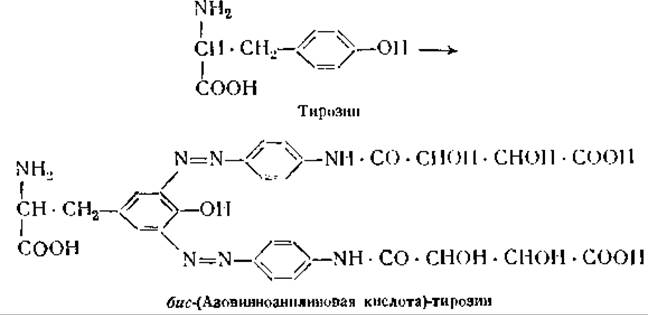
В результате этих экспериментов Ландштейнер нашел, что азобелки, содержащие d-винную кислоту, и такие же азобелки, содержащие l-винную кислоту, ведут себя как различные антигены. Антитела, образованные в ответ на введение белка, соединенного с одним из изомеров, не реагируют с белком, соединенным со вторым изомером [9]. Подобным же образом отличаются друг от друга по антигенным свойствам лейцилглицин и глицил-лейцин [10]. В другой серии опытов было показано, что диазопроизводные о-, м- и n-аминофенилсульфокислоты при соединении с белками дают совершенно различные антигены [11]. Как из этих, так и из многих других данных, на которых мы здесь не можем останавливаться, вытекает, что специфичность обработанных подобным образом белков зависит главным образом от химических групп, введенных в их молекулу. Так, например, антитела против арсанилазопроизводных сывороточных белков лошади могут преципитировать арсанилазоовальбумин и другие арсанилбелки. При химической обработке белки могут терять свою видовую специфичность. Если, например, в молекулу сывороточного глобулина лошади ввести большое число азогрупп, то образовавшиеся соединения не преципитируются антителами против этого глобулина. Точно так же при иодировании или ацетилировании сывороточного глобулина происходит потеря его видовой специфичности, если число введенных атомов иода или ацетильных групп превышает некоторый минимум [12].
Не все группы, которые можно ввести в белковую молекулу, обладают способностью изменять ее серологические свойства и вызывать образование специфических антител. Серологическую специфичность антигенов определяют только полярные группы, главным образом кислотные группы, например —СООН, —SO3H, —AsО3H2 [2], или основные группы, например четвертичная аммониевая группа [13]. Полярные группы, вероятно, определяют и антигенную специфичность природных белков. В настоящее время мы не в состоянии указать, какие именно химические группы определяют антигенную специфичность этих белков. Весьма вероятно, однако, что эта специфичность связана не с одним каким-нибудь определенным типом групп, а зависит от определенного расположения на поверхности белковой молекулы различных полярных групп [12].
Антигенные свойства белков исчезают после расщепления белков протеолитическими ферментами. В результате денатурации может происходить либо изменение, либо частичная потеря первоначальных антигенных свойств нативного белка. Так, например, антитела против нативного яичного альбумина весьма слабо реагируют с денатурированным яичным альбумином [14]. Иммунизация же денатурированным яичным альбумином приводит к образованию антител, специфически реагирующих только с денатурированным белком [15]. Надо, однако, отметить, что каких-либо заметных различий в антигенной активности нативного и денатурированного сывороточного глобулина лошади обнаружить не удалось [16]. Количественное изучение антигенных свойств денатурированных белков весьма затрудняется их склонностью образовывать агрегаты, так как образование агрегатов влечет за собой неспецифическое увеличение массы преципитата. Снижение антигенной активности денатурированных белков обусловлено, по всей вероятности, тем, что они расщепляются протеолитическими ферментами значительно быстрее, чем нативные белки (см. стр. 149). В связи с этим денатурированные белки могут расщепляться в организме прежде, чем они успеют вызвать образование антител.
Желатина, которую получают при нагревании коллагена, не обладает антигенными свойствами. Этот факт первоначально пытались объяснить отсутствием в этом белке тирозина. Однако желатина не приобретает антигенных свойств и после присоединения к ней тирозина [17], диазосоединений [18] или иода [19]. В настоящее время отсутствие антигенных свойств у желатины приписывают нескольким причинам: 1) желатина представляет собой денатурированный в результате нагревания белок и вследствие этого не обладает определенной внутренней структурой [20]; 2) при введении в организм она не отлагается в местах образования антител, но быстро выводится из организма [18, 19]; 3) желатина содержит большое количество глицина. Поскольку глицин не содержит в a-положении боковых цепей, пептидные цепи, в состав которых входит глицин, могут свободно вращаться вокруг своей длинной оси, что влечет за собой нарушение их пространственной конфигурации [21]. В связи с этим пептидные цепи желатины не обладают жесткой структурой, которая является одним из необходимых условий иммунологической специфичности белков.
Необходимость наличия определенной, устойчивой структуры для сохранения антигенных свойств подтверждается тем фактом, что эти свойства теряются при действии на белки высокого давления. Так, например, сывороточные белки теряют свои антигенные свойства после выдерживания под давлением 6 000 атм [28].
Иммунологическая специфичность белков является весьма характерным их свойством, которое в нормальных условиях сохраняется без изменения. Однако присоединяя к белкам чужеродные соединения или создавая комплексы из двух и более белков, можно изменить их антигенные свойства. Так, например, если сывороточный глобулин осторожно нагревать в присутствии сывороточного альбумина, то образуется комплекс, обладающий новыми серологическими свойствами [23]. Подобным же образом при иодировании белков происходит изменение их серологической специфичности [24, 25]. Специфичность иодированных белков обусловливается присутствием в них дииодтирозиновых групп. Однако антитела против этих белков не реагируют с тиреоглобулином — иодсодержащим белком щитовидной железы [26J. Это указывает на то, что дииодгруппы в тиреоглобулине расположены внутри крупной молекулы гормона тиреоглобулина и что они поэтому недоступны для антител против дииодтирозина. Совершенно очевидно, что определять специфичность молекулы антигена могут лишь реактивные группы, расположенные на поверхности молекулы.
Подытоживая изложенные данные, можно сказать, что наличие антигенных свойств у молекул того или иного соединения зависит от следующих условий: 1) молекула должна содержать белок в качестве носителя детерминирующих групп; 2) белковая частица должна иметь некоторые минимальные размеры; 3) внутренняя ее структура должна быть устойчивой и не должна быстро изменяться и 4) белок должен нести на своей поверхности определенное число полярных групп.
Отсутствие антигенных свойств (точнее, наличие лишь незначительной антигенности) у инсулина и многих гормонов гипофиза, по всей вероятности, обусловлено их низким молекулярным весом. В некоторых случаях мы не знаем причины, почему то или иное соединение лишено антигенных свойств. Так, например, неизвестно, почему желтые ферменты (флавопротеины) не являются антигенами [27], хотя другие ферменты, в частности уреаза, весьма активны в этом отношении.
Соединение антигена с антителом не требует обязательного участия белкового компонента антигена; так, например, антитела против арсанилазобелков соединяются также и с арсаниловой кислотой или с арсанилазотирозином [28, 29]. Оказалось также, что реакция между сульфонилазобелком и соответствующим антителом тормозится низкомолекулярными соединениями, содержащими ту же самую группу фенилсульфокислоты [2]. Такие низкомолекулярные небелковые соединения называются гаптенами вследствие их способности связываться с антителами (от греческого слова гаптен — связывать). Обычно процесс соединения антитела с гаптеном не сопровождается преципитацией, хотя в некоторых случаях преципитация имеет место. Гаптены отличаются от настоящих антигенов тем, что они неспособны вызывать образование соответствующих антител при парентеральной инъекции.