Химия и биология белков - Ф. Гауровитц 1953
Синтез белка
Ферментативный синтез пептидов
Имеются многочисленные сообщения о том, что аминокислоты и пептиды могут превращаться в белки под действием протеолитических ферментов. Синтетические белки, полученные таким способом, были названы пластеинами. Тщательное повторение этих опытов с использованием усовершенствованной техники [12] и иммунологических методов анализа [13] показало, что некоторые из веществ, образующихся при подобной обработке, являются пептидами или циклопептидами [14] с низким молекулярным весом. В некоторых из опубликованных опытов образование белков было обусловлено размножением бактерий или плесеней. Это видно из того, что аминокислотный состав образовавшихся при этом белков отличается от состава аминокислот белков, подвергнутых обработке протеолитическими ферментами. С другой стороны, при действии химотрипсина на смесь пептидов, присутствующих в пептоне Витта, наблюдается настоящий синтез белка [15]. Химотрипсин катализирует также образование пептидов из эфиров аминокислот [16]. Энергия, необходимая для этой эндергонической реакции, доставляется одновременно протекающим процессом превращения части эфиров аминокислот в свободные аминокислоты [16].
Соединение аминокислот друг с другом, приводящее к образованию пептидов или белков, связано с освобождением воды; по этой причине синтез подобных соединений должен был бы сопровождаться увеличением, а гидролиз — уменьшением объема раствора (см. гл. III). В соответствии с этим следует ожидать ускорения гидролиза белка под влиянием высокого давления. Вопреки этому недавно появились сообщения о том, что триптический гидролизат сывороточного альбумина под давлением 6 000 атм при 38° превращается в сывороточный альбумин [17] Необходимо отметить, что имеющиеся в литературе сообщения о ферментативном синтезе белков весьма противоречивы и нуждаются в дальнейшей проверке. Истинный ферментативный синтез пептидов был осуществлен Бергманом [18], который получал анилиды ациламинокислот из ациламинокислот и замещенных анилинов, действуя на них папаином или химотрипсином. Этим способом был получен гиппуриланилид из гиппуриламида и анилина под действием папаина
![]()
и бензоилтирозилглициланилид из бензоилтирозина и глициланилида под действием химотрипсина [20]
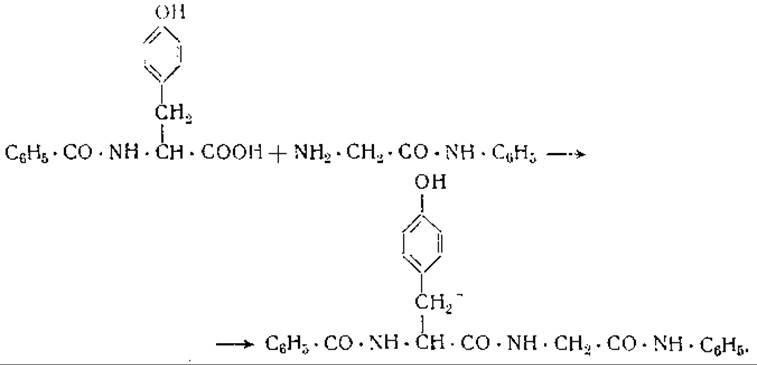
1 Автор здесь уделяет лишь очень незначительное внимание работам наших советских исследователей С. Е. Бресслера и его сотрудников о ресинтезе белков из продуктов их ферментативного расщепления при высоких давлениях. Между тем эти исследования имеют громадное значение для развития наших представлений о процессах синтеза белка. Подробнее об этих работах см. обзор С. Е. Бресслера (Некоторые соображения о биосинтезе белка, Усп. совр. биол., XXX, 1 (4), 90, 1950).
В этих опытах вызывает удивление прежде всего то, что субстраты, использованные для синтеза, представляют собой не природные аминокислоты, а анилиды и ацетилированные аминокислоты. Возможность столь легкого синтеза пептидов из подобных соединений объясняется тем, что продукты, образующиеся в результате этой реакции, нерастворимы в воде и удаляются из системы в виде нерастворимых осадков. Поэтому равновесие (1)
![]()
непрерывно смещается в правую сторону, что, согласно закону действующих масс, способствует синтезу.
По аналогии предполагалось, что и в организме животных синтез белка будет протекать лучше, если образующийся белок нерастворим. Это предположение, однако, пришлось отбросить, так как оказалось, что ферментативный синтез пептидов анилина не зависит от их растворимости [19].
Другое предположение для объяснения механизма ферментативного синтеза пептидов из анилидов и ацетилированных аминокислот основано на том, что ни одно из веществ, участвующих в этом синтезе, не может образовывать цвиттерионы. Синтез пептидов из соединений, находящихся в деионизированной форме (реакция 1), требует значительно меньше энергии, чем синтез пептидов из соединений, находящихся в ионизированной форме (реакция 2) [21]:
![]()
Это объясняется тем, что для превращения присутствующих в водных растворах ионизированных аминных и карбоксильных групп аминокислот в неионизированные формы (СООН и NH2) требуется некоторое количество энергии.
При написании реакций (1) и (2) исходят из предположения, что синтез белка является процессом, обратным ферментативному гидролизу белков. Однако справедливость этого предположения никогда не была доказана достаточно убедительно. Очень возможно, что пути белкового синтеза и белкового распада различны.
В последние годы было высказано несколько предположений о возможных путях белкового синтеза. Один из таких путей состоит в сопряжении белкового синтеза с окислением некоторых органических веществ. Так, например, было показано, что если к гомогенату печени добавить n-аминогиппуровую кислоту и глицин, то образуется соответствующий дипептид. Синтез этого пептида связан со структурными гранулами гомогенатов печени и тормозится ионами кальция [22]. Подобным же образом в печеночных гомогенатах образуется гиппуровая кислота из бензойной кислоты и глицина; необходимая для этой эндергонической реакции энергия доставляется в результате распада аденозинтрифосфорной кислоты [23]. Возможно, что при этих реакциях в качестве промежуточного продукта образуются фоcфорилированные аминокислоты [24, 25]. В пользу этого говорит то, что в фосфатном растворе при pH 4,7 и температуре 37° из глицина и дибензоилфосфата происходит спонтанное образование гиппуровой кислоты [26]. В этом случае для образования гиппуровой кислоты не требуется никакого фермента и необходимая для синтеза энергия освобождается, по всей вероятности, при разрыве ангидридной связи между фосфорной и бензойной кислотами. Весьма вероятно, что описанная выше реакция является следствием активации аминокислот, происходящей при фосфорилировании, хотя убедительных доказательств для этой теории еще не получено.
Согласно другой гипотезе, активация аминокислот может быть следствием их ацетилирования [27] или восстановления до аминоальдегидов; известно, что при конденсации аминоальдегидов с образованием пептидных цепей освобождается энергия [28].