Химия и биология белков - Ф. Гауровитц 1953
Величина и форма белковых молекул
Осмотическое давление белков
Осмотическое давление определяют в осмометре, который состоит в основном из полупроницаемой мембраны, содержащей белковый раствор, и капилляра, служащего манометром (фиг. 4). Если полупроницаемую мембрану, заполненную белковым раствором, опустить в воду, то вода начнет перемещаться в белковый раствор и уровень в капилляре будет подыматься до тех пор, пока гидростатическое давление р не станет равным осмотическому давлению белкового раствора. Осмотическое давление приближенно пропорционально молярной концентрации белка С и абсолютной температуре Т или, в математическом выражении, р = КСТ, где К — постоянная.
Вант-Гофф нашел, что К тождественна газовой постоянной R, величина которой составляет 0,08207 л ∙ атм/г рад. Молярная концентрация С равна с/М, где с — концентрация в граммах на 1 л и М — молекулярный вес белка. Подставляя эти значения в приведенное выше уравнение, получаем p = RTc/M и M = RTc/p, т. е. известное уравнение Вант-Гоффа для осмотического давления. Оно тождественно уравнению Гей-Люссака для газов.
Осмотическое давление равно, очевидно, тому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии в той же молекулярной концентрации, что и в растворе. Ранее, действительно, осмотическое давление рассматривалось как следствие ударов частиц растворенного вещества о стенки мембраны.
Точные измерения осмотического давления белков показали, однако, что пропорциональность между давлением и концентрацией наблюдается только в очень разведенных растворах, концентрация которых лежит ниже некоторого предела [3, 5]. Отклонение от идеального поведения учитывается следующим уравнением:
М = RTc/(p — Кс2),
где К — постоянная для изучаемой системы [6]. Если К заменить выражением BRT и графически изобразить зависимость р/с от с, то тангенс угла наклона прямой даст множитель В, а отрезок, отсекаемый на оси ординат, будет пропорционален 1/М [7, 8]. При очень низких концентрациях растворенного вещества величина с2 становится настолько мала, что членом Кс2 можно пренебречь. В этом случае молекулярный вес может быть определен путем нанесения на график осмотического давления р в зависимости от концентрации с и экстраполяции кривой до с = 0; отрезок, отсекаемый на оси ординат, рассматривают как осмотическое давление идеального раствора и используют для расчета М, согласно закону Вант-Гоффа.
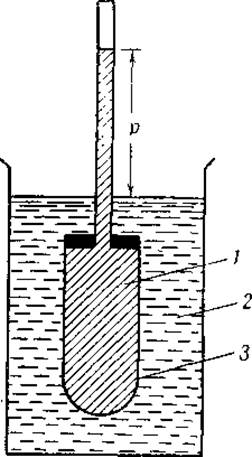
Фиг. 4. Осмометр. 1 — раствор; 2 — растворитель; 3 — мембрана.
Постоянная К в приведенном выше уравнении вносит поправку на тот объем, который занимают сами белковые молекулы. Отклонение от поведения идеального раствора особенно велико в растворах, содержащих нитевидные молекулы, поскольку они затрудняют движение молекул растворителя [9]. Ясно, что осмотическое давление не может возникать просто из соударений белковых молекул с мембраной.
Ближе отвечает действительности представление, согласно которому [10] осмотическое давление определяется разницей в активности молекул воды по обе стороны мембраны. В то время как вода, в которую погружен осмометр, обладает полной активностью свободной воды, активность воды с внутренней стороны мембраны снижена гидратацией белка, а также иммобилизирующим действием нитевидных белковых молекул. С термодинамической точки зрения ток воды в направлении белкового раствора можно рассматривать как результат стремления энтропии к возрастанию. При высоком гидростатическом давлении межмолекулярные расстояния и энтропия уменьшаются [6].
На осмотическое давление белковых растворов оказывает влияние pH раствора, поскольку число анионных или катионных групп в белковой молекуле зависит от pH. В кислых растворах белки находятся в виде катионов, в щелочных — в виде анионов, в связи с чем для уравновешивания заряда белковых ионов необходимо проникновение через мембрану некоторого количества диализующихся анионов или катионов. Это ведет к неравномерному распределению способных к диализу ионов с внешней и внутренней стороны мембраны (эффект Доннана). Осмотическое давление кислого или щелочного раствора белков поэтому выше, чем осмотическое давление изоэлектрических растворов. Так, например, было установлено, что осмотическое давление 1,2-процентного раствора гемоглобина при pH 5,4; 6,5; 7,2 и 10,2 равно соответственно 13,4; 3,2; 5,0 и 21,4 мм рт. ст. [4]. Следовательно, величина осмотического давления минимальна вблизи изоэлектрической точки гемоглобина (pH 6,9).
Хотя оборудование, требующееся для осмометрии, весьма несложно (фиг, 4), точные определения очень затруднительны. Чтобы избежать бактериального разложения белка, определения следует проводить при низких температурах и в течение коротких промежутков времени. Для ускорения достижения равновесия часто применяют в качестве манометра капиллярную трубку. При этом капиллярных явлений [11] можно избежать, заменяя воду в капилляре толуолом. С целью уменьшить эффект Доннана и исключить ошибки, вызванные следами солей, присутствующих в белковых растворах, в качестве растворителя используют концентрированный солевой раствор; в него же погружают и мембрану осмометра. Измерение мембранных потенциалов позволяет рассчитать ту часть давления р, которая обусловлена различиями в активности ионов.
Найденный таким путем молекулярный вес яичного альбумина оказался равным 45 000 [12—14], сывороточного альбумина — 69 000 [15] и гемоглобина — 72 000 [16]. Эти значения хорошо совпадают с данными, полученными другими методами.
При определении в смесях белков [17] были, однако, получены более низкие значения р, что говорит, повидимому, об образовании в таких смесях белковых комплексов.
Поскольку белки легче растворяются в концентрированных растворах мочевины, чем в воде, 6,66 М раствор мочевины часто используется как растворитель при определении молекулярного веса белков [5]. Оказалось, однако, что молекулярные веса амандина и эксцельсина в растворе мочевины равны 30 300 и 35 700, тогда как в нативных водных растворах они составляют соответственно 206 000 и 214 000 [18]. Правда, молекулярные веса яичного альбумина, сывороточного альбумина, глиадина и некоторых других белков в воде и в растворе мочевины одинаковы [19]. Многие другие белки после денатурации мочевиной и подобными агентами подвергаются агрегации [19].
Осмометрические определения молекулярных весов соединений, имеющих молекулярный вес ниже 150 000, более точны, чем определения при помощи других методов, так как их результаты менее зависят от формы и гидратации белковых молекул. Осмометрические определения, однако, не дают возможности судить, является ли белок в испытуемом растворе гомогенным или же он представляет собой смесь белков различных молекулярных весов. Если раствор содержит более одного вида белка, то молекулярный вес, рассчитанный из осмотического давления, является средней величиной, равной сумме молекулярных весов всех белковых молекул, разделенной на общее число молекул белка.