Химия и биология белков - Ф. Гауровитц 1953
Взаимодействие белков с водой
Белки на поверхностях
Белки являются поверхностно-активными веществами, и концентрация их на поверхности водного раствора выше, чем во всей массе раствора. Диффузия белковых молекул в поверхностный слой совершается медленно и протекает иногда часами [45]; на поверхности белкового раствора образуется упругая мономолекулярная пленка. Наиболее прочные пленки получаются тогда, когда они образуются на поверхности растворов с pH, близким к изоэлектрической точке [46, 47]. Получить белковые пленки можно несколькими методами. Один из них основан на свойстве белковых растворов растекаться по поверхности воды и состоит в том, что из микропипетки на поверхность воды наносят водный раствор белка. При другом методе на поверхность воды наносят небольшое количество сухого белка, который, постепенно растворяясь, образует белковую пленку [48].
Хорошо растворимые белки, такие, как яичный альбумин или гемоглобин, легко образуют поверхностные пленки на воде или на разбавленных солевых растворах. Менее растворимые белки, такие, как миозин, образуют пленки только после кратковременной обработки их трипсином [46]. Желатина совершенно не образует пленок на свободной от солей воде, но может образовывать пленки на поверхности раствора сульфата аммония.
При изучении белковых пленок установлен весьма интересный факт, состоящий в том, что все белки образуют пленки одного типа. Площадь, покрываемая 1 мг белка, равна примерно 0,7—0,85 м3, так как удельный объем белков равен приблизительно 0,75, то объем, занимаемый 1 мг белка, равен 0,75 мм3, а толщина пленки равна отношению объема белка к площади, занимаемой пленкой, т. е. равна приблизительно 9—10 Å [45]1. Эта величина значительно меньше диаметра большинства белковых молекул и даже меньше, чем толщина, пленок, образуемых жирными кислотами. Отсюда следует, что пептидные цепи глобулярных белковых молекул при образовании пленки развертываются и пленка образуется из мономолекулярного слоя, в котором цепи главных валентностей расположены параллельно поверхности раствора.
Боковое давление, развиваемое белковыми пленками, может быть измерено при помощи пленочных весов. Если графически выразить зависимость между площадью, занимаемой пленкой, и давлением пленки, то получаются кривые, подобные той, которая изображена на фиг. 25 [42]. Нижняя часть кривой характеризует поведение пленки в области низкого давления. В этой области белковые молекулы ведут себя подобно двумерному газу. Они могут свободно передвигаться в двух направлениях, параллельно поверхности, передвижение же в третьем направлении — вверх и вниз — невозможно. Боковое давление, развиваемое пленкой, подобно осмотическому давлению и зависит от числа белковых молекул. Если число молекул, образовавших пленку, выразить через я, то получим следующее уравнение:
FA = nRT,
где F — сила (в динах), А — площадь (в квадратных сантиметрах), R — газовая постоянная (8,31 ∙ 107 эрг/град ∙ моль) и Т — абсолютная температура. Если через W обозначить вес всей белковой пленки, а через М — молекулярный вес белка, образующего пленку, то М = W/n [42]. При помощи этого метода были вычислены значения молекулярных весов для нескольких белков. Они оказались равными для ß-лактоглобулина 17 100, для зеина 20 100 и для пепсина 34 400 [49]. Этот метод был также использован для определения молекулярного веса пептидов, образовавшихся из яичного альбумина в результате гидролиза под действием пепсина [50].
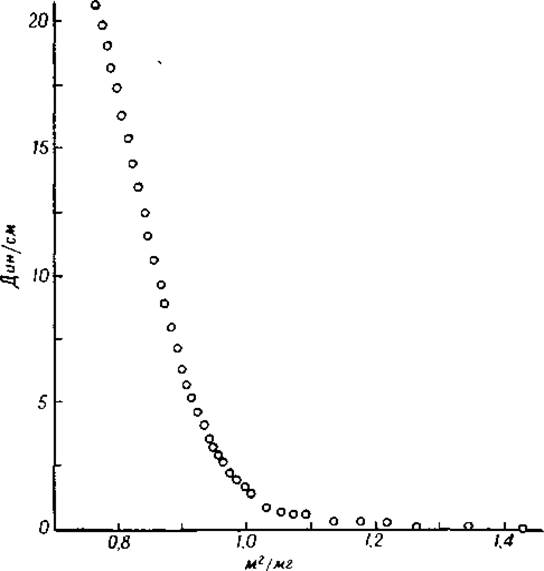
Фиг. 25. Кривая, характеризующая распределение сил в пленке яичного альбумина, образованной на поверхности 35-процентного раствора сернокислого аммония [42].
1 Согласно данным недавно опубликованной работы М. М. Заалишвили (Биохимия, 16, 321, 1951), миоген А образует на поверхности воды пленку толщиной 7,5 Å. Площадь, покрываемая 1 мг этого белка, равна 1 м2. Основная полипептидная цепь лежит на поверхности, а боковые группы образуют по отношению к этой поверхности угол, приближающийся к 90°. — Прим. ред.
Из табл. 9 видно, что площадь, занимаемая пленкой белка при низком давлении, значительно больше, чем площадь, занимаемая тем же количеством белка при высоком давлении [51].
Таблица 9 Площадь белковых пленок, образованных 1 мг белка, м2 [51]
|
Белок |
Область низких давлений при экстраполяции до нулевого давления |
Область высоких давлений в точке разрушения пленки |
|
Яичный альбумин |
1,3 |
0,77 |
|
Инсулин |
1,65 |
0,77 |
|
Сывороточный альбумин |
1,45 |
0,79 |
|
Глиадин |
1,65 |
0,50 |
|
Цитохром с |
1,55 |
0,70 |
Механизм образования белковых пленок изучен очень мало. Вероятно, в молекулах белка, расположенных на поверхности раствора, гидрофильные ионные группы погружены в воду, а неполярные группы, расположенные над слоем цепей главных валентностей, поднимаются над поверхностью воды [41, 52]. Белковые пленки имеют определенную структуру, что может быть показано при помощи индикаторных масел. Индикаторные масла, растекаясь по поверхности пленки, образуют пятна, имеющие форму различных геометрических фигур (например, звездчатые). Эти пятна заметны благодаря радужной окраске, возникающей в связи с интерференцией света в тонких пленках [53].
При вычислении площади, занимаемой пленками, исходят из того предположения, что пленки гомогенны и не имеют разрывов. Если в пленках имеются разрывы или мультимолекулярные участки, то они могут быть обнаружены при рассматривании поверхности пленки в ультрамикроскопе с темным полем [54]. Мультимолекулярные пленки яичного альбумина получаются, если концентрация белкового раствора превышает 0,1% [55]. При нанесении белков на стеараты получаются негомогенные пленки [41].
Если белки смешаны с липидами, то образуются смешанные белково-липидные пленки. Свойства таких смешанных пленок представляют особый интерес с биологической точки зрения, так как подобные пленки могут присутствовать в клетках организма. Было показано, что белково-липидные пленки проницаемы как для веществ, растворимых в воде, так ц для веществ, растворимых в жирах. Проникновение воднорастворимых молекул осуществляется, повидимому, сквозь белковые участки пленки, проникновение жирорастворимых веществ — через участки, образованные липидами. Молекулы, обладающие одновременно теми и другими свойствами, проникают, по всей вероятности, через пограничные участки водно-липидных пленок таким образом, что полярная часть комплексной молекулы направлена в водно-белковую, а неполярная — в липидную фазу [56, 57].
Белки растекаются не только по поверхности водных растворов, но также по поверхности раздела между водой и органическими растворителями. Так, например, было обнаружено, что глиадин и сывороточный альбумин образуют пленки на поверхности раздела вода — бензол [58]. Площадь, занимаемая пленкой яичного альбумина на поверхности раздела вода — бромбензол, больше, чем площадь пленки, образующейся на поверхности раздела вода — воздух [59].
Поверхностное натяжение на поверхности раздела вода — n-ксилол значительно понижается сывороточным альбумином, яичным альбумином или пепсином. Этот эффект особенно четко выражен в растворах глобина [60].
Глобулярные белки претерпевают в монослоях частичную или полную денатурацию, поэтому процесс образования монослоя на поверхности носит необратимый характер. Этот вопрос будет рассмотрен в гл. VII.