Химия и биология белков - Ф. Гауровитц 1953
Нерастворимые белки (склеропротеины)
Кератины
Кератины образуются в клетках, расположенных на поверхности кожи. Они входят в состав волос, шерсти, перьев, рогов, ногтей и копыт. Кератин получается из всех этих тканей после обработки их в размельченном состоянии сначала горячими органическими растворителями, затем водой и, наконец, пепсином и трипсином. Если указанным способом обработать кожу, нервную ткань и некоторые другие органы, то можно получить небольшие количества кератиноподобных веществ, носящих название псевдокератинов. Псевдокератины менее устойчивы к действию протеолитических ферментов, чем истинные, так называемые эвкератины [1]. К группе псевдокератинов относится нейрокератин нервной ткани [2], яичный кератин из куриных яиц [3] и, возможно, коилин — кератиноподобное вещество, находящееся в зобе птиц.
Эвкератины очень богаты цистином. Так, например, кератин человеческих волос и кератин шерсти содержат приблизительно 11—12% цистина (т. е. 3% серы). Остальные эвкератины содержат от 3 до 5% серы, тогда как псевдокератины содержат только 1—3% [4]. Эвкератины и псевдокератины отличаются также по содержанию аминокислот, обладающих основными свойствами. Так, в молекулу эвкератинов гистидин, лизин и аргинин входят в соотношении 1:4:12, тогда как в молекуле псевдокератинов отношение лизина к аргинину равно 1 : 1 [4]. Типичный неприятный запах жженой шерсти, который обусловлен, по всей вероятности, образованием меркаптанов, зависит от наличия в кератине большого количества цистина. При кипячении шерсти в 2-процентном растворе углекислого натрия и при последующем ее гидролизе в кипящей соляной кислоте вместо цистина получается лантионин [5], имеющий формулу СООН ∙ CHNH2∙ СН2∙ S ∙ СН2∙ CHNH2∙ СООН.
С наличием в молекуле кератинов больших количеств цистина связаны, очевидно, и их нерастворимость, и их устойчивость по отношению к действию ферментов. Давно известно, что волос растворяется под действием сульфидов (поэтому сульфиды применяются для удаления шерсти у экспериментальных животных перед хирургическими операциями, а также в косметических целях). Указанное действие сульфидов обусловлено, по всей вероятности, их способностью восстанавливать дисульфидные связи цистина с образованием сульфгидрильных групп. Сходный эффект наблюдается при действии тиогликолевой кислоты или цианидов [6]:
R—S—S—R + HCN → RSH + NCS—R.
Если восстановление проводится в присутствии алкилендибромидов, то алкиленовая группа вклинивается между двумя атомами серы [57]:
R—S—S—R → R—S—СН2—S—R.
Восстановленный кератин, который носит название кератеина, способен расщепляться протеолитическими ферментами [6]. Дисульфидные связи (—S—S—) в кератине можно расщепить также окислителями, например бромом или перекисью водорода. При мягком окислении волос, сохраняя свою первоначальную форму и нерастворимость в воде, приобретает способность перевариваться протеолитическими ферментами [7]. Препараты кератина из волос, перьев, панцыря черепахи и других подобных материалов имеют различный аминокислотный состав. На этом основании следует признать существование целой группы кератинов [8, 9]. До сих пор неизвестно, обладают ли кератины и псевдокератины видовой специфичностью, так как из-за их нерастворимости в воде невозможно провести соответствующие иммунологические исследования.
Устойчивость кератина по отношению к различным растворителям и ферментам понижается не только при обработке кератина упомянутыми химическими реактивами, но также под влиянием механических воздействий. Так, например, тонкорастертая шерсть расщепляется ферментами [10], а порошок рога частично растворяется в воде [11].
Волосы и волокна шерсти обладают значительной эластичностью: при определенных условиях они могут растягиваться и вновь возвращаться к исходной форме. Это свойство волос используется при изготовлении волосяных гигрометров — приборов, служащих для определения влажности воздуха. Рентгеноструктурный анализ нормального и растянутого волоса показал, что растягивание волоса сопровождается изменениями в рентгенограмме. Волокна кератина в нерастянутом и растянутом волосе представляют собой две различные модификации, получившие соответственно название а- и β-кератинов. Длина периодов идентичности вдоль цепей главных валентностей составляет для а-кератина 5,1 Å, для ß-кератина — 3,4 Å [12]. Это дало основание предположить, что в молекуле β-кератина пептидные цепи находятся в растянутом состоянии (схема I), тогда как пептидные цепи а-кератина имеют складчатую форму, образуя правильно чередующиеся петли диаметром 5,1 А (схема II) [55].
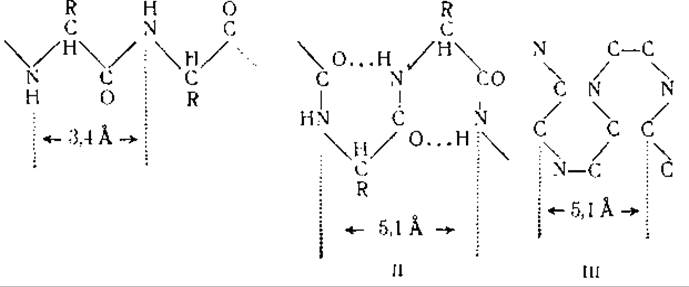
Складывание пептидных цепей а-кератина по типу, изображенному на схеме (III) [12], не согласуется с наличием в молекуле а-кератина длинных боковых аминокислотных цепей (13, 14]. Необходимо учитывать, что характер рентгенограмм кератина может быть обусловлен также и параллельной ориентацией пептидных цепей по отношению к центральной оси, при отсутствии какой бы то ни было ориентации в других направлениях. Это параллельное расположение пептидных цепей удерживается отчасти благодаря дисульфидным связям цистина. Цистин, представляющий собой диаминодикарбоновую кислоту, может образовывать мостики между отдельными параллельными пептидными
цепями:
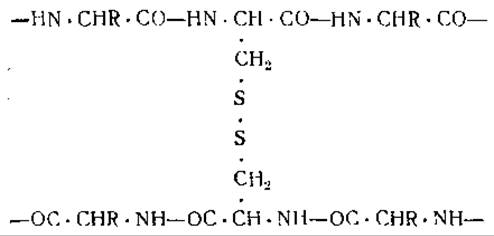
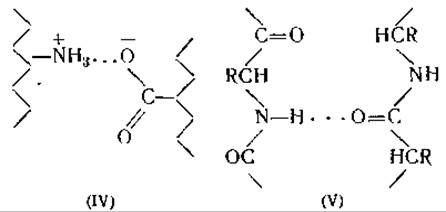
Вода не расщепляет дисульфидных связей при комнатной температуре. Причиной набухания волос и шерсти во влажной атмосфере является, вероятнее всего, разрыв связей между пептидными цепями, образующими кератиновое волокно. При этом могут разрываться либо солеобразные связи (схема IV) между противоположно заряженными боковыми цепями аминокислот [15], либо водородные связи между группами NH и СО внутри пептидной цепи (схема II) или между двумя прилегающими пептидными цепями (схема V) [16].
Увеличение влажного волоса в длину заметно простым глазом, тогда как соответствующее увеличение волоса в диаметре можно определить только при помощи чувствительных измерительных приборов [17].
Помимо способности к набуханию кератиновые волокна обладают еще способностью к сверхсокращению. По всей вероятности, и это явление также обусловлено присутствием в кератине солевых мостиков и водородных связей. Хорошо известно, что шерсть необратимо садится в горячей воде. Причиной такой усадки шерсти является, повидимому, разрыв при повышенной температуре слабых поперечных связей (дисульфидные связи при этом сохраняются). В результате разрыва этих связей пептидные цепи принимают более беспорядочное положение, что сопровождается увеличением энтропии [18]. Нарушение солевых мостиков и водородных связей при растяжении кератинового волокна носит обратимый характер, тогда как разрыв этих связей в горячей воде, приводящий к сжатию (сверхсокращению) волокна, является необратимым процессом (фиг. 38).
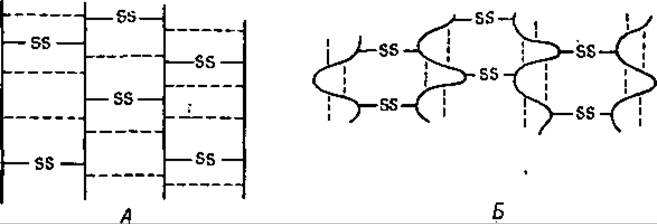
Фиг. 38. Кератиновые волокна.
А — активное состояние; Б — сверхсокращенное состояние. Пунктирные линии обозначают водородные связи.
При растяжении и сверхсокращении кератиновых волокон важную роль играют электровалентные связи между противоположно заряженными группами пептидной цепи. В пользу этого свидетельствуют два наблюдения: 1) влияние на оба эти явления дезаминирования кератина [19, 20] и 2) потеря способности шерсти к усадке после присоединения к ионным группам кислых или основных соединений [21].
Помимо периодов идентичности 5,1 и 3,4 Å, обнаруживаемых при помощи рентгеноструктурного анализа, кератиновые волокна имеют еще правильно повторяющиеся периоды более высокого порядка, примерно 110 Å, которые удается обнаружить при помощи электронной микроскопии [22]. Этот факт дает основание считать, что кератиновые волокна состоят из цепочек глобулярных частиц, каждая из которых занимает вдоль оси волокна 110 Å.
При кипячении в нейтральном растворе додецилбензолсульфоновой кислоты в бисульфите натрия кератин пера растворяется. Осмометрический и седиментационный анализ этих растворов показал, что величина растворенных частиц соответствует молекулярному весу 75 000. Частицы содержат примерно 40% детергента (додецилбензолсульфоновой кислоты) и 60% кератина. Если предположить, что каждая частица содержит только одну молекулу кератина, то молекулярный вес растворимых частиц кератина будет близок к 40 000 [23]. Попытки определить природу концевых аминокислот в этих частицах при помощи блокирования свободных аминогрупп динитрофторбензолом (см. стр. 124) привели к неожиданным результатам. Было обнаружено, что с динитрофторбензолом реагируют семь различных аминокислот [24]. При этом были получены следующие молекулярные соотношения динитрофтораминокислот: 18 молекул глицина, 8 — треонина, 4 — валина, 2 — аланина, 2 — серина, 2 — глутаминовой кислоты и 1 — аспарагиновой кислоты. На этом основании пришли к заключению, что минимальный молекулярный вес кератина равен 2 000 000 и что молекула кератина состоит из 37 цепей, каждая со средним молекулярным весом 55 000 [24].