Химия и биология белков - Ф. Гауровитц 1953
Нерастворимые белки (склеропротеины)
Коллаген и желатина
Коллаген представляет собой структурный белок соединительной ткани. Он образует основную часть сухожилий, связок, фасций и некоторых других сходных тканей и входит в состав костей, хряща и кожи1. Нативный коллаген лишь в слабой степени способен подвергаться воздействию разведенных кислот, щелочей и протеолитических ферментов. Поэтому при обработке соответствующих тканей этими гидролизующими агентами можно удалить из тканей все белки кроме коллагена и таким образом выделить коллаген. Продолжительное действие кислот, щелочей и ферментов вызывает, однако, необратимое изменение коллагена. Процесс изготовления кожи и состоит в очистке и дублении содержащегося в шкуре животного коллагена. Дубление коллагена достигается действием осаждающих веществ, например дубильной кислоты и солей тяжелых металлов. Низкие значения pH благоприятны для процесса дубления; при высоких значениях pH некоторая часть дубителя удаляется из шкуры животного [33].
1 В примечании к стр. 16 уже указывалось, что В. Н. Ореховичем и его сотрудниками был выделен из соединительной ткани различных видов животных новый тип белков, которые получили название проколлагенов. По своему аминокислотному составу проколлагены отличаются от коллагена главным образом содержанием тирозина, фенилаланина, гистидина, пролина и оксипролина. В то время как в проколлагенах тирозин полностью отсутствует, его содержание в коллагене достигает 1,4%. Содержание фенилаланина в проколлагенах приблизительно вдвое меньше, чем в коллагене, содержание же гистидина в проколлагенах, наоборот, значительно выше. Проколлагены нерастворимы в чистой воде и сравнительно слабо растворимы в подкисленной воде и в кислых буферных растворах с невысокой концентрацией солей. Электрофоретический анализ чистого нативного проколлагена кожи крысы показал гомогенность этого белка. Ультрафиолетовый спектр поглощения раствора проколлагена отличается от спектра коллагена и обнаруживает пять полос поглощения, характерных для фенилалаина. Молекулярный вес проколлагена, выделенного из кожи крыс, по данным С. Б. Бреслера, П. А. Финогенова и С. Я. Френкеля (ДАН СССР, 72, 555, 1950), равняется 70 000 + 3 500. По форме молекулы проколлагена приближаются к цилиндру, высота которого приблизительно в 23 раза больше его диаметра. Определение длины цепей проколлагенов дает основание считать, что молекула про коллагена состоит из шести пептидных цепей. В отличие от коллагена проколлагены сравнительно хорошо расщепляются трипсином. Содержание проколлагена в коже морских свинок в возрасте от 10 дней до 5—6 месяцев колеблется от 7,0 до 10,5%; у более старых свинок содержание проколлагена в коже резко уменьшается и падает до 1%. Резко уменьшено содержание проколлагена и в коже скорбутных морских свинок.
Изучение скорости образования проколлагенов при помощи изотопов (С14) показало, что образование проколлагенов происходит значительно быстрее образования коллагена. Сопоставляя эти данные с данными о содержании проколлагена в коже молодых и старых животных, а также с данными об изменениях в содержании проколлагенов и коллагена при скорбуте и голодании, авторы приходят к заключению, что проколлагены являются биологическими предшественниками коллагена в организме животных. Удалось также обнаружить в коже различных животных белковые фракции, которые по своим свойствам являются промежуточными между проколлагенами и коллагенами. Основные данные относительно свойств проколлагенов приведены авторами в следующих статьях: К. Д. Орехович, ДАН СССР, 71, 521, 1950; В. Н. Орехович, А. А. Тустановский, Бюлл. эксп. биол. и мед., 23, 197, 1947; В. Н. Орехович, А. А. Тустановский, К. Д. Орехович, Н. Е. Плотникова, Биохимия, 13, 55, 1948; В. Н. Орехович, А. А. Тустановский, Н. Е. Плотникова, ДАН СССР, 60, 837, 1948; В. Н. Орехович, А. С. Коникова, К. Д. Орехович, Н. Н. Добберт, ДАН СССР, 71, 105, 1950; Н. Е. Плотникова, Вопросы мед. химии, 1, 82, 1949; А. А. Тустановский, там же, 1, 159, 1949; М. П. Черников, ДАН СССР, 67, 345, 1949. — Прим. ред.
По своему аминокислотному составу коллаген сильно отличается от кератина и фиброина. Молекула коллагена не содержит ни цистина и цистеина, ни триптофана, а тирозин и метионин содержит лишь в очень небольших количествах. Коллаген необычайно богат глицином, пролином и оксипролином. Следует отметить, что глицин выделен из коллагена еще в 1820 г. Браконо [35]. Состав коллагена, выделенного из бычьей шкуры, можно выразить следующей формулой: гли136, ала41, лей-изолей17, вал11, фен10, тир3, сер13, тре8, мет2, про51, оксипро41, лиз12, оксили33, арг20, гис2, асп19, глу30, аммиак18 [36]. Вычисленный минимальный молекулярный вес коллагена равен 39 000.
При нагревании коллагена с водой (63—64°) происходит необратимое сверхсокращение коллагена до 1/3 его первоначальной длины. Усадка кожи в горячей воде указывает на то, что и дубленый коллаген также подвергается сверхсокращению. Если нагревание коллагена в воде производится в течение долгого времени, коллаген в конце концов растворяется и необратимо превращается в водорастворимое вещество — желатину. Растворы желатины имеют очень высокую вязкость. При концентрации 2—3% и выше они образуют при комнатной температуре твердые гели. Образование геля зависит не только от концентрации желатины, но также от природы и от концентрации присутствующих в растворе солей и от pH раствора [37]. Те же самые факторы влияют и на набухание желатиновых гелей в воде [38].
Рентгеноструктурный анализ коллагена показал, что его структура отличается от структуры кератина или фиброина. Короткие промежутки вдоль оси коллагенового волокна соответствуют периодам идентичности в 2,86 Å [12, 39]. Ввиду того что эта величина меньше протяженности одного аминокислотного остатка в полностью растянутой пептидной цепи [3,4 А], следует предположить, что у коллагена пептидная цепь имеет другую форму. Было высказано предположение, что наличие в коллагене многочисленных остатков пролина и оксипролина [40] делает невозможным существование растянутой транс-конфигурации пептидной цепи.
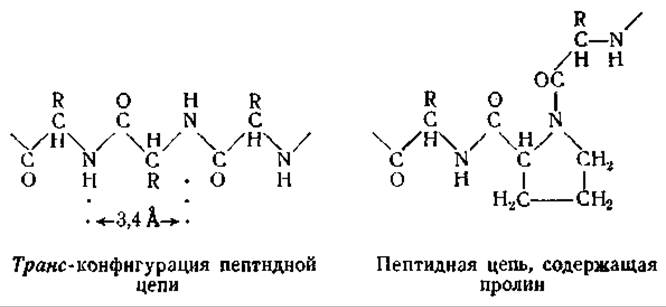
Коллаген состоит главным образом из нитевидных частиц. Об этом свидетельствует двойное лучепреломление коллагеновых волокон в поляризованном свете. Положительный характер двойного лучепреломления указывает, что анизотропными частицами являются субмикроскопические палочки, ориентированные параллельно длинной оси волокна [41]. Волокна коллагена не могут растягиваться подобно кератиновым волокнам. Полагают, что его пептидные цепи вытянуты до максимальной длины. При сверхсокращении рентгенограмма коллагена резко изменяется. На основании этого предполагают, что при сверхсокращении происходит поперечное складывание продольно ориентированных пептидных цепей [40].
Одно время считалось, что процесс превращения коллагена в желатину связан с легким гидролизом пептидных связей, а обратный процесс — с конденсацией аминных и карбоксильных групп. Известно, однако, что коллаген плохо растворим в горячей воде и что его растворимость повышается при обработке м-крезолом, формамидом или молочной кислотой [42]. Эти данные дают основание предположить, что структура нативного коллагена поддерживается при помощи солевых мостиков и водородных связей (см. гл. VII). При разрыве некоторых из этих связей коллагеновые волокна переходят в сверхсокращенное состояние. Разрыв же всех поперечных связей приводит к полному растворению коллагена, т. е. к переходу его в желатину [42].
Образование желатиновых гелей происходит вследствие взаимного переплетения нитевидных молекул. Действующие при этом силы настолько слабы, что нагревание до 45—50° вновь вызывает растворение гелей. Если к желатине добавить формальдегид, то между аминогруппами смежных молекул образуются мостики —СН2—, которые не разрываются при добавлении воды или при осторожном нагревании. Вследствие этого гели формализованной желатины в противоположность необработанной желатине набухают только до определенной степени [43, 44].

Фиг. 89. Электронная микрограмма коллагенового волокна. Волокна приготовлены из свежей кожи взрослой крысы, для чего кожа была подвергнута обработке трипсином. Тонкие нити на заднем фоне образованы эластическими волокнами. Увеличение 16 400. При получении микрограммы волокна оттеняли хромом.
Рентгеноструктурный анализ коллагена под малым углом обнаруживает большие, правильно повторяющиеся промежутки, равные приблизительно 640 Å и расположенные в направлении длинных осей волокон [45, 46]. Если относительная влажность воздуха повышается до 100%, то на рентгенограммах эти промежутки увеличиваются до 672 Å [49]. Аналогичная периодичность была обнаружена также при помощи электронного микроскопа [47]. Согласно данным электронной микроскопии, коллагеновые волокна имеют поперечную исчерченность [48]. Расстояние между полосами у различных препаратов коллагена варьирует от 522 до 902 Å. Эти вариации зависят до некоторой степени от содержания воды в коллагене [49].
Было высказано много предположений по вопросу о том, как толковать большие периоды идентичности в коллагеновом волокне. По мнению различных авторов, эта периодичность может быть обусловлена: 1) правильным чередованием аминокислотных остатков вдоль длинной пептидной цепи [40]; 2) правильным чередованием петель вдоль длинной оси волокна [47]; 3) линейной агрегацией глобулярных белковых частиц [50]. В настоящее время, однако, еще невозможно окончательно установить, какое из этих предположений ближе всего соответствует действительному положению вещей.