Химия и биология белков - Ф. Гауровитц 1953
Сложные белки
Глюкопротеиды (мукопротеиды)
Термины глюкопротеиды и мукопротеиды употребляются для обозначения группы сложных белков, в состав которых входят глюкоза или другие сахара и производные сахаров. Группа глюкопротеидов включает соединения, имеющие различный состав и свойства. По свойствам углеводного компонента эта группа разделена на две подгруппы: 1) нейтральные глюкопротеиды и 2) кислые глюкопротеиды [39]. Первая из этих подгрупп включает глюкопротеиды, в состав которых входят нейтральные углеводы, построенные из моносахаридов или аминосахаров. Вторая подгруппа включает глюкопротеиды, углеводный компонент которых содержит гексуроновые кислоты или же эфиры сахаров с серной кислотой. Следует, однако, всегда помнить, что углеводный компонент большинства глюкопротеидов представляет собой смесь кислых и нейтральных углеводов и что поэтому приведенная классификация не может считаться достаточна удовлетворительной. В основу другой классификации положено количественное содержание углеводов в глюкопротеидах. Соединения, содержащие более 4% углеводов, получили название мукоидов или мукопротеидов, соединения же, содержащие менее 4% углеводов, были названы глюкопротеидами [38].
До настоящего времени ни один из глюкопротеидов не получен в чистом кристаллическом виде. Некоторые «глюкопротеиды», вероятно, представляют собой смесь различных соединений, другие же образуются из белков и углеводов в процессе их выделения, и их следует считать артефактами. Устойчивость глюкопротеидов по отношению к действию денатурирующих агентов часто используют для отделения их от белков. При этом белки осаждают путем нагревания растворов, а затем из фильтрата осаждают глюкопротеиды путем высаливания или при подкислении.
До недавнего времени имелись некоторые сомнения относительно того, содержат ли глюкопротеиды незначительное количество больших молекул полисахаридов, соединенных с молекулами белка, или же большое количество мелких молекул сахаров, связанных с различными группами белка. В настоящее время считают, что простетические группы типичных глюкопротеидов состоят из полисахаридов. Белки могут соединяться с полисахаридами in vitro, образуя более или менее стойкие симплексы [40]. Наиболее выраженной способностью образовывать соединения с полисахаридами обладают тирозин и аргинин [40]. На этом основании было высказано предположение, что в молекуле глюкопротеидов полисахариды присоединены именно к этим аминокислотам. В кислых глюкопротеидах соединение между полисахаридными кислотами и белком осуществляется, вероятно, путем образования солеобразных связей между кислыми группами полисахаридов и щелочными группами белков [41]. Кроме этих солеобразных связей, возможно также и наличие дипольных связей между белком и простетической группой.
Хрящевая ткань состоит главным образом из коллагена и хондроитинсерной кислоты. Хондроитинсерная кислота представляет собой полисахарид, содержащий эквивалентные количества глюкуроновой кислоты и эфира ацетилхондрозаминсерной кислоты [42]. Эфир хондроитинсерной кислоты, приготовленный из хряща, представляет собой полисахарид, который при растворении обусловливает высокую вязкость растворов и обнаруживает двойное лучепреломление в потоке [43]. Его молекулярный вес равен приблизительно 260 000, а длина цепи молекулы достигает 4 700 А [43]. До сих пор окончательно не выяснено, являются ли цепи этого полисахарида прямыми [44] или разветвленными [45]. Хондроитинсерная кислота соединяется с белком при pH 4,85, т. е. ниже изоэлектрической точки белка [46].
Основную массу белка хрящей составляет коллаген, нерастворимый фибриллярный склеропротеин (см. гл. IX), построенный из длинных пептидных цепей. Поливалентные анионы хондроитинсерной кислоты соединяются, повидимому, с щелочными группами белковых нитей, образуя сетку из фибриллярных анионов полисахарида и катионов белка [46]. При кипячении хряща в воде коллаген превращается в водорастворимую желатину, которая, соединяясь с хондроитинсерной кислотой, образует так называемый хондромукоид. Это соединение, очевидно, представляет собой продукт распада нативного коллагена [46]. Поскольку коллаген при обычном значении pH тканей организма содержит избыток отрицательных групп, весьма вероятно, что не только солеобразные связи, но и вандерваальсовские силы участвуют в образовании соединения между коллагеном и хондроитинсерной кислотой [46]. Коллаген, как и хондроитинсерная кислота, кроме хрящей, находится также в коже и костях, которые, вероятно, содержат тот же глюкопротеид, что и хрящи. До сих пор окончательно не разрешен вопрос, принадлежит ли амилоид к категории глюкопротеидов, содержащих хондроитинсерную кислоту. Амилоид образуется в печени и других органах при хронических воспалительных процессах. При реакции с иодом он дает пурпурную окраску. Название «амилоид» дано этому веществу в связи с его сходством с крахмалом. В состав амилоида входят эфиры серной кислоты [47].
Муцины представляют собой глюкопротеиды слюны, желудочного и кишечного сока и ряда других секретов. Муцины, повидимому, состоят из длинных нитевидных молекул. При растворении они дают очень вязкие растворы. Муцины принадлежат к группе кислых глюкопротеидов и содержат гексуроновую кислоту, вероятнее всего, глюкуроновую (СООН ∙ СНОН ∙ СНОН ∙ СНОН ∙ СНОН ∙ СОН) [39]. В муцине из подчелюстной слюнной железы была обнаружена глюконовая кислота (СН2ОН ∙ СНОН ∙ СНОН ∙ СНОН ∙ СНОН ∙ СООН) [38]. Кроме гексуроновых кислот, муцины содержат 5—8% маннозы и 5—8% ацетилирован- ного глюкозамина [48] или хондрозамина [49]. Поскольку муцины содержат лишь следы серной кислоты, в их состав не может входить сколько-нибудь значительное количество мукоитинсерной кислоты, как это предполагалось ранее [48].
Вследствие наличия в их составе гексуроновой или гексоновой кислот, муцины являются кислыми соединениями, изоэлектрическая точка которых лежит между pH 3 и 5 [50]. Муцины осаждаются из слюны и других секретов уксусной кислотой и вновь растворяются при прибавлении щелочей.
Глюкопротеиды, извлекаемые из различных органов водой или солевыми растворами, получили название мукоидов. Большое количество мукоидов было найдено в кистах, в особенности в кистах яичника. Мукоиды входят также в состав стекловидного тела глаза. Различные мукоиды содержат разные углеводы. Мукоид стекловидного тела глаза содержит ацетилглюкозамин и глюкуроновую кислоту; мукоид же роговицы содержит мукоитинсерную кислоту. Эта последняя кислота представляет собой эфир гиалуроновой кислоты с серной [51]. В мукоидах, выделенных из сухожилий, была найдена хондроитинсерная кислота [52]. Возможно, однак о, что этот мукоид образуется вторично и является продуктом распада коллагена, сами же сухожилия содержат только коллаген и хондроитинсерную кислоту. Мукоиды, выделенные из мочи, содержат глюкозамин и галактозу [53].
Гиалуроновая кислота, входящая в состав мукоида стекловидного тела, представляет собой полисахарид, содержащий эквивалентные количества N-ацетилглюкозамина и глюкуроновой кислоты [54]. Этот полисахарид был выделен также из пупочного канатика и из синовиальных оболочек [43]. Его молекулярный вес равен приблизительно 200 000, а длина цепи его молекулы колеблется от 4 800 до 10 000 Å [43]. Роль гиалуроновой кислоты, обладающей большой вязкостью, состоит в том, чтобы удерживать клетки в определенном положении, заполняя промежутки между ними как своего рода цемент [55]. С белками соответствующих тканей гиалуроновая кислота связана, вероятно, таким же образом, как хондроитинсерная кислота — с белками хрящей и костей. Гиалуроновая кислота обусловливает желатинообразную структуру стекловидного тела и пупочного канатика.
Овомукоид — глюкопротеид, выделенный из белка яиц, — изучен весьма тщательно. При коагуляции яичных белков в результате нагревания овомукоид остается в фильтрате; из этого фильтрата он может быть осажден прибавлением этилового спирта. Углеводный компонент этого протеида, составляющий 20% всего соединения [56, 57], содержит 3 молекулы маннозы, 7 молекул ацетилглюкозамина и 1 молекулу галактозы. Таким образом, в состав этого углевода входят 11 остатков моносахаридов, и его структура, вероятно, соответствует следующей формуле [56];
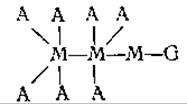
где А—N-ацетилглкжозамин, М — маннопираноза и G — галактозопираноза [56].
Углевод связан с белком, повидимому, эфирной связью, образующейся между гидроксильной группой адетилглюкозамина и карбоксильной группой белка. В яйце овомукоид образует комплексы с другими белками [58].
Глюкопротеиды были обнаружены также в сыворотке крови. Для выделения их поступают следующим образом. Сначала удаляют глобулины высаливанием равным объемом насыщенного сернокислого аммония, а затем из фильтрата осаждают смесь альбуминов и глюкопротеидов подкислением фильтрата до pH 4,7 — изоэлектрической точки альбуминов. Осадок растворяют в воде и высаливают глобогликоид равным объемом насыщенного раствора сернокислого аммония при pH 7,6 [59]. Выпавший белок не содержит углеводов и по своим свойствам очень похож на сывороточный альбумин [60]. Оставшийся в растворе сывороточный альбумин подвергают коагуляции путем нагревания. Из фильтрата затем можно выделить два глюкопротеида: серогликоид и серомукоид. Серогликоид, содержащий галактозу, маннозу и глюкозамин, не является однородным белком, так как его можно разделить на ряд фракций при обработке концентрированными растворами буферов [61]. Второй глюкопротеид — серомукоид — содержит 10,7% углевода, состоящего из N-ацетилглюкозамина, d-галактозы и d-маннозы. Отношение этих составных частей равно 1:1:1 [60]. Сыворотка лошади содержит 0,5% глобогликоида и приблизительно такое же количество серогликоида и серомукоида [59]. Если сыворотку крови фракционировать этиловым спиртом, то глюкопротеиды попадают во фракцию IV (см. гл. VIII). В этой фракции находится также а2-глобулин, содержащий значительное количество углеводов и два других сложных белка: гликопротеин и мукопротеин [62].
К глюкопротеидам принадлежит и гонадотропный гормон, найденный в моче беременных женщин. Он содержит 18% углевода (см. гл. XIII).
Белки, входящие в состав веществ, определяющих специфические групповые свойства эритроцитов крови, также содержат углеводы. Уже давно установлено, что эритроциты могут быть разделены на четыре основные группы, обозначаемые как группы А, В, AB и 0. Вещества определяющие групповые свойства эритроцитов, обозначаются соответственно как А, В и 0. Красные кровяные тельца, содержащие эти вещества, агглютинируются сывороткой, принадлежащей к другим группам, так как в этой сыворотке содержатся специфические агглютинины. Вещества, определяющие групповую специфичность красных кровяных телец, представляют собой глюкопротеиды или глюкополипептиды, в состав которых наряду с аминокислотами входит и большое количество углеводов [70]. Красные кровяные тельца содержат лишь небольшие количества этих веществ. В большей концентрации весьма сходные соединения были обнаружены в слюне, в продажных препаратах пептона, в различных препаратах пепсина и в желудке свиней [63—66]. Вещество А, выделенное из различных тканей, очень близко, но не идентично веществу А красных кровяных телец. Оба эти вещества содержат 40—70% углеводов, состоящих из d-галактозы, d-маннозы, d-глюкозамина и d-фукозы [65]. Этот углевод представляет собой полимерное соединение, концевые группы которого образованы фукозой [67]. В веществе А, выделенном из желудка свиньи, азот глюкозамина составляет 39%, а азот аминокислот — 27,1% общего азота. При гидролизе этого вещества было получено 1,6% глицина, 0,7% валина, 0,3% изолейцина, 3,3% пролина, 1,9% гистидина, 0,3% тирозина, 0,1% фенилаланина, 0,2% триптофана и небольшие количества других аминокислот [68].
Вещества В и 0 очень похожи на вещество А. Все три вещества, выделенные из слюны и из содержимого кист яичника [69], содержат 5,3—5,7% общего азота, 2,3—2,9% азота аминокислот и 1,7—1,8% азота гексозамина. Они дают реакцию Сакагуши на аргинин, диазореакцию и биуретовую реакцию. Ни одно из этих веществ не содержит серы [63]. Природа других азотсодержащих веществ, входящих в состав соединений, определяющих групповые свойства крови, еще не установлена. Неизвестно также, каким образом углевод соединяется с белком или полипептидом. Все указанные вещества в нативном состоянии являются очень вязкими и при pH 8,5 образуют гели. Под действием едкого или углекислого натрия они теряют свою вязкость [70], вероятно, вследствие денатурации или расщепления белка. При нагревании все эти вещества инактивируются [67].
До сих пор еще неясно, содержит ли кутикула насекомых истинный глюкопротеид или же она состоит из двух проникающих друг в друга слоев: белка и углевода (хитина) [71].