Химия и биология белков - Ф. Гауровитц 1953
Методы выделения, очистки и определения белков
Количественное определение белков
Полученные тем или иным способом осадки (см. предыдущий раздел) могут служить для количественного определения содержания в них белков по Кьельдалю. При использовании этого метода предполагают, что осадок содержит только белковый азот. Однако это предположение не совсем справедливо, потому что вместе с белками осаждаются и другие высокомолекулярные соединения, такие, как полисахаридные кислоты (например, хондроитинсерная кислота) и некоторые азотсодержащие липиды (например, лецитины или кефалины). Метод Кьельдаля основан на переводе имеющегося в навеске белкового азота в сульфат аммония путем кипячения белка с концентрированной серной кислотой и сульфатом калия в присутствии катализатора. Обычно принимается, что содержание азота во всех белках равно 16%. В действительности эта величина значительно варьирует. Например, яичный альбумин содержит 15,75% азота, в то время как эдестин содержит 18,7% [34]. Отсюда ясно, что необходимо знать точно содержание азота в исследуемом белке. Хотя метод Кьельдаля представляет собой один из стандартных методов, употребляемых в биохимических лабораториях, получаемые по этому методу результаты часто слишком занижены. Наиболее точные данные получаются при использовании в качестве катализатора ртути [35, 36]. Нагревание белка с серной кислотой и сульфатом калия в присутствии катализатора должно продолжаться в течение 8 час. [34]. При соблюдении этих условий были получены точные данные для ряда белков, содержание азота в которых было известно.
Интересно, что при некоторых патологических состояниях организма в его тканях можно обнаружить белки с содержанием азота, значительно отклоняющимся от нормы. Так, например, было обнаружено, что у больных, страдающих отеками на почве голода, белки сыворотки содержат меньше азота, чем в норме [37]
Метод Кьельдаля в его первоначальном виде несколько сложен из-за необходимости вести отгонку образующегося аммиака. Было предложено несколько модификаций этого метода, в которых отгонка аммиака устранена. Так, например, было предложено окислять образовавшийся в результате сжигания сульфат аммония гипобромитом (NaOBr) и избыток гипобромита оттитровывать иодометрически [38]. Содержание аммиака можно определить также колориметрически при помощи реактива Несслера. Конвей предложил вести отгонку аммиака при комнатной температуре в закрытых чашках (фиг. 1), состоящих из двух круглых отделений, входящих одно в другое [39, 40]. Несмотря на все эти упрощения, метод Кьельдаля остается довольно трудоемким. В литературе описаны попытки заменить метод Кьельдаля нефелометрическим или колориметрическим способом определения белков. Нефелометрические методы определения белков дают, однако, только приблизительные величины, так как мутность, образуемая осаждающими агентами, частично зависит от концентрации солей и других примесей. Лучшие результаты получаются при колориметрическом определении белка по биуретовой реакции [41—43].
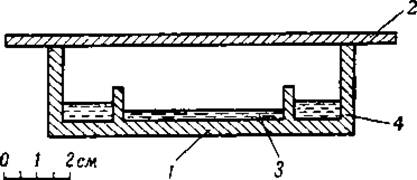
Фиг. 1. Поперечный разрез чашки Конвея [39].
1 — внешний сосуд; 2 — стеклянная крышка; 3 — внутренний сосуд, содержащий кислоту; 4 — раствор солей аммония, к которому прибавляется поташ. Диаметр чашки 70 см.
1 Уменьшение содержания азота в белках сыворотки в указанных случаях обусловлено не появлением в сыворотке белков, содержащих меньше азота, а изменением соотношения в ней различных белков. В многочисленных исследованиях было показано, что при голодании, сопровождающемся появлением отеков, особенно резко падает содержание альбуминов. Количество же различных глобулинов уменьшается не столь сильно, а иногда даже остается неизменным. Поскольку содержание азота в отдельных белках сыворотки неодинаково, изменение в количественных соотношениях этих белков должно вести и к соответствующим изменениям в содержании азота в суммарных белках сыворотки. До сих пор, однако, нет никаких доказательств того, что при голодании или при каких-либо других патологических состояниях меняется содержание азота в индивидуальных чистых белках. Все данные по этому вопросу, полученные Шенком, Лангом, Дирром и другими авторами, при последующей проверке оказались ошибочными, обусловленными неточностью методов определения в исследованиях указанных авторов. — Прим. ред.
Ввиду того что удельный вес кровяной сыворотки в значительной степени зависит от концентрации в ней белков, последнюю можно определить при помощи измерения удельного веса сыворотки в пробирках, содержащих смесь бромбензола и керосина [44]. В качестве стандартного раствора используются растворы сульфата калия различной плотности или растворы сульфата меди. Однако ни один из этих методов не свободен от ошибок, обусловленных частичной зависимостью удельного веса сыворотки от содержания в ней веществ небелкового характера [45, 46].
Из этого обсуждения ясно, что количественное определение белков представляет собой довольно сложную процедуру. Большие количества белка можно определить путем прямого взвешивания высушенного осадка, полученного при кипячении растворов белка или при осаждении белка в его изоэлектрической точке. Главная трудность состоит здесь в удалении солей и других растворимых соединений, так как белковые осадки при промывании дестиллированной водой часто дают коллоидные растворы. Иногда этого можно избежать, если промывать белковый осадок разведенной уксусной кислотой или смесью метилового спирта с водой в разведении 1 : 1, а затем ацетоном и эфиром.
Для определения очень маленьких количеств белка можно использовать способность тирозина интенсивно поглощать свет в ультрафиолетовой части спектра при 280 mμ [47] или же способность белков восстанавливать реактив Фолина (фосфорномолибденовую кислоту) с образованием синей окраски [48]. Оба метода очень просты и быстры. Однако нельзя забывать, что интенсивность поглощения в ультрафиолете и синяя окраска с реактивом Фолина зависят от содержания тирозина и других ароматических аминокислот, которое варьирует от белка к белку. Необходимо поэтому стандартизировать анализируемую пробу белка по известному белку.