Химия и биология белков - Ф. Гауровитц 1953
Белки с ферментативными свойствами
Гидролазы
К гидролизам обычно относят три различные группы ферментов: эстеразы, карбогидразы и протеазы. Эстеразы катализируют как гидролиз сложных эфиров, так и обратную реакцию их синтеза:
RCООR + H2О ⇄ RCOOH + HOR.
Карбогидразы катализируют расщепление эфирной связи (ROR) в дисахаридах и полисахаридах. Протеазы катализируют расщепление пептидов RCONHR с образованием RCOOH и H2NR.
Эстеразы, расщепляющие эфиры фосфорной и серной кислот, носят название фосфатаз и сульфатаз; липазами называют эстеразы, расщепляющие нейтральные эфиры. Кристаллическая липаза была выделена из печени [53].
Эфирные связи фосфорной кислоты в нуклеиновых кислотах (см. гл. XI, стр. 259) расщепляются рибонуклеазой и дезоксирибонуклеазой. Рибонуклеаза получена в кристаллическом виде путем фракционирования водного экстракта поджелудочной железы быка сернокислым аммонием при слегка кислой реакции [54]. Фермент сравнительно устойчив к нагреванию [4] и инактивируется лишь при температуре выше 85°; при охлаждении раствора активность фермента, однако, вновь восстанавливается. Термостабильность рибонуклеазы обусловлена, по всей вероятности, очень жесткой структурой ее небольшой молекулы, вес которой равен 12 700 [55]. Кроме рибонуклеазы из поджелудочной железы быка получена также кристаллическая дезоксирибонуклеаза [56].
Карбогидразы. Хотя многие из этих ферментов известны давно, только один из них, а именно амилаза, получен в кристаллическом виде. Амилаза выделена из картофеля [57], ячменя [58], поджелудочной железы и из слюны [59]. Амилаза слюны человека идентична с амилазой поджелудочной железы человека, но отличается от амилазы поджелудочной железы свиньи [59]. Молекулярный вес амилазы 20 000. Уже много лет назад было установлено, что амилаза при диализе теряет свою активность, но вновь восстанавливает ее при добавлении хлористого натрия, который препятствует образованию неактивного комплекса амилаза—муцин [60].
Несмотря на то, что препараты дрожжевой инвертазы многократно исследовались, этот фермент до сих пор не удалось получить в кристаллическом виде. Наиболее чистые препараты получают путем адсорбции на фосфорнокислом кальции. Эти препараты содержат только 5% азота [61].
Из яичного белка, выделений слизистой носа и из хряща был выделен фермент, обладающий способностью гидролизовать полисахаридные кислоты. Он оказался основным белком — лизоцимом. Изоэлектрическая точка этого белка лежит при pH 10,5—11,0, а его молекулярный вес равен 17 000 [62—64]. Лизоцим имеет много общего с гиалуронидазой (фактор распространения), выделенной из семенников, и составляет примерно 3% всех белков яичного белка (см. стр. 194).
Пепсин. Этот фермент получен в кристаллическом виде из слизистой желудка и из продажных препаратов пепсина путем фракционирования сернокислым магнием или этиловым спиртом [65]. Пепсины, выделенные из организма различных животных, обладают видовой специфичностью [66]. Молекулярный вес кристаллического пепсина 33 000—38 000 [65, 67]. Рентгеноструктурный анализ кристаллического пепсина показал, что в нем содержатся отдельные частички, каждая из которых состоит из 12 молекул [68]. Пепсин является белком с резко выраженным кислотным характером; изоэлектрическая точка его лежит при pH < 2,7. В молекуле пепсина содержится мало основных аминокислот и много аспарагиновой и глутаминовой кислот (см. табл. 1). В составе пепсина обнаружены также небольшие количества (вероятно, моль на моль) фосфорной кислоты. Несмотря на способность к кристаллизации, пепсин не является однородным белком, а представляет собой смесь двух или более белков.
Слизистая желудка содержит неактивный предшественник пепсина, получивший название пепсиногена; этот белок также был выделен в кристаллическом виде [69]. Пепсиноген превращается в активный пепсин под действием соляной кислоты, причем в процессе этого превращения от пепсиногена отщепляется 15—20% его азота [69]. Весьма вероятно, что при этом отщепляется полипептид с молекулярным весом 2 500, обладающий свойствами ингибитора пепсина. Пепсин преимущественно расщепляет пептидные связи между аминодикарбоновой кислотой и тирозином; одним из наиболее простых субстратов для действия пепсина является карбобензоксиглутамилтирозин [70]1:
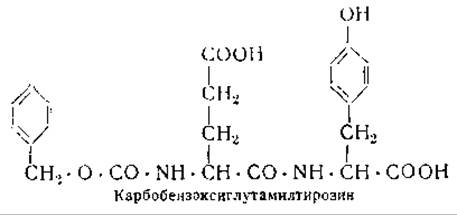
Очевидно, реактивные группы пепсина обладают способностью связывать как отрицательно заряженную боковую цепь амино- дикарбоновой кислоты, так и фенольный остаток тирозина, входящие в состав этого дипептид а. В пользу этого свидетельствует что белки с иодированными фенольными группами не расщепляются пепсином, тогда как после отщепления иода они расщепляются этим ферментом с большой легкостью [71].
Трипсин. Этот фермент получен в виде кристаллов из поджелудочной железы [72]. Лучший метод получения кристаллического трипсина сводится к получению кристаллического его предшественника — трипсиногена — и к превращению последнего в кристаллический трипсин. Для этого размельченную железу смешивают с разбавленной серной кислотой и полученную смесь фракционируют сернокислым аммонием; первые фракции содержат химотрипсиноген, трипсиноген же выпадает при дальнейшем добавлении сернокислого аммония [73]. При стоянии раствора трипсиногена в течение нескольких дней с сернокислым магнием или с энтерокиназой происходит превращение трипсиногена в трипсин. В поджелудочной железе содержится также специфический ингибитор, препятствующий действию трипсина. Этот ингибитор был получен в кристаллическом виде [74]. Другой ингибитор трипсина, выделенный из яичного белка, оказался идентичным с овомукоидом [75].
Трипсин относительно устойчив к действию горячих растворов разбавленных кислот. Молекулярный вес трипсина 34 000 [76]. Этот фермент расщепляет пептидные связи, образованные карбоксильными группами аргинина или лизина, причем обязательным условием является, повидимому, незамещенность второй аминогруппы этих двуосновных аминокислот [77]. Для действия трипсина наличие NH-группы пептидной связи не является обязательным, так как трипсин расщепляет также эфиры аргинина [24].
1 Автор почему то не указывает, что пепсин обладает также способностью створаживать молоко и что у взрослых животных и человека нет особого фермента, который специально осуществлял бы только эту функцию. Это, как известно, установлено было И. П. Павловым, который в ряде исследований показал ошибочность точки зрения Гаммарстена, утверждавшего, что кроме пепсина в желудочном соке имеется особый фермент — химозин или реннин, единственной функцией которого является створаживание молока. Такой фермент удалось обнаружить только е секрете четвертого желудка молодых телят. У других молодых и взрослых животных и у человека химозин обнаружить не удалось. — Прим. ред.
Химотрипсин представляет собой второй протеолитический фермент поджелудочной железы. Он обладает также и способностью створаживать молоко. Свежая поджелудочная железа содержит химотрипсиноген, который был выделен в кристаллическом виде [78]. Химотрипсиноген превращается в активный фермент — химотрипсин — под действием небольших количеств трипсина; 1 мг трипсина способен активировать 3 г химотрипсиногена, причем активность последнего возрастает при этом примерно в 1 000 раз. Превращение химотрипсиногена в химотрипсин является, повидимому, очень сложным процессом, при котором образуются несколько промежуточных продуктов. Так, например, установлено, что химотрипсиноген переходит сначала в п-химотрипсин, затем в δ-химотрипсин. В конечном итоге из химотрипсиногена получается смесь химотрипсинов, обозначаемых буквами а, β и у [79, 80]. Сущность процесса активации заключается, повидимому, в освобождении 4—6 аминогрупп в каждой молекуле химотрипсиногена [82]. В результате стояния водного раствора а-химотрипсина при pH 7,6 происходит необратимое превращение его в ß- и у-химотрипсины, которые отличаются от а-химотрипсина по форме кристаллов и по растворимости [80]. у-Химотрипсин является димером а-химотрипсина [81]. Химотрипсин расщепляет пептидные связи, образованные карбоксильной группой тирозина, фенилаланина, триптофана или метионина [20, 83], а также эфиры тирозина [84].
Папаин, протеаза млечного сока дынного дерева (Carica papaya), был получен в кристаллическом виде [85]. Его активность связана с наличием в его молекуле сульфгидрильных групп. Доказательством этого служит то, что при окислении этих групп активность фермента исчезает, а при их восстановлении (например, глютатионом) вновь появляется [86, 87]. Такими же свойствами обладают и другие растительные протеазы, например бромелин ананаса и фицин фигового дерева, а также катепсин—протеаза, присутствующая во многих клетках животного организма. Все эти ферменты, подобно папаину, активируются различными восстановителями, а также цианидами [88]. Наиболее простым субстратом для действия папаина является гиппуриламид [85]. Согласно данным, полученным Абдергальденом и его сотрудниками, инъекция кроликам чужеродных белков ведет к образованию в их организме специфических протеаз, которые обладают способностью расщеплять только введенный белок. Так, например, инъекция альбумина, глобулина и фибриногена приводит к образованию различных защитных ферментов [89]. Эти же исследователи сообщили, что в ответ на парентеральное введение белков сыворотки молодых и старых животных также образуются соответствующие защитные ферменты [90]. Защитные ферменты были найдены как в кровяной сыворотке, так и в моче [91]. Имеются также указания на то, что защитные протеазы можно получить в кристаллическом виде; полученные названными авторами чистые препараты не обладали, однако, специфической протеолитической активностью [92] и приобретали ее только после реактивирования трипсином [93, 94]. Все приведенные данные относительно образования защитных ферментов нельзя еще считать окончательно установленными. Так, автору и его сотрудникам [95] не удалось вызвать образования защитных ферментов при инъекции сывороточного глобулина или глобулинов, в которых были замещены отдельные группы.
Карбоксиполипептидаза представляет собой единственную пептидазу, полученную в настоящее время в кристаллическом виде. Она получена из сока, вытекающего при оттаивании замороженной поджелудочной железы, фракционированным осаждением сернокислым аммонием при слегка кислой реакции [96]. Молекулярный вес карбоксиполипептидазы 33 800 [47]. Этот фермент расщепляет пептиды, содержащие свободные карбоксильные группы, причем наличие свободных аминогрупп не обязательно [97]. Карбоксиполипептидаза может расщеплять не только пептидные, но также и эфирные связи [25, 52].
Реннин (химозин) — протеолитический фермент желудочного сока, вызывающий створаживание молока, получен в кристаллическом виде [99, 100]1. Было найдено, что 1 часть чистого фермента вызывает створаживание 107 частей молока.
Уреаза, первый фермент, который удалось выделить в кристаллическом виде, получается из муки бобов Canavallia ensiformis [1]. Молекулярный вес чистого белка 483 000 [101]. Интересно отметить, что продукт деполимеризации уреазы, имеющий молекулярный вес 17 000, также обладает ферментативной активностью. Трипсин инактивирует кристаллическую уреазу [103].
1 См. примечание к стр. 292. — Прим. ред.