БИОХИМИЯ ЧЕЛОВЕКА - Л. В. Капилевич - 2016
ЧАСТЬ 1. СПОРТИВНАЯ БИОХИМИЯ
ХИМИЧЕСКИЙ СОСТАВ ОРГАНИЗМА
Организм человека имеет следующий химический состав: вода - 60-65 %, органические соединения - 30-32 %, минеральные вещества - 4 %.
Наибольшее значение для живых организмов имеют органические соединения. Важнейшими классами органических соединений, входящих в живые организмы, являются белки, углеводы, липиды и нуклеиновые кислоты.
Белки
Белки выполняют в организме очень важные функции: ферментативный катализ, транспорт и накопление, сокращение и движение, иммунная защита, передача информации в клетку, регуляция метаболизма, механическая опора, энергетическая.
Строение белков
Белки - это высокомолекулярные соединения (полимеры), состоящие из аминокислот - мономерных звеньев, соединенных между собой пептидными связями. Все 20 аминокислот, встречающиеся в белках, это аминокислоты, общим признаком которых является наличие аминогруппы NН2 и карбоксильной группы СООН. Аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Все аминокислоты можно сгруппировать на основе полярности R-групп, т. е. их способности взаимодействовать с водой при биологических значениях рН.
Пептидные связи образуются при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты: пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку.
Молекула белка имеет четыре уровня структурной организации.
Первый уровень - первичная структура. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и определяется генами.
Второй уровень пространственной организации - вторичная структура (рис. 1). Известно несколько видов вторичной структуры: α-спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и СО-группой четвертого от нее остатка; β-структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи, изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание α-спиралей и β-структур в разных белках различно: у фибриллярных белков - только α-спираль или только β-складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо α-спираль, либо β-складчатый лист, либо беспорядочный клубок. В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи.
Рис. 1. Вторичная структура белка (А - α-спираль, Б - β-складчатый слой)
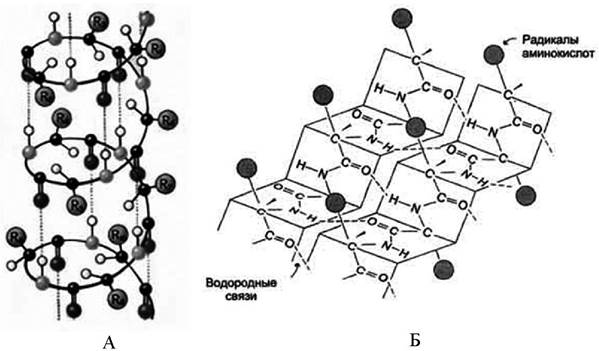
Третий уровень пространственной организации - третичная структура. Представляет собой ориентацию в пространстве полипептидной цепи, содержащей α-спирали, β-структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Такая структура стабилизируется электростатическими силами, водородными связями, гидрофобными взаимодействиями и дисульфидными связями.
Пространственная форма всей белковой молекулы получила название конформация. Конформация характеризуется нестабильностью и может легко изменяться, что влияет на биологические функции белка. Конформация, находясь в которой белок обладает биологической активностью, называется нативной.
Четвертичной структурой обладают только некоторые белки. Четвертичная структура - это сложное надмолекулярное образование, состоящее их нескольких белков, имеющих свою собственную первичную, вторичную и третичную структуры. Каждый белок, входящий в состав четвертичной структуры, называется субъединицей.
Объединяются субъединицы в четвертичную структуру за счет слабых нековалентных связей (ионных, водородных, гидрофобных), и поэтому четверичная структура неустойчива и легко диссоциирует на субъединицы.
Классификация белков
Существует несколько классификаций белков. Среди них наиболее распространены две:
1. По составу белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот (альбумины, глобулины, гистоны, белки опорных тканей). Сложные белки содержат еще компоненты неаминокислотной природы. Небелковую часть называют простетической группой, а белковую апопротеином. Например, фосфопротеиды содержат фосфорную кислоту, нуклеопротеиды содержат нуклеиновую кислоту, гликопротеиды содержат углевод и др.
2. Классификация белков по пространственной форме. В этом случае белки разделяются на два больших класса: глобулярные и фибриллярные. Молекулы глобулярных белков имеют шарообразную или эллипсоидную форму. Примером таких белков служат альбумины и глобулины плазмы крови. Фибриллярные белки представляют собою вытянутые молекулы. К таким белкам, прежде всего, необходимо отнести коллаген.
Физико-химические свойства белков
1. Денатурация.
Белковая молекула имеет нативную (функциональную) конформацию благодаря наличию большого числа слабых связей и быстро денатурирует при изменении условий среды, от которых зависит стабильность этих связей. Изменение температуры, ионной силы, рН, а также обработка органическими или некоторыми дестабилизирующими агентами может привести к нарушению нативной конформации, что и называется денатурацией. Денатурирующие вещества образуют связи с аминогруппами или карбонильными группами пептидного остова или некоторыми боковыми остатками аминокислот, подменяя собственные внутримолекулярные связи в белке, вследствие чего вторичная и третичная структуры изменяются. Эти изменения не затрагивают первичную структуру, при этом биологическая активность белка утрачивается.
2. Ренативация.
При определенных условиях денатурированный белок может быть ренативирован (обратимая денатурация). Это происходит при удалении денатурирующего или дестабилизирующего фактора. Например, при удалении мочевины диализом полипептиды самопроизвольно восстанавливают свою нативную конформацию. То же происходит при медленном охлаждении денатурированного нагреванием белка.
3. Молекулярная масса.
Белки являются высокомолекулярными соединениями. Например, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка, и ее молекулярная масса составляет примерно 14 000. Миоглобин (белок мышц), состоящий из 153 аминокислотных остатков, имеет молекулярную массу 17 000, а гемоглобин - 64 500 (574 аминокислотных остатка). Молекулярные массы других белков более высокие: глобулин (образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150 000, а молекулярная масса фермента глутаматдегидрогеназы превышает 1 000 000.
4. Амфотерность.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой, глутаминовой аминокислот, а щелочные - радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства, и наоборот. В щелочной среде белок отдает протон и заряжается отрицательно, тогда как в кислой среде подавляется диссоциация кислотных групп и белок становится катионом. Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН.
Однако при определенных значениях рН-число положительных и отрицательных зарядов уравнивается, и молекула становится электронейтральной, т. е. она не будет перемещаться в электрическом поле. Такое значение рН-среды определяется как изоэлектрическая точка белков.
5. Растворимость в воде.
Белки обладают большим сродством к воде, т. е. они гидрофильны. Молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок. Величина гидратной оболочки зависит от структуры белка.
6. Высаливание.
Белки обладают свойством обратимого осаждения, т. е. выпадением белка в осадок под действием определенных веществ, после удаления которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд.
Нуклеиновые кислоты
Нуклеиновые кислоты выполняют в организме человека следующие функции: ДНК - хранение наследственной информации, РНК - реализацию генетической информации и каталитическую функцию.
Строение нуклеиновых кислот
Нуклеиновые кислоты представляют линейные полимеры нуклео- зидмонофосфатов, то есть полинуклеотиды. Нуклеотиды построены из трех компонентов: пиримидинового или пуринового основания, углевода (пентозы) и фосфорной кислоты. Нуклеотиды связаны между собой в цепь фосфодиэфирной связью. Она образуется за счет этерификации ОН-группы С-3-пентозы одного нуклеотида, и ОН-группы фосфатного остатка другого нуклеотида.
Молекула нуклеиновой кислоты имеет два уровня структурной организации.
Первичная структура нуклеиновых кислот определяется как последовательность нуклеотидных остатков в полимерной цепи. Многообразие молекул ДНК и РНК объясняется их первичной структурой.
Вторичная структура у молекул ДНК и РНК разная. Молекула ДНК представляет собой правозакрученную спираль, состоящую из двух полинуклеотидных цепей с антипараллельным ходом. Это означает, что 3-концу одной цепи соответствует 5-конец другой цепи, и наоборот. Остатки оснований направлены внутрь спирали. На один виток спирали приходится 10 пар оснований. Цепи ДНК не идентичны, так как нуклеотидный состав их различен, однако первичная структура одной цепи предопределяет нуклеотидную последовательность другой цепи, то есть они комплементарны друг другу. Это связано с существованием комплементарных пар оснований. Физико-химическую основу комплементарности составляют водородные связи, которые могут образоваться только между аденином одной цепи и тимином другой, противоположно направленной цепи (пара А-Т), и аналогично между гуанином и цитозином (пара Г-Ц).
Молекула РНК состоит из одной полинуклеотидной цепи. Отдельные участки этой цепи (до 20-30 нуклеотидных пар) могут быть комплементарны между собой и образуют спиральную структуру за счет связей между аденином и урацилом (пара А-У) и гуанином и цитозином (пара Г-Ц). Между спирализованными участками располагаются одноцепочечные петли. Существует несколько разновидностей РНК: матричная (мРНК), транспортная (тРНК), рибосомная (рРНК).
Классификация нуклеиновых кислот
В одну молекулу нуклеиновых кислот может входить углевод только одного вида - рибоза или дезоксирибоза. На этом основании все нуклеиновые кислоты делятся на два типа: рибонуклеиновые - РНК (содержат рибозу) - и дезоксирибонуклеиновые - ДНК (содержат дезоксирибозу).
Физико-химические свойства нуклеиновых кислот
1. Денатурация.
Вторичная структура DNA стабилизируется лишь слабыми водородными и гидрофобными связями, следовательно, DNA способна к денатурации (плавлению) при повышении температуры до 80-90 °С. При денатурации двухспиральная молекула ДНК разделяется на отдельные цепи. Температура, при которой 50 % ДНК денатурировано, называется температурой плавления и зависит от качественного состава ДНК.
2. Ренатурация.
Если раствор денатурированной ДНК медленно охлаждать (отжиг), то вновь возникают слабые связи между комплементарными цепями, и может получиться спиральная структура, идентичная исходной (нативной).
3. Растворимость в воде.
В воде ДНК образует вязкие растворы, при нагревании таких растворов до 60 °С или при действии щелочей двойная спираль распадается на две составляющие цепи.
4. Молекулярная масса.
Молекулярная масса нуклеиновых кислот сильно варьирует, но в целом очень большая, особенно у ДНК. В ядре клетки человеческого организма содержится 46 молекул ДНК, в составе каждой из них - 3,5 млрд пар мононуклеотидов. В митохондриях есть циклическая ДНК, ее молекула содержит 16 тыс. пар мононуклеотидов. Сначала была расшифрована структура митохондриальной ДНК. В ней закодирована информация о строении 13-ти полипептидных цепей, 2-х рибосомальных РНК и 22-х транспортных РНК.
Углеводы
В основном углеводы выполняют энергетическую функцию. Главными источниками энергии являются глюкоза и гликоген. Кроме того, из углеводов могут синтезироваться липиды, некоторые аминокислоты, пентозы. Углеводы входят как составная часть в структурно-функциональные компоненты клетки - гликолипиды и гликопротеины.
Строение углеводов
Углеводы - это альдегидоспирты или кетоспирты и их производные.
Классификация углеводов
По современной классификации углеводы делятся на три основные группы: моносахариды, олигосахариды и полисахариды.
Моносахариды (простые сахара) не подвергаются гидролизу, получить из них более простые углеводы невозможно. К моносахаридам относятся: рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза и др.
Олигосахариды состоят из нескольких (до 10) моносахаридов, соединенных ковалентными связями. При гидролизе они распадаются на входящие в их молекулы моносахариды. Наиболее распространены дисахариды, такие как: сахароза (пищевой или тростниковый сахар), содержащая в своей молекуле остатки глюкозы и фруктозы, лактоза (молочный сахар), состоящая из остатков глюкозы и галактозы, и др.
Полисахариды представляют собой длинные неразветвленные или разветвленные цепи, включающие сотни, тысячи моносахаридов. Чаще всего полисахариды состоят из глюкозы. Наиболее распространены следующие полисахариды: целлюлоза (клетчатка), крахмал, гликоген. Все они состоят только из остатков глюкозы.
Физико-химические свойства углеводов
1. Молекулярная масса.
Среди углеводов встречаются как достаточно простые соединения с молекулярной массой около 200, так и гигантские полимеры, молекулярная масса которых составляет несколько миллионов.
2. Растворимость в воде.
Моносахариды очень легко растворимы в воде, легко образуют сиропы, из которых выделить их в кристаллическом виде бывает очень трудно.
3. Окисление.
Как и у всех альдегидов, окисление моносахаридов приводит к соответствующим кислотам. Так, при окислении глюкозы аммиачным раствором гидрата окиси серебра образуется глюконовая кислота (реакция «серебряного зеркала»).
4. Восстановление.
Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрид лития и др.
5. Алкилирование (образование простых эфиров).
Под действием метилового спирта при наличии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
6. Ацилирование (образование сложных эфиров).
При действии на глюкозу уксусного ангидрида образуется сложный эфир - пентаацетилглюкоза.
Основные углеводы в организме человека
Основным природным углеводом является глюкоза, которая может находиться как в свободном виде (моносахарид), так и в составе олигосахаридов (сахароза, лактоза и др.) и полисахаридов (клетчатка, крахмал, гликоген).
Эмпирическая формула глюкозы С6Н12О6. Однако, как известно, глюкоза может иметь различные пространственные формы (ациклическую и циклическую). В организме человека почти вся глюкоза (свободная и входящая в олиго- и полисахариды) находится в циклической форме.
Свободная глюкоза в организме человека в основном находится в крови, где ее содержание довольно постоянно и колеблется в узком диапазоне от 3,0 до 6,1 ммоль/л (70-110 мг %).
Другим углеводом, типичным для человека и высших животных, является гликоген. Состоит гликоген из сильно разветвленных молекул большого размера, содержащих десятки тысяч остатков глюкозы. Эмпирическая формула гликогена - (С6Н10О5)n (С6Н10О5 - остаток глюкозы).
Гликоген является запасной, резервной формой глюкозы. Основные запасы гликогена сосредоточены в печени (до 5-6 % от массы печени) и в мышцах (до 2-3 % от их массы).
Глюкоза и гликоген в организме выполняют энергетическую функцию, являясь главными источниками энергии для всех клеток организма.
Липиды
Биологические функции липидов определяются прежде всего тем, что они являются источниками энергии. Эту функцию выполняют жирные кислоты, освобождающиеся после распада жиров. Фосфолипиды, гликолипиды и холестерин участвуют в образовании клеточных мембран. Производные некоторых полиненасыщенных жирных кислот (простагландины) выполняют регуляторную функцию, эти жирные кислоты представляют собой незаменимые пищевые компоненты. Холестерин является структурным компонентом мембран, а также предшественником желчных кислот и стероидных гормонов.
Строение липидов
Молекула жира состоит из остатка многоатомного спирта и остатков жирных кислот, соединенных сложноэфирной связью.
Жирные кислоты, входящие в состав жиров, делятся на предельные, или насыщенные (не имеют двойных связей), и непредельные, или ненасыщенные (содержат одну или несколько двойных связей).
Отличаются друг от друга жиры разного происхождения набором жирных кислот.
Адипоциты (жировые клетки) состоят из триглицеридов. В состав биомембран входят фосфолипиды, гликолипиды и холестерин.
Классификация липидов
Липиды делятся на жиры и жироподобные вещества (липоиды).
Физико-химические свойства липидов
1. Растворимость.
Жиры нерастворимы в воде, хорошо растворимы в органических растворителях, но обычно плохо растворимы в спирте.
2. Гидролиз.
При обработке перегретым паром, минеральными кислотами или щелочью жиры подвергаются гидролизу (омылению) с формированием глицерина и жирных кислот или их солей, образуя мыла. При сильном взбалтывании с водой образуют эмульсии. Примером стойкой эмульсии жира в
воде является молоко. Эмульгирование жиров в кишечнике (необходимое условие их всасывания) осуществляется солями желчных кислот.
Вопросы для самоконтроля
1. Перечислите важнейшие классы органических соединений, входящие в живые организмы.
2. Какие функции в организме человека выполняют белки?
3. Какой связью стабилизируется первичная структура белковой молекулы?
4. Приведите примеры глобулярных белков.
5. Опишите структуру ДНК.
6. Приведите примеры полисахаридов.
7. В каких органах человека сосредоточены запасы гликогена?
8. По какому признаку жирные кислоты делятся на насыщенные и ненасыщенные?
9. Сколько выделяется энергии при окислении 1 г жира?