Гликопротеины - Хьюз Р. 1985
Биосинтез
Сборка N-гликанов
Липиды-переносчики
Как мы уже видели, структура N-гликанов в гликопротеинах чрезвычайно разнообразна. Строение гибридных и сложных типов цепей маннозосодержащих олигосахаридов было описано в гл. 2. Несмотря на такое структурное разнообразие, биосинтез N-гликанов большинства (а возможно, и всех) гликопротеннов происходит с использованием общего промежуточного липида полиизопренольного типа — долихола [23, 24]. Этот путь удивительно консервативен в процессе эволюции [24].
Роль полиизопренолов в гликозилировании была впервые установлена при изучении биосинтеза некоторых полимеров клеточной стенки бактерий: полисахариды, несущие антигенно-активные видоспецифические последовательности углеводов, исследовали Филипс Робинс (Robbins) и его сотрудники, а структуру пептидогликана из клеточной стенки — Жак Строминджер (Strominger) и его группа. Позднее выдающийся аргентинский биохимик Луис Лелуар (Leloir) представил убедительные данные о том, что подобные изопренольные переносчики участвуют в гликозилировании белков.
В общем виде структура активного полиизопренола показана на рис. 3.4. Значение и варьирует, но для тканей животных она колеблется от 17 до 22. Концевое изопреновое звено насыщено и несет первичную гидроксильную группу, которая в активной форме фосфорилирована. Эта реакция осуществляется специфической СТР-зависимой киназой. Когда экстракты из разнообразных клеток животного происхождения, а также насекомых, растений и некоторых низших эукариотов (таких, как дрожжи, определенные виды грибов и простейшие) инкубировали с долихолфосфатами и GDP-маннозой или UDP-глюкозой, происходило высвобождение UDP или GDP и образование растворимых в органических растворителях производных сахаров. Остатки сахаров связываются с полиизопренолами фосфодиэфирной связью, которая имеет ß-конфигурацию (рис. 3.4). Поскольку в нуклеотидсахарах имеется связь в a-конфигурации, то образование долихолфосфатсахаров происходит с обращением связи при С-1. В отличие от этого N-ацетилглюкозамин-1-фосфат переносится с UDP-N-ацетилглюкозамина на долихолфосфат с отщеплением UMP. (рис, 3.4). Следовательно, a-конфигурация сахарного звена сохраняется в долихолпирофосфат-N-ацетилглюкозамине.
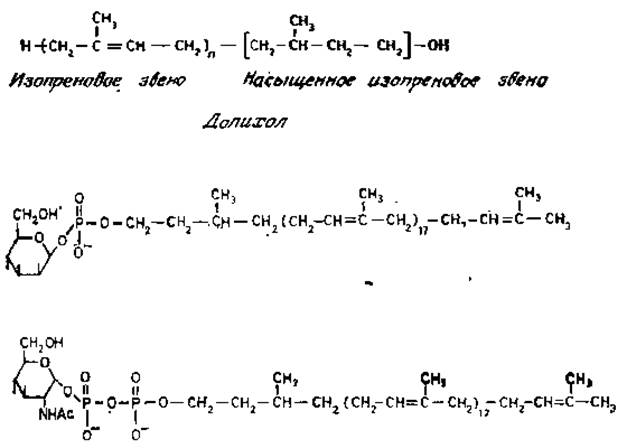
Рис. 3.4. Структура долихолов и фосфодолихилмоносахарндных производных, активных в биосинтезе гликопротеинов.
Простейшие производные долихолов, приведенные на рис. 3.4, отнюдь не единственные липофильные соединения, синтезируемые клеточными экстрактами. Лелуар сделал фундаментальное открытие, обнаружив производные долихолфосфатов с необычной растворимостью, и показал, что в этих производных присутствуют олигосахариды, присоединенные пирофосфатной связью к первичному гидроксилу долихола. Эти данные подтвердились на примере многих типов клеток и тканевых экстрактов, а впоследствии была установлена полная последовательность реакций, включающих долихолфосфаты и нуклеотидсахара (рис. 3.5), Кроме того, теперь изучены и некоторые аспекты регуляции этого уникального метаболического пути.
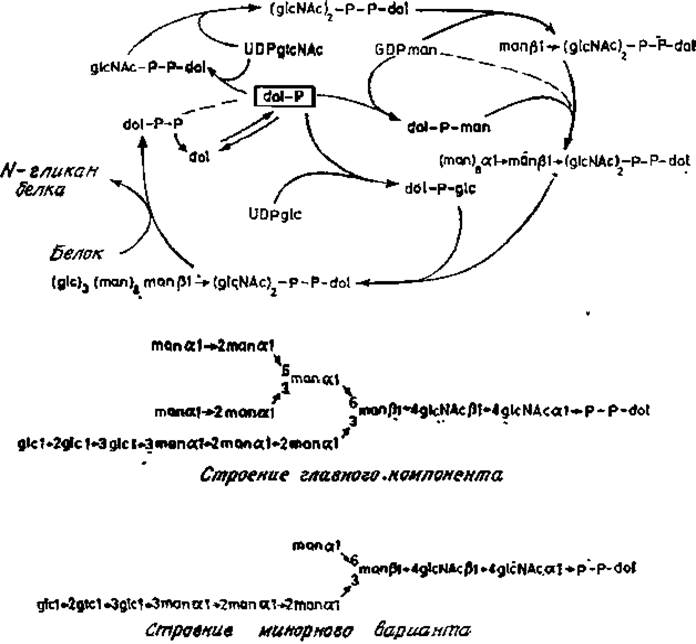
Рис. 3.5. Липидный цикл и структура конечного продукта.
Содержание долихолфосфатов в клетках и тканях контролируется по крайней мере двумя ферментами: уже упоминавшейся киназой и фосфатазой. Реакция UDP-N- ацетилглюкозамина с долихолфосфатом катализируется специфическим ферментом, в результате действия которого образуется пирофосфатное производное, содержащее остаток N-ацетилглюкозамина, связанный с долихолом. Этот остаток образует «точку присоединения» для фермента, переносящего второй остаток N-ацетилглюкозамика с UDP-N-ацетилглюкозамина с образованием (ß1→4)-связи. После этого следует присоединение ß-маннозильного остатка в положение С-4 этого нового звена. Донором маннозы в этой реакции служит GDP-манноза. Следующие этапы биосинтеза заключаются в переносе восьми остатков маннозы с образованием а-связи с долихолом и трех остатков глюкозы. Что приводит к образованию уникальной разветвленной структурой [23, 24]. В настоящее время эти маннозилтрансферазы еще не удается получить в очищенном виде. Однако из кинетических данных, полученных в опытах с дельными клетками, вполне очевидно, что присоединение а-маннозильных звеньев является высокоупорядоченным процессом (рис. 3.6), вероятно закрепленным в процессе эволюции. В первую очередь с центральным ß-маннозильным звеном связывается (а1→3)-маннозильный остаток, а затем (а1→6)-маннозильный остаток. Боковая ветвь, содержащая a-маннозильный остаток, присоединившийся первым, далее удлиняется на два (a1→2)-маннозильных звена, прежде чем происходит сборка полиманнозной цепи у второй ветви. И опять (a1→3)- связанная ветвь собирается раньше, чем (a1→6) -связанная ветвь; в конце этого процесса присоединяется глюкоза [25]. Весьма вероятно, что для этих стадий биосинтеза требуются различные a-маннозилтрансферазы и три глюкозилтрансферазы.
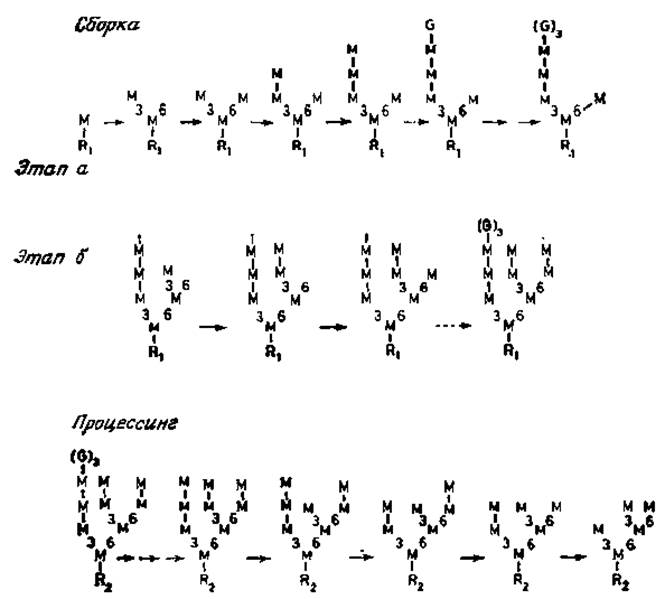
Рис. 3.6. Сборка олигоманнозидлипидов и стадии процессинга СНО- яйцеклеток китайского хомячка. R1 — glcNAcß1→4glcNAc-пирoфocфатдолихол. R2 — glcNAcß1→glcNAc Asn. Положение остатков маннозы (М) и глюкозы (G) в цепи показано на рис. 3.5. Этап а — минорный путь, этап б — главный путь.
![]()
Рис. 3.7. Последние стадии гликозилировании остатков аспарагина в белках.
В клетках со специально заблокированным синтезом долихолфосфатманнозы образуются только укороченные варианты липидных промежуточных продуктов, содержащие четыре остатка маннозы (рис. 3.5). В нормальных клетках такие укороченные долихолфосфатманнозы являются лишь минорными компонентами. Из этого следует, что первые a-маннозильные остатки переносятся от GDP-маннозы, а последующие четыре остатка происходят от долихолфосфатманнозы [26, 27]. Остальные стадии сборки заключаются в присоединении скорее всего из долихилфосфатглюкозы трех остатков глюкозы к одной из ветвей структуры, богатой маннозой. Главный конечный продукт (рис. 3.5) служит прямым предшественником N-гликанов в гликопротеинах: олигосахаридная часть липидного промежуточного продукта переносится целиком (в виде единого блока) на остаток аспарагина в полипептидном акцепторе. Долихолпирофосфаты удаляются и, возможно, возвращаются в результате дефосфорилирования в общий пул долихолов (рис. 3.7).
Фермент, способный переносить такой блок, обнаружен во многих тканях, активно синтезирующих гликопротеины. Этот фермент удивительно универсален. Ферментные препараты из одного источника проявляют активность по отношению к различным акцепторам, полученным из этой же ткани или из совершенно иного источника. Еще более удивительно, что короткие пептиды, содержащие аспарагин, тоже способны выполнять в этой реакции роль акцепторов (28, 291. Когда сравнивали акцепторную активность развернутой рибонуклеази и а-лактальбумина с акцепторной активностью синтетических пептидов, последовательность которых была идентична последовательности вокруг гликозилируемого аспарагина соответствующих полипептидов данных гликопротеинов, то акцепторная активность таких синтетических пептидов была высокой (табл. 3.1). Однако активны были не все пептиды, а только те из них, которые имеют последовательность Asn-x-Ser или Thr, где х может быть практически любой аминокислотой, кроме пролина и, возможно, аспарагиновой кислоты (табл. 3.1). Для того чтобы функционировать в качестве акцептора, остатки аспарагина и гидроксиаминокислот должны иметь заблокированные амино- и карбоксильную концевые группы, а то, что остаток аспарагина существен для акцепторной активности, неудивительно, так как именно этот остаток гликозилируется. Таким образом, аналогичные пептиды, содержащие остатки глутамина или аспарагиновой кислоты вместо аспарагина, полностью лишены активности. Требования к акцептору при переносе олигосахарида на полипептид, установленные в этих исследованиях, всецело зависят от последовательности в пептиде вокруг гликозилируемого остатка аспарагина В данном гликопротеине [30]. Многие из таких последовательностей теперь известны, и во всех случаях Asn-x- Ser или Thr локализованы внутри гликозилированной полипептидной цепи. Ингибиторный эффект пролина был также предсказан на основе рассмотрения гликозилированных участков в гликопротеинах. Причина такого ингибирования неизвестна, но одно из соображений заключается в том, что между амидом аспарагина и гидроксильной группой серина или треонина может возникать водородная связь, тогда как остаток пролииа препятствует возникновению такой связи. Возможно, что такая связь необходима, чтобы индуцировать соответствующую конформацию для замещения амидной группы подходящей олигосахаридной, например, путем модификации ионизации амидной группы.
Таблица 3.1. Требования к акцептору для осуществления переноса олигосахаридов [25, 29]
|
Синтетические пептиды |
Относительная активность, % |
|
РНКаза (Asn34-Leu-35-Thr) |
100 |
|
Na -ацетил Asn-Leu-ThrNHCH3 |
473 |
|
Na -ацетил Asn-Leu-Thr Lys |
293 |
|
Ser. Arg Asn-Leu-Thr-Lys |
120 |
|
Na-ацетил Asn-Leu-Thr |
5 |
|
Asn-Leu-Thr-Lys |
1 |
|
Asn-Leu -Thr |
1 |
|
а-Лактальбумин (Asn15-Gln16-Ser17) |
100 |
|
Nа-ацетил Asn-Leu-Ser-Leu |
18 |
|
Asn-Leu-Ser-Leu |
<1 |
|
Tyr-Asn-Leu-Thr-Ser-Val |
100 |
|
Tyr-Asp-Leu-Thr-Ser-Val |
0 |
|
Tyr-Gln-Leu-Thr-Ser-Val |
0 |
|
Tvr-Asn-Leu-Val-Ser-Val |
0 |
|
Tyr-Asn-Pro-Thr-Ser-Val |
0 |
Хотя совершенно ясно, что для переноса олигосахарида на аспарагин требуется наличие трипептида с определенной последовательностью, этого еще не достаточно. Во многих белках имеются требуемые последовательности, однако они или совсем не гликозилированы, или не полностью гликозилируются в процессе нормального клеточного биосинтеза. Фермент поджелудочной железы — рибонуклеаза — прекрасный пример такого явления. Только 20% белковых молекул гликозилированы по аспарагину-34 (табл. 3.1), тогда как остальные белки остаются негликозилированными и могут служить прекрасными акцепторами лишь при условии, что их полипептидная часть вначале денатурируется (развертывается) соответствующими химическими воздействиями (например, гидролизом бисульфидных связей и карбоксиметилированием в денатурирующих условиях). Подобно этому, а-лактальбумин имеет два узнаваемых трипептида Asn-GIn-Ser и Asn-Thr-Ser. Однако большинство этих последовательностей не гликозилираваны, и лишь небольшая их часть гликозилирована по первому центру гликозилирования. Денатурированные белки хорошо гликозилируются по любому из этих трипептидов, а синтетические пептиды, приготовленные на основе данных, полученных при изучении их последовательностей, в свою очередь — прекрасные акцепторы. Из этого можно сделать следующие выводы: 1) трипептид должен быть экспонирован соответствующим образом на поверхности молекулы белка для того, чтобы в процессе сборки гликопротеина в клетке могло быть осуществлено гликозилирование; 2) существующий механизм контроля позволяет гликозилировать только те остатки аспарагина, которые встречаются в последовательности, завершающей формирование поверхности белка после биосинтеза и складывающейся из полностью гликозилированного полипептида. Совершенно ясно, что объемные углеводные группы всегда существуют на поверхности белковой глобулы и обычно находятся в участках пептидов с бета-складчатостью. Такие конформации особенно предпочтительны для введения гликозилированных последовательностей.
Как уже отмечалось, при особых обстоятельствах можно предотвратить полную сборку глюкозосодержащих промежуточных липидов в целых клетках. Однако образование N-гликозилированных белков все же осуществляется в таких клетках, и тогда возникает вопрос о специфичности гликозилтрансфераз, катализирующих перенос олигосахаридов на полипептид. По-видимому, некоторые долихолпирофосфатолигосахариды могут функционировать в качестве промежуточных соединений в такой реакции. Даже долихолпирофосфо-N-ацетилглюкозаминил-ß1→4N-ацетилглюказамин используется ферментом для переноса хитобиозного звена на синтетический пептид, хотя эффективность такого переноса снижена [28]. Все это наряду с тем фактом, что в клетках в нормальных условиях имеются большие глюкозосодержащие липиды-переносчики, которые в основном представляют собой связанные с долихолом олигосахариды, вполне определенно свидетельствуют о том, что N-гликозилирование в клетках осуществляется преимущественно путем переноса таких глюкозосодержащих олигосахаридов на полипептид. Прямым доказательством в пользу такого предположения стали эксперименты с импульсной меткой, проведенные с нормальными клетками или с клетками, инфицированными вирусом. Из этих исследований стало ясно, что олигосахарид, изначально перенесенный на полипептид в клетках или в вирусных гликопротеинах, идентичен по размеру и по структуре большому глюкозосодержащему долихольному промежуточному соединению. Глюкоза полностью собранного промежуточного переносчика, видимо, является необходимым фактором, контролирующим эффективность переноса на белки, по крайней мере в клетках животных (31].