Гликопротеины - Хьюз Р. 1985
Биосинтез
Сборка N-гликанов
Реакции терминирования
До сих пор мы обсуждали сборку N-гликанов олигоманнозидного типа, содержащих до девяти остатков маннозы. Как же тогда образуется другой основной класс N-гликанов, содержащих периферические остатки сиаловых кислот и галактозы и дополнительные остатки N-ацетилглюкозамина? Как осуществляется контроль за присоединением фукозы? Интересно, что в олигоманнозидных гликанах не обнаруживается фукоза, присоединенная к хитобиозной последовательности коровой области. К тому же фукоза часто встречается в структурах galß1→4glcNAc невосстанавливающего конца сложных N-гликанов, так же как и сиаловая кислота. Структур, в которых последовательность моносахаридов была бы замещена как сиаловой кислотой, так и фукозой, не обнаружено.
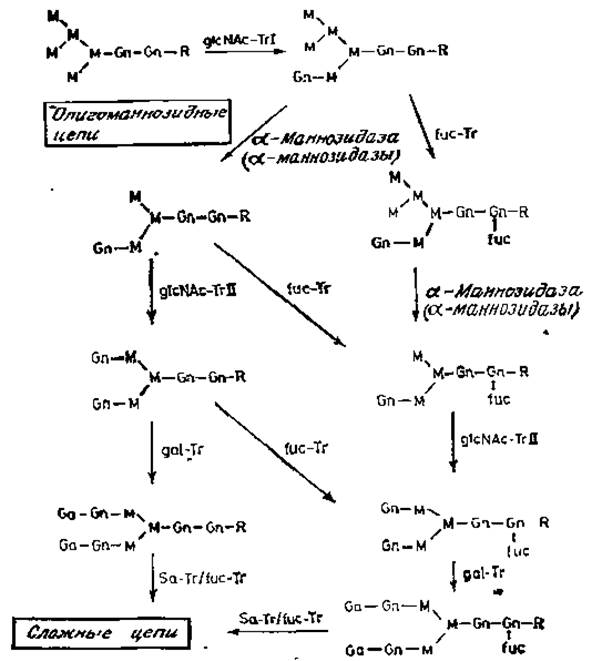
Рис. 3.8. Биосинтез N-гликанов, содержащих галактозу, Tr — трансфераза (значения сокращений см. в табл. 1.1).
Отправной точкой сборки сложных N-гликанов является структура, содержащая пять остатков маннозы (рис. 3.8). Гарри Шахтер (Schächter) и его сотрудники идентифицировали специфическую ß-N-ацетилглюкозаминилтрансферазу, которая использует этот субстрат, перенося остаток моносахарида с UDP-N-ацетилглюкозамина на а-маннозное звено с образованием (а1→3)-гликозидной связи в коровой области [35]. Фермент известен как N-ацетилглюкозаменилтрансфераза I, или glcNAc-Trl. Эксперименты с использованием бесклеточной системы или с очищенными ферментами показали, что возможным субстратом данного фермента является структура с пятью остатками маннозы, хотя и другие олигоманнозидные гликопептиды и гликопротеины могут служить акцепторами в этой реакции. Присоединение остатка N-ацетилглюкозамина запускает дальнейший процессинг олигосахарида, образующегося под действием a-маннозидазы. Эта a-маннозидаза (или а-маннозидазы) была получена в очищенном виде. Установлено, что она гидролизует (a1→3)- и (a1→6)-связи, причем маннозил-(а1→2)-связи не расщепляются под действием этого фермента, который явно отличается от ферментов, участвующих в более ранних реакциях процессинга (рис. 3.6). Продуктом действия a-маннозидаз является асимметричная последовательность, содержащая два a-маннозильных остатка, связанных с коровой областью. Такая структура служит субстратом для другой специфической N-ацетилглюкозаминилтрансферазы. II, или glcNAc-Trll, Последующие реакции включают перенос остатка галактозы с UDP-галактозы на остатки N-ацетилглюкозамина по С-4 с образованием N-ацетиллактозаминов, типичных для многих сложных N-гликанов. Недавно была описана [36] галактозилтрансфераза, способная, как и предполагалось, синтезировать последовательность galß1→3glcNAc в этих же участках моносахаридных цепей, так как такая последовательность была обнаружена в некоторых N-гликанах. Таким образом, glcNAc-трансфераза I является ключевым ферментом в превращении олигоманнозидных N-гликанов в сложные цепи.
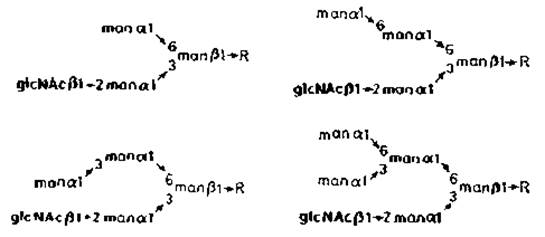
Рис. 3.9. Углеводные цепи бычьего родопсина. R — glcNAcß1→4glcNAc.Asn.
Другой тип контроля сборки N-гликанов обнаружен при биосинтезе родопсина — главного гликопротеина, составляющего мембраны дисков внешнего сегмента палочек сетчатки. Клетки, ответственные за биосинтез этого белка, по-видимому, содержат низкую а-маннозидазную активность, что и отражается в структуре N-гликана родопсина (рис. 3.9). Хотя очевидно, что в этих клетках образуется продукт N-ацетилглюкозаминилтрансферазы I и происходит процессинг, второй N-ацетилглюкозамин отсутствует.
Реакция, катализируемая N-ацетилглюкозаминилтрансферазой I, по-видимому, определяет другую важную модификацию гликана. В клеточных экстрактах была обнаружена фукозилтрансферазная активность, благодаря которой остаток фукозы присоединяется (a1→6)-связью к остатку N-ацетилглюкозамина, соединенного с аспарагином [11, 35]. Эта трансфераза может действовать на структуру коровой области Man3glcNAc2.Asn только тогда, когда хотя бы один из остатков N-ацетилглюкозамина присоединен к остатку a-маннозы. Другими словами, N-ацетилглюкозаминилтрансфераза I должна действовать до того, как соответствующая последовательность будет доступна для действия специфической фукозилтрансферазы (рис. 3.8). Это делает попятными данные, свидетельствующие о том, что такая связь отсутствует в N-гликанах, содержащих только маннозу.
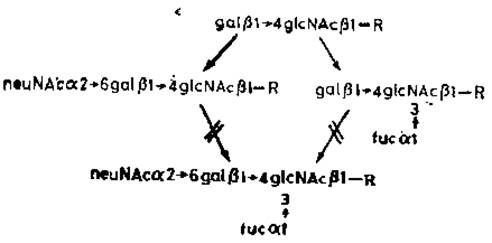
Рис. 3.10. Контроль конечных реакций при биосинтезе N-гликанов (R — см. рис. 3.9).
Конечные стадии сборки сложного N-гликана заключаются в присоединении сиаловых кислот и фукозы при помощи СМР-сиаловой кислоты и GDP-фукозы соответственно. Известно, что разные производные сиаловых кислот находятся на невосстанавливающих концах N-гликанов и присоединены гликозидной связью по С-3 или С-6 предшествующих остатков галактозы. Различные сиалилтрансферазы, по-видимому, катализируют образование этих гликозидных связей. Дальнейшее структурное разнообразие затем накапливается благодаря модификации сиаловых кислот, например, в результате окисления N-ацетильных групп до N-гликольных групп или же благодаря присоединению О-ацетильных групп, которое может осуществляться после переноса сиаловых кислот на цепь гликана.
При изучении активности очищенной сиалилтрансферазы, образующей (а2→6)-гликозидные связи с галактозой, выявилось [38] конкурентное взаимодействие с фукозилтрансферазой (рис. 3.10). Концевые последовательности типа галактозил-ß1→4N-ацетилглюкозамина могут служить акцепторами либо сиаловой кислоты, либо фукозы. Эти две реакции взаимоисключающие, что проливает свет на недавно установленные структуры N-гликанов в а-амилазе слюнной железы (рис. 3.11). Fucal→3GlcNAc присутствует также в N-гликане орозомукоида (рис. 2.1) и в других гликопротеинах.
Несколько главных проблем еще ждут своего решения. Во-первых, до сих пор не получено какой-либо информации о N-ацетилглюкозаминилтрансферазе, присоединяющей остатки к ß-маннозы звеньям в гибридных структурах или no С-4 и С-6 остатка а-маннозы в высокоразветвленных сложных N-гликанах, например в орозомукоиде (рис. 2.11). Однако очень вероятно, что это разные активности, отличающиеся от трансфераз I и II. Во-вторых, мы не представляем себе до настоящего времени. Как процессинг и терминация контролируются в соответствии с положением аспарагинового остатка в полипептидной цепи.
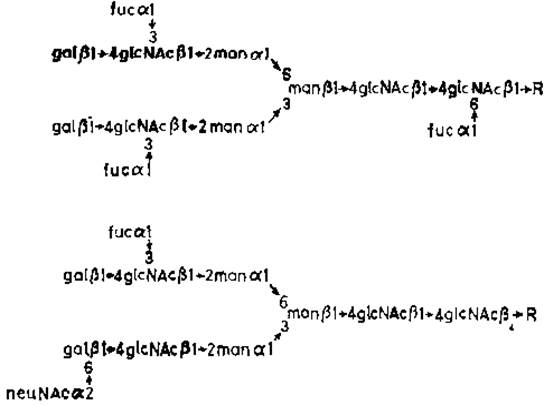
Рис. 3.11. Строение N-гликанов а-амилазы из околоушной железы [39].