Гликопротеины - Хьюз Р. 1985
Функции
Лектины: белки, связывающие углеводы
Специфичность
В табл. 4.1 приведена специфичность лектинов в отношении сахаров. Эти данные были получены в опытах по подавлению простыми углеводами агглютинации клеток, вызываемой лектинами. Обычно отдельный моносахарид, метилгликозид (а или ß) или дисахарид (например, galß1→3galNAc в случае лектина из арахиса), будучи добавлены в миллимолярных концентрациях, ингибируют активность лектина. Однако специфичность лектинов значительно выше, чем выявляется в подобных опытах, поскольку они часто способны различать достаточно длинные углеводные цепи — аналогично эндогликозидазам (гл. 2) и гликозилтрансферазам, а также ферменту из бактерий — лизоциму. Последний способен гидролизовать хитин и олигомеры N-ацетилглюкозамина, соединенные (ß1→4) -связью. Для наибольшего соответствия субстрата активному центру лизоцима требуется наличие шести моносахаридных остатков. Лизоцим связывает и меньшие по размерам олигомеры, но с более низким сродством. Длинные цепи связываются не лучше, чем олигосахариды, состоящие из шести остатков. Сходной специфичностью обладает лектин из проростков пшеницы (табл. 4.1). Для этого лектина оптимальным рецептором является трисахарид из остатков N-ацетилглюкозамина, связанных гликозидной (ß1→4)-связью. N-ацетилнейраминовая кислота также связывается лектином, но с меньшим сродством, чем вещества типа хитобиозы.
Подобно этому, конканавалин А реагирует лучше с цепями, содержащими маннозу, чем просто с остатком маннозы или маннозидами. Согласно данным рентгеноструктурного анализа, каждая из четырех идентичных субъединиц лектина имеет по одному участку, связывающему углевод, причем он соответствует одному-двум моносахаридам. Условия, минимально необходимые для связывания, — это наличие D-манно- или D-глюкопиранозидной конфигурации при С-3, С-4 и С-6, причем предпочтительным для связывания служит а-аномер. Таким образом, несмотря на небольшие размеры участка связывания, способность к распознаванию разных углеводных последовательностей гликопротеинов может быть очень значительной. Наиболее важным сахаром, участвующим в связывании гликопротеинов с конканавалином А, являются остатки а-маннозы, поскольку глюкоза обычно редко встречается в гликопротеинах, как и концевые N-ацетилглюкозамины. Значительная часть остатков a-маннозы занимает концевое положение у олигоманнозидных гликанов. С другой стороны, связываться способны и неконцевые остатки маннозы, замещенные по С-2 гликозидной связью. Основное требование для хорошего связывания — это наличие двух остатков a-маннозы, присоединенных к другому остатку с образованием разветвленной структуры (рис. 4.1). Этим последним может быть а-манноза, связанная с коровой областью, или man5- и mаn6-производные, как, например, у овальбумина, причем хорошее связывание сохраняется даже после удлинения цепи другими остатками N-ацетил- глюкозамина, галактозы и сиаловой кислоты. Однако сродство связывания резко снижается при замещении по С-4 одного из а-маннозных остатков. Более удивительным является тот факт, что замещение N-ацетилглюкозамином остатка а-маннозы в коровой области «гибридных» N-гликанов также снижает способность связывания с внешними разветвленными а-маннозильными звеньями. Возможно, что в этом случае остаток N-ацетилглюкозамина мешает взаимодействию с конканавалином А, заслоняя а-маннозильные остатки, либо вызывает такое конформационное изменение (растягивание) а-маннозильных остатков, которое неблагоприятно для многовалентного связывания с лектином.
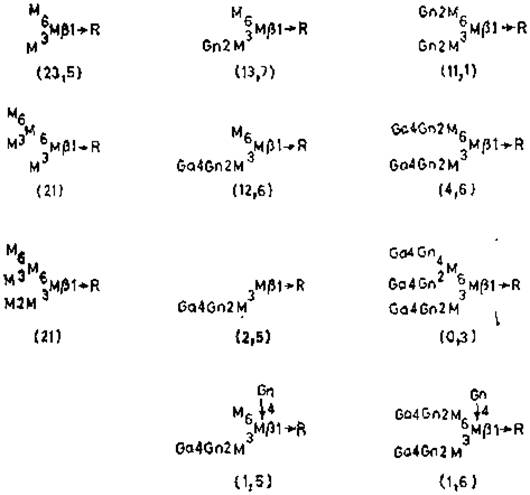
Рис. 4.1. Специфичность связывания у конканавалина А. Числа в скобках — значения констант ассоциации (X106 M-1) [56|. R — glcNAcß1→glcNAc.Asn.
Часто очистку гликопротеинов и гликопептидов проводят с помощью метода аффинной хроматографии на конканавалине А, присоединенном к сефарозе или агарозе. На колонках с этими сорбентами задерживаются только молекулы, имеющие участки связывания углеводов с константой ассоциации выше 4∙106 М-1. Это позволяет достаточно просто разделить гликаны, имеющие очень близкую структуру.
Лектины соевых бобов RCAI и RCAII (рицин) — очень сходные белки, построенные из нескольких субъединиц (рис. 4.2). Первый из них способен агглютинировать клетки при низких концентрациях; его молекулярная масса равна 120 000. Молекула RCAI слагается из двух В-цепей, имеющих участки связывания углеводов и двух А'-цепей, Рицин агглютинирует клетки только при высоких концентрациях и имеет лишь одну В-цепь и одну A-цепь, которая сходна с А'-цепью, но не идентична ей. Полипептидные цепи двух этик лектинов очень схожи между собой по своему аминокислотному и углеводному составу (у В-субъединицы имеется олигосахарид с высоким содержанием маннозы), а также по N-концевой аминокислотной последовательности. У рицина, однако, А-субъединица отличается очень высокой токсичностью [57]; причины токсичности будут описаны ниже. По специфичности связывания RCAI и рицин значительно отличаются друг от друга (рис. 4.3). RCAI, как правило, связываются со сложными N-гликанами с большим сродством, чем с О-гликанами [58], а N-гликаны, имеющие два концевых остатка галактозы, лучше реагируют с лектином, чем гликаны, содержащие галактозу лишь на одном конце цепи, В отличие от конканавалина А рицин и RCAI хорошо связываются с N-гликанами, у которых остатки а-маннозы при С-2 и С-4 присоединены к цепи, содержащей галактозу. Сиалирование N-гликанов не оказывает заметного влияния на их связывание с лектином, однако О-глиианы после этого полностью теряют свою реакционную способность. Присоединение лектинов к олигосахаридам galß1→3gaINAcal→Ser (Thr) или galNAсаl→Ser (Thr) резко возрастает, если вдоль полипептидной цепи разбросано много моно- или дисахаридов, как, например, в случае десиалированного гликофорина.
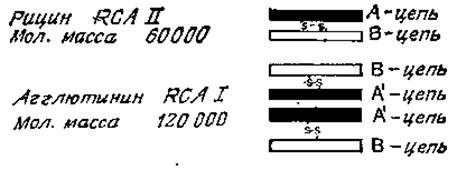
Рис. 4.2. Строение лектинов касторовых бобов.
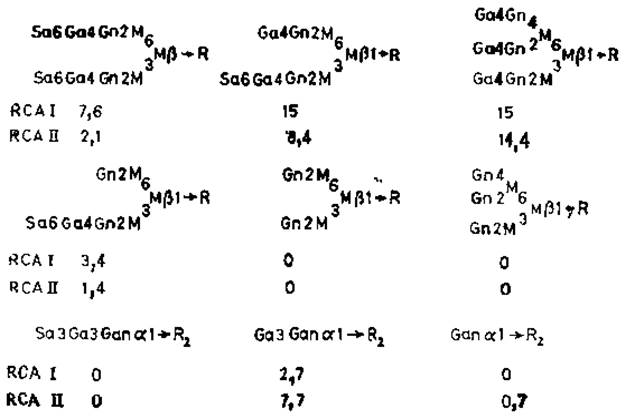
Рис. 4.3. Специфичность связывания у лектинов касторовых бобов RCAI и RCAII (рицин). Приведены величины константы ассоциации (Х106 М-1) [58]. R1 — glcNAcß1→4glcNAc.Asn, R2 — полипептид.