БІОХІМІЯ - Лабораторний практикум - НАУ 2015
МОДУЛЬ II
ФЕРМЕНТИ ТА МЕТАБОЛІЧНІ ШЛЯХИ.
Лабораторна робота 9
ЕКСПЕРИМЕНТАЛЬНЕ ПІДТВЕРДЖЕННЯ ФУНКЦІОНУВАННЯ ДИХАЛЬНОГО ЛАНЦЮГА
Мета роботи: виділити мітохондрії та субмітохондріальну фракцію, що містить ферменти дихального ланцюга, виявити окремі компоненти дихального ланцюга та дослідити їх функціонування.
Основні теоретичні відомості
Ферменти дихального ланцюга (ДЛ) локалізовані на внутрішній мембрані мітохондрій. Тому для дослідження функціонування ДЛ в лабораторних дослідах необхідно передусім одержати мітохондрії. Це досягається подрібненням тканин, їх руйнуванням, диференціальним центрифугуванням. Виділення окремих ферментних білків та комплексів проводиться екстрагуванням буферними розчинами. Дихальний ланцюг забезпечує передачу відновних еквівалентів (атомів водню та електронів) на кисень, кінцевою реакцією є утворення води. Таким чином, ДЛ забезпечує тканинне дихання — поглинання кисню тканинами. За рахунок енергії, що вивільняється під час транспортування відновних еквівалентів уздовж ДЛ, відбувається окисне фосфорилування — синтез АТФ з АДФ та неорганічного фосфату.
Процесу перенесення електронів уздовж ДЛ зручно вивчати з використанням субмітохондріальних фрагментів. Препарат Кейліна-Хартрі — фрагменти внутрішньої мембрани мітохондрій, майже без ферментів циклу Кребса, але з повним набором компонентів ДЛ. Для одержання препарату тканину руйнують розтиранням з абразивними матеріалами, проводять диференціальне центрифугування, екстрагування сольовими буферними розчинами.
Здатність мітохондрій поглинати кисень характеризує інтенсивність їх метаболізму. Манометричний метод, запропонований О. Варбургом, можна використовувати для дослідження процесів, що відбуваються з поглинанням кисню — окисного дезамінування, аеробного гліколізу, функціонування ДЛ, а також процесів, які відбуваються з виділенням газоподібних продуктів. Визначають зміну тиску в замкненій системі відомого об’єму за перебігом певних реакцій, розраховують об’єм газоподібного продукту, що утворився або витратився.
Полярографічний метод визначення концентрації кисню базується на електрохімічній реакції відновлення розчиненого кисню до перекису водню та води:
О2 + 2 ĕ + 2 Н+ → Н2О2
О2 + 4 ĕ + 4 Н+ → 2 Н2О
Електричний струм за певних умов лінійно залежить від концентрації кисню, тому можна визначити дихання біологічних об’єктів — тканин, суспензій клітинних органел, у тому числі мітохондрій. Найчастіше використовують електрод Кларка, який виготовлений з платини, що відділяється від реакційної суміші тонкою тефлоновою мембраною. Електрод заповнений насиченим розчином КСl. У цей розчин дифундує кисень з реакційної суміші, перебігає електрохімічна реакція відновлення.
Акцептором атомів водню від НАДН+Н+ у ДЛ є флавінові ферменти, які містять простетичну групу — похідне вітаміну В2 (рибофлавіну) флавінмононуклеотид (ФМН). Простетичною групою ферменту сукцинатдегідрогенази є флавінаденіндинуклеотид (ФАД). ФМН та ФАД у складі ферментів беруть участь в оборотних окисно-відновних реакціях:
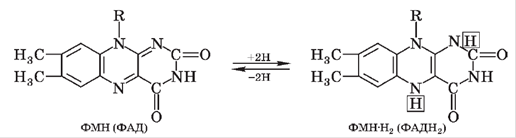
Окиснені форми ФМН і ФАД мають червоний, коричневий або зелений колір, тому ці компоненти ДЛ можна виявити за світлопоглинанням.
У перенесенні електронів ДЛ бере участь система цитохромів. Простетичною групою цитохромів є гем. Під час функціонування ДЛ валентність металу, що міститься у складі гему цитохромів, змінюється (Fe2+ ↔ Fe3+, Сu+ ↔ Cu2+), цитохром приєднує або віддає один електрон. У клітині одночасно працює щонайменше два ланцюги цитохромів. Усі цитохроми, особливо у відновленій формі, мають характерні спектри cвітлопоглинання. Цитохроми b, c1, cвиконують функцію проміжних переносників електронів, а цитохроми a та a3 (цитохромоксидаза) є дихальним ферментом, що безпосередньо взаємодіє з киснем. Окиснена форма цитохромоксидази приймає електрони від відновленого цитохрому, переходячи у відновлену форму, яка потім знову окиснюється молекулярним киснем. Утворений активний кисень О2- приєднує два протони, унаслідок чого утворюється молекула води.
Цитохромоксидаза дуже чутлива до дії ціанідів, сульфідів, азидів, чадного газу та інших речовин, що взаємодіють з металом у складі гему. Інгібування цитохромоксидази спричинює кисневе голодування тканин, що пов’язане з неможливістю використовувати кисень як акцептор електронів і протонів у ДЛ мітохондрій.
Обладнання: пробірки, пробірка з пробкою та газовідвідною трубкою, марля, фільтрувальний папір, піпетки, ножиці, чашки Петрі, склянки, лід, пропелерна мішалка, скляний гомогенізатор, центрифуга рефрижераторна високооборотна, м'ясорубка, ручний прес, фарфорова ступка з товкачиком, флуориметр.
9.1. Виділення мітохондрій з печінки тварин
Матеріали та реактиви: печінка тварин, 0,25 М розчин сахарози, розчин для виділення, що містить 0,25 М сахарози і 0,001 М ЕДТА (етилендіамінтетраацетату), рН 7,4, 1 М розчин НСl; 0,1 М розчин НСl; 1 М розчин КОН; 0,1 М розчин КОН.
Порядок виконання роботи
Тканину печінки промивають 2—3 рази невеликою кількістю охолодженого до 0 °С розчину для виділення. 15—20 г тканини подрібнюють ножицями в чашці Петрі, що стоїть на льоду. Кашицю переносять у склянку із свіжим розчином для виділення, знову промивають 2—3 рази, кожного разу відстоюють суміш, надосадову рідину обережно зливають. Тканину гомогенізують 30 — 40 с з 40 мл розчину для виділення, центрифугують 10 хв за 600 g і температури 0 — 2 °Сдля видалення ядер та не подрібнених шматочків тканини. Для розрахунку g (центрифужного поля) використовують формулу
g = 1118 · 10-8 R N2,
де R — радіус, що вимірюється від центра ротора до точки, у якій визначається центрифугувальне поле (до дна пробірки), см; N — швидкість обертання ротора, об/хв.
Супернатант зливають та зберігають на льоду, осад гомогенізують 20 с з 20 мл розчину для виділення, центрифугують 10 хв за 600 g. Супернатанти об’єднують.
Для осадження мітохондрій супернатант центрифугують при 14 000 g 10 хв. Осад суспендують в 0,5 мл розчину для виділення. Малими порціями, обережно струшуючи, додають 40 мл розчину для виділення та знову осаджують мітохондрії при 14 000 g 10 хв. Осад суспендують в 0,25 М сахарозі, знову центрифугують при 14 000 g 10 хв. Супернатант зливають, на осад мітохондрій обережно нашаровують 0,2—0,3 мл 0,25 М сахарози, легким струшуванням змивають верхній пухкий шар осаду, повторюють процедуру 2—3 рази. Щільний осад мітохондрій ретельно суспендують в 0,4—0,5 мл 0,25 М сахарози. Одержану густу суспензію мітохондрій зберігають у пробірці на льоду.
9.2. Одержання субмітохондріальних фрагментів
(препарату Кейліна—Хартрі)
Матеріали та реактиви: яловиче серце, фосфатно-боратний буфер, рН 7,4 (змішують однакові об’єми 0,15 М Н3ВО3 та 0,15 М Na2HPО4); 0,1 М фосфатний буфер, рН 7,4; 0,02 М фосфатний буфер, рН 7,4; 1 М розчин НСl; 0,1 М розчин НСl; 1 М розчин КОН; 0,1 М розчин КОН.
Порядок виконання роботи
Для одержання препарату можна використовувати як свіже серце, так і заморожене. Активність НАДН—КоQ-редуктази в препараті із замороженого серця знижується, але активність сукцинатдегідрогенази майже не змінюється.
Серце очищають від жиру, судин, сполучної тканини, 100 г нарізають, розмелюють на м'ясорубці. Заливають 1 л водопровідної води і перемішують пропелерною мішалкою 20 хв. Воду зливають, осад фільтрують крізь 4 шари марлі, старанно віджимають. Повторюють декілька разів. Далі всі операції виконують у холодній кімнаті або на льоду з використанням охолоджених до 4 °С розчинів. Масу заливають 1 л 0,1 М фосфатного буфера, лишають на 2 год, безперервно перемішуючі. Екстракт зливають, масу, що залишилася, двічі промивають дистильованою водою по 0,5 л, старанно віджимають (краще за допомогою ручного преса) та поміщають у фарфорову ступку, додають 10 мл 0,02 М фосфатного буфера та 10 г кварцового піску для розтирання. Суміш розтирають товкачиком протягом 1,5 год до одержання гомогенної сметаноподібної маси. До неї додають 25 мл 0,02 М фосфатного буфера, суміш ретельно перемішують.
Під час оброблення фосфатним буфером вимиваються ферменти циклу Кребса, а також цитохром с, тому висока активність препарату може бути досягнута лише при додаванні цитохрому с в інкубаційне середовище.
Одержаний препарат центрифугують за охолодження протягом 30 хв зі швидкістю 2 500 об/хв. Супернатант обережно зливають, центрифугують при 40 000 g протягом 1,5 год за температури
1 — 2 °С. Майже прозорий супернатант зливають. До осаду додають 1 мл фосфатно-боратного буфера, суспендують в скляному гомогенізаторі за найменшої швидкості обертання товкачика.
Одержаний препарат Кейліна—Хартрі зберігають у пробірці за температури 0 °С протягом декількох діб без помітного зниження сукцинатдегідрогеназної активності.
9.3. Виявлення флавінових коферментів
Матеріали та реактиви: 1 %-і розчини флавінаденін-динуклеотиду та флавінмононуклеотиду.
Порядок виконання роботи
Окиснені форми ФАД і ФМН здатні зумовлювати в ультрафіолетовому спектрі флуоресценцію, інтенсивність якої залежить від їх концентрації. У відновлених формах флавінів флуоресценція не виникає.
В одну пробірку вносять 10 крапель 0,002 %-го розчину ФАД, а в другу — 10 крапель 0,002 %-го розчину ФМН, що готують розведенням 1 %-х розчинів. Доливають у кожну пробірку по 5 мл води і перемішують струшуванням. Опромінення вмісту пробірок ультрафіолетом зумовлює флуоресценцію. Порівнюють інтенсивність флуоресценції двох проб за допомогою флуориметра.
Додають у кожну пробірку на кінці скальпеля порошок сульфіту натрію (відновник) і спостерігають за згасанням флуоресценції.
9.4. Визначення цитохрому с
Матеріали та реактиви: 1 %-й розчини цитохрому с, концентрована соляна кислота, металевий цинк, 0,5 М розчин аскорбінової кислоти.
Порядок виконання роботи
Розчин цитохрому с має червоний колір, після відновлення забарвлення втрачається. Як відновник поза організмом може бути використаний водень, що утворюється під час взаємодії концентрованої соляної кислоти і металевого цинку. Аскорбінова кислота може бути відновником цитохрому с як in vitro, так і in vivo.
В одну пробірку вносять невелику частину розчину цитохрому с, у другу пробірку з газовідвідною трубкою — декілька мілілітрів концентрованої хлоридної кислоти і невеликий кусок металевого цинку. Закривають другу пробірку пробкою, зовнішній кінець трубки занурюють у першу пробірку, щоб крізь розчин цитохрому с проходили бульбашки водню. Через деякий час розчин помітно блідне (порівнюють забарвлення з контрольним розчином цитохрому с). Під час стояння розчин цитохрому с поступово знову набуває колишнього забарвлення унаслідок його окиснення киснем повітря. У третю пробірку вносять 1 — 2 мл розчину цитохрому с, додають 3 мл розчину 0,5 М аскорбінової кислоти. Спостерігають зникнення забарвлення.
9.5. Визначення цитохромоксидази
Матеріали та реактиви: свіжа м’язова тканина, відновний реактив: 1 %-й розчин диметил-п-фенілендіаміну, 1,5 %-й розчину карбонату натрію і 1%-й розчин α-нафтолу в спирті змішують в рівних об’ємах, розчин повинен мати темно-коричневий колір без рожевого відтінку, його готують заздалегідь (за 1 год до заняття);
1 %-й розчин азиду натрію.
Порядок виконання роботи
Цитохромоксидаза здатна окиснювати за участю оксигену не тільки цитохроми, але й деякі інші сполуки, наприклад α-нафтол і N,N′-диметил-n-фенілендіамін (відновний реактив). Унаслідок їх окиснення утворюється кольоровий продукт — індофеноловий блакитний:
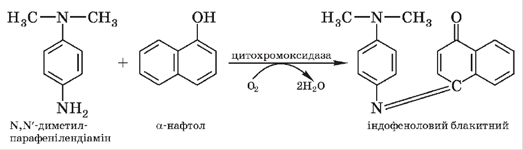
Подрібнюють ножицями і ретельно розтирають у ступці 5 г свіжої м’язової тканини, додають порціями 20 мл води. М’язову кашку фільтрують через подвійний шар марлі і багаторазово промивають водою до знебарвлення промивних вод. Безбарвну масу, яка містить цитохромоксидазу, комплекс цитохромів і деякі дегідрогенази, віджимають між аркушами фільтрувального паперу. Одержаний залишок кашки розділяють на три частини: одну переносять у пробірку, а дві інші залишають на фільтрувальному папері. До кашки в пробірку доливають 2 мл води і кип’ятять уміст на водяній бані 1 хв. Пробірку охолоджують, обережно зливають рідину, а м’язову кашку за допомогою скляної палички переносять на інший аркуш фільтрувального паперу. На першу порцію м’язової кашки (кип’ячену) і другу (некип’ячену) наносять по 2—3 краплі відновного реактиву, третю (некип’ячену) спочатку змочують 1 %-м розчином азиду натрію, а через 3 хв на неї наносять 2—3 краплі реактиву НАДІ. Порівнюють забарвлення трьох проб.
Оброблення експериментальних даних
Побудуйте схему послідовних етапів виділення мітохондріальної фракції та субмітохондріальних фрагментів з тваринних тканин. Напишіть окисно-відновні реакції за участю цитохромів ДЛ. Напишіть формулу гему у складі цитохрому в.
Контрольні запитання та завдання
1.Назвіть внутрішньомітохондріальну локалізацію ферментів ЦТК та ДЛ.
2.Чому для виявлення активності дегідрогеназ у субмітохондріальних фрагментах (препараті Кейліна—Хартрі) необхідно в реакційну суміш додавати розчин цитохрому с?
3.Напишіть перетворення ФАД, ФМН, НАД, НАДФ у ході окисно-відновної реакції. Укажіть ділянки молекул, що змінюються.
4. Поясніть принцип методу виявлення цитохрому с в досліджуваному розчині.
5. З яких білково-ліпідних комплексів складається ДЛ?
6. Назвіть місця спряження дихання та фосфорилування.
7. Чим зумовлено послідовність ферментів та переносників ДЛ?
8. Які речовини є інгібіторами ДЛ?
9. Які речовини роз’єднують процеси дихання та окисного фосфорилування?
10. Які речовини є інгібіторами окисного фосфорилування? На який фермент вони впливають?
11. Поясніть хеміоосмотичну теорію Мітчела.