БІОХІМІЯ - Лабораторний практикум - НАУ 2015
МОДУЛЬ II
ФЕРМЕНТИ ТА МЕТАБОЛІЧНІ ШЛЯХИ.
ЕНЕРГЕТИЧНИЙ МЕТАБОЛІЗМ
Лабораторна робота 7
ДОСЛІДЖЕННЯ СПЕЦИФІЧНОСТІ ДІЇ ГІДРОЛІТИЧНИХ ФЕРМЕНТІВ
Мета роботи: довести різні види специфічності гідролітичних ферментів.
Основні теоретичні відомості
Ферменти — високоспецифічні речовини. Вони розрізняються за видом (типом) специфічності. Якщо фермент каталізує перетворення лише одного субстрату, він має абсолютну специфічність.
Якщо фермент каталізує перетворення групи субстратів, його специфічність — відносна (або групова). Такий фермент високоспецифічний щодо типу зв’язку в молекулі субстрату. Гідролітичні ферменти (гідролази) каталізують розрив ковалентних зв’язків у молекулі субстрату за участю молекули води. Гідролази можуть мати абсолютну або відносну (групову) специфічність. Більшості гідролітичних ферментів шлунково-кишкового тракту людини притаманна групова специфічність. Наприклад, протеази (протеїнази, або пептидази) каталізують розщеплення пептидних зв’язків у молекулах білка, кінцевим продуктом гідролізу є амінокислоти. Глікозидази розривають глікозидні зв’язки, їх субстратом є вуглеводи, що розщеплюються за повного гідролізу до простих вуглеводів — моносахаридів. Естерази діють на ліпіди, складові компоненти яких з’єднані складноефірними зв’язками, продуктами гідролізу нейтральних ліпідів є гліцерол та вищі жирні кислоти. Нуклеази (ДНК-ази, РНК-ази) прискорюють гідроліз нуклеїнових кислот до нуклеотидів.
Стереоспецифічними є ферменти, які каталізують перетворення лише певного стереоізомеру субстрату, а на інший стереоізомер не впливають.
Обладнання: штатив із пробірками, піпетки, водяна баня, крапельниці, термостат, газовий пальник.
7.1. Специфічність дії амілази та сахарази
Матеріали та реактиви: розчин слини, 0,5 %-й розчин крохмалю, 0,5 %-й розчин сахарози, 0,1 %-й розчин йоду в 0,2 %-у розчині йодиду калію, реактив Фелінга та препарат сахарази (див. лабораторні роботи 2 та 6).
Порядок виконання роботи
У дві пробірки наливають по 3 мл розчину крохмалю. У першу пробірку додають 1 мл розчину слини (амілази), у другу — 1 мл препарату сахарази, перемішують і ставлять у термостат (38 °С).
У дві інші пробірки наливають по 3 мл розчину сахарози. У першу пробірку додають 1 мл препарату сахарази, у другу — 1 мл розчину слини і також ставлять у термостат (38 °С).
Через 15 хв у перші дві пробірки з крохмалем додають по п’ять крапель розчину йоду і спостерігають за забарвленням. У пробірці з амілазою синє забарвлення розчину не виникає або згодом зникає внаслідок розщеплення крохмалю амілазою. У другій пробірці розчин має синій колір тому, що сахараза не діє на крохмаль.
У двох інших пробірках дія ферменту виявляється за позитивною реакцією Фелінга на відновлювальні сахариди. Для цього в пробірки додають по 1 мл реактиву Фелінга та нагрівають до кипіння. Сахароза відновних властивостей не має, а глюкоза — один з продуктів гідролізу сахарози — має відновні властивості за рахунок наявності альдегідної групи. Тому в пробірці, у якій під впливом сахарази сахароза розщепилася на глюкозу та фруктозу, спостерігається цегляно-червоне забарвлення внаслідок утворення геміоксиду міді, а в пробірці, у якій сахароза лишилась неторканою, реакція Фелінга негативна.
Результати дослідження заносять до табл.7.1.
Таблиця 7.1
Визначення специфічності α-амілази та сахарази
Фермент |
Субстрат |
Умови реакції |
Реакція |
|
З йодом |
Фелінга |
|||
Амілаза |
Крохмаль |
37 °С 15 хв |
||
Амілаза |
Сахароза |
|||
Сахараза |
Крохмаль |
37 °С 15 хв |
||
Сахараза |
Сахароза |
|||
7.2. Групова специфічність дії сахарази
Матеріали та реактиви: препарат сахарази (див. лабораторну роботу 6), реактив Фелінга (див. лабораторну роботу 2), 1 %-й розчин рафінози, 1 %-й розчин сахарози.
Порядок виконання роботи
У дві пробірки наливають по 1 мл препарату сахарази. Сахараза специфічна щодо фруктозної частини дисахариду сахарози та трисахариду рафінози. В одну пробірку додають 2 мл розчину сахарози, у другу — 2 мл розчину рафінози. Вміст пробірок перемішують і поміщають на 5—10 хв у термостат (38 °С). Під дією ферменту розщеплюється β-глікозидний зв’язок ближче до фруктозної частини молекули. Потім у пробірки додають по 3 мл реактиву Фелінга, старанно перемішують і нагрівають до кипіння. Продукти ферментативного гідролізу сахарози та рафінози мають позитивну реакцію з реактивом Фелінга.
В обох пробірках утворюється червоний осад оксиду міді(I).
7.3. Дія уреази
Матеріали та реактиви: розчин сечовини (5 %-й), 1 %-й спиртовий розчин фенолфталеїну, 0,01 %-й розчин кристалічної уреази або препарат уреази (до 8 г соєвої муки або подрібненого і розтертого гарбузового насіння додають 46 мл дистильованої води, 2 мл розчину 0,1 М НС1, перемішують, додають кілька крапель толуолу, залишають на півдоби і фільтрують).
Порядок виконання роботи
У дві пробірки наливають по 1 мл розчину сечовини і додають по п’ять крапель розчину фенолфталеїну. В одну з них додають 5 мл препарату уреази або розчин уреази і перемішують. У другу пробірку додають 5 мл дистильованої води. Уреаза пришвидшує розщеплення сечовини з утворенням СО2 і NН3:
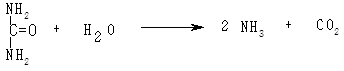
У пробірці з уреазою утворюється аміак, який змінює рН середовища на лужне. За зміною рН у бік лужних значень роблять висновок про дію уреази.
За наявності фенолфталеїну розчин забарвлюється в рожевий колір. Колір розчину в пробірці без уреази не змінюється.
7.4. Абсолютна специфічність дії уреази
Матеріали та реактиви: препарат уреази або 0,01 %-й розчин кристалічної уреази, 1 %-й спиртовий розчин фенолфталеїну, 5 %-й розчин сечовини, 5 %-й розчин тіосечовини.
Порядок виконання роботи
У дві пробірки наливають по 5 мл препарату або розчину уреази та додають по п’ять крапель розчину фенолфталеїну. В одну пробірку додають 1 мл розчину сечовини, а в другу — 1 мл розчину тіосечовини. Обидві пробірки залишають на 20 хв за кімнатної температури. Незначні зміни в структурі субстрату приводять до того, що фермент з абсолютною специфічністю не впливає на цей субстрат. Так, субстратом для уреази є сечовина, а тіосечовина, яка відрізняється від сечовини наявністю атома сірки, уреазою не розщеплюється.
Вміст пробірки із сечовиною забарвлюється в рожевий колір унаслідок утворення аміаку під час розщеплення сечовини.
Тіосечовина не розщеплюється під дією уреази, тому забарвлення в другій пробірці не виникає.
![]()
![]()
Сечовина Тіосечовина
Оброблення експериментальних даних
Побудуйте таблицю, яка міститиме субстрати, які можуть розщеплюватися відомими вам гідролітичними ферментами. Виокреміть види специфічності цих ферментів.
Контрольні запитання та завдання
1. Назвіть класи ферментів. До якого класу належать уреаза, амілаза, сахараза?
2. Назвіть види специфічності ферментів. Наведіть приклади.
3. Яку специфічність має більшість гідролітичних ферментів?
4. До чого специфічні ферменти, що мають групову (відносну) специфічність?
5. Напишіть реакцію гідролізу крохмалю. Яким ферментом вона каталізується?
6. Чому рН за дії уреази змінюється?