ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
4. ТРЕХМЕРНАЯ СТРУКТУРА БЕЛКОВ
4.4. Денатурация и фолдинг белка
Все белки начинают свое существование на рибосомах в виде линейной последовательности аминокислотных остатков (гл. 27). Эти полипептидные цепи в процессе синтеза или по его завершении должны соответствующим образом свернуться, чтобы принять свою нативную конформацию. Мы уже подчеркивали, что нативная конформация белка устойчива лишь условно. Совсем небольшие изменения окружающих параметров могут привести к таким структурным изменениям белка, которые скажутся и на то функции. Теперь рассмотрим подробнее процессы сворачивания и разворачивания белка.
Нарушение структуры приводит к потере функций белка
Специфическая структура белка сформировалась для обеспечения реализации его функций в определенном окружении в клетке. Условия, отличающиеся от условий в клетке, могут в различной степени повлиять на структуру белка. Нарушение трехмерной структуры белка, способное повлечь за собой потерю его функции, называют денатурацией. Денатурированное состояние всем не обязательно соответствует полностью развернутой конформации белка. В большинстве случаев денатурированные белки находятся частично развернутых состояниях, которые еще не до конца изучены.
Многие белки денатурируют под действием тепла, которое сложным образом влияет на слабые взаимодействия (в первую очередь на водородные связи) в белке. Если температура повышается медленно, конформация белка обычно остается неизменной вплоть до внезапного нарушения структуры (и функции), происходящего в узком интервале температур (рис. 4-25). Резкость этого перехода говорит о том, что разворачивание представляет собой кооперативный процесс: нарушение структуры в одной части белка дестабилизирует другие его части. Действие нагревания на белки не является полностью предсказуемым. Термостабильные белки бактерий-термофилов функционируют при температуре горячих источников, т. е. около 100°С. Интересно, что структура этих белков лишь немногим отличается от структуры гомологичных им белков, например, у бактерии Escherichia coli. До сих пор остается загадкой, каким образом толь незначительные отличия обеспечивают стабильность при высоких температурах.
Рис. 4-25. Денатурация белка. Показаны процессы денатурации белков под действием двух различных факторов. В каждом случае наблюдается довольно резкий переход между свернутой и развернутой конформацией, что говорит в пользу кооперативности процесса разворачивания белка, а) Тепловая денатурация апомиоглобина лошади (миоглобин без гемовой группы) и рибонуклеазы А (дисульфидные связи белка сохраняются, см. рис. 4-26). Средняя точка интервала температур, в котором происходит денатурация, называется температурой плавления (t°пл). За денатурацией апомиоглобина следили с помощью метода кругового дихроизма (см. рис. 4-9), позволяющего определять число спиральных структур в макромолекулах. Денатурацию рибонуклеазы А регистрировали по изменениям флуоресценции белка, связанным с изменением окружения остатков Тгр. 6) Денатурация рибонуклеазы А под действием гуанидина гидрохлорида (GuHCl), определенная методом кругового дихроизма; дисульфидные связи белка сохраняются.
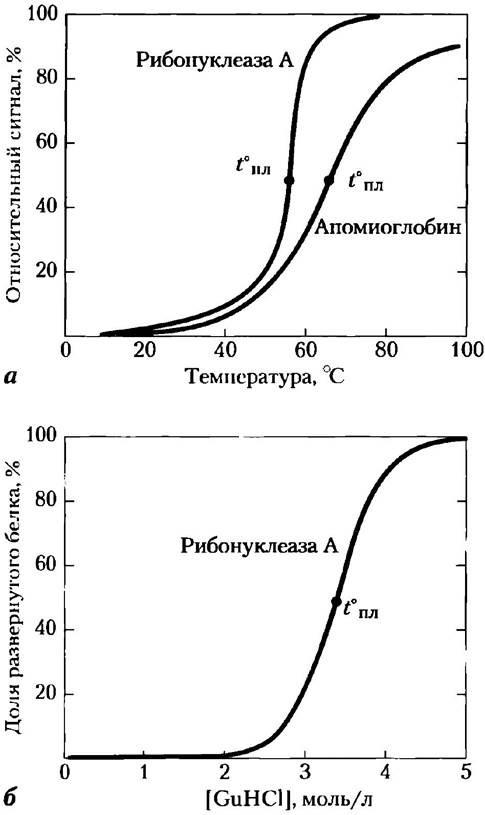
Белки также денатурируют при сильных изменениях кислотности, в присутствии некоторых смешиваемых с водой растворителей, таких как спирты или ацетон, а также мочевины, гидрохлорида гуанидина и детергентов. Каждый из этих факторов оказывает сравнительно слабое воздействие в том смысле, что ни одна ковалентная связь в полипептидной цепи белка не разрывается. Действие органических растворителей, мочевины и детергентов преимущественно заключается в нарушении гидрофобных взаимодействий, обеспечивающих устойчивость сердцевины глобулярных белков. Экстремальные значения pH изменяют суммарный заряд белка, что вызывает электростатическое отталкивание различных групп и разрыв некоторых водородных связей. В результате действия перечисленных факторов белок может переходить в денатурированное состояние, и необязательно в одно и то же.
Аминокислотная последовательность определяет трехмерную структуру
Третичная структура глобулярного белка определяется его аминокислотной последовательностью. Наиболее веским доказательством этого тезиса являются эксперименты по обратимой инактивации некоторых белков. Некоторые глобулярные белки, которые теряют свою нативную конформацию под действием тепла, экстремальных значений pH или денатурирующих агентов, при возвращении к исходным условиям вновь обретают нативную структуру и биологическую активность. Этот процесс называют ренатурацией.
Классическим примером может служить ренатурация рибонуклеазы А, продемонстрированная в 1950-х гг. Кристианом Анфинсеном. При обработке очищенного препарата рибонуклеазы А концентрированным раствором мочевины в присутствии восстановителя фермент полностью денатурирует. Восстановитель разрушает четыре дисульфидные связи в молекуле рибонуклеазы с образованием свободных остатков Cys, а мочевина нарушает стабилизирующие гидрофобные взаимодействия. В таких условиях полипептидная цепь полностью разворачивается, и фермент лишается своей каталитической активности. Если удалить мочевину и восстановитель, то беспорядочным образом скрученная молекула рибонуклеазы самопроизвольно сворачивается, принимая присущую ей нативную конформацию; каталитическая активность фермента восстанавливается (рис. 4-26). Процесс сворачивания рибонуклеазы настолько точен, что все четыре внутримолекулярных дисульфидных мостика оказываются на прежних местах. Математический расчет показывает, что существует 105 способов образования дисульфидиых мостиков между восемью остатками Суs. Действительно, в присутствии денатурирующих агентов дисульфидные связи образуются абсолютно случайным образом; это говорит о том, что для правильного расположения дисульфидных связей и восстановления нативной конформации необходимы слабые взаимодействия. Позднее аналогичные результаты были получены с использованием синтезированного химическим путем каталитически активного препарата рибонуклеазы А. Подобный эксперимент полностью исключил возможность, что минорные компоненты в очищенном препарате Анфинсена принимали какое-либо участие в ренатурации белка, и окончательно доказывал самопроизвольность процесса фолдинга.
Рис. 4-26. Ренатурация развернутой молекулы рибонуклеазы. Мочевина вызывает денатурацию рибонуклеазы, а меркаптоэтанол (НОСН2СН2SН) восстанавливает дисульфидные связи с высвобождением восьми остатков Суs. В результате ренатурации происходит восстановление исходных дисульфидиых мостиков.
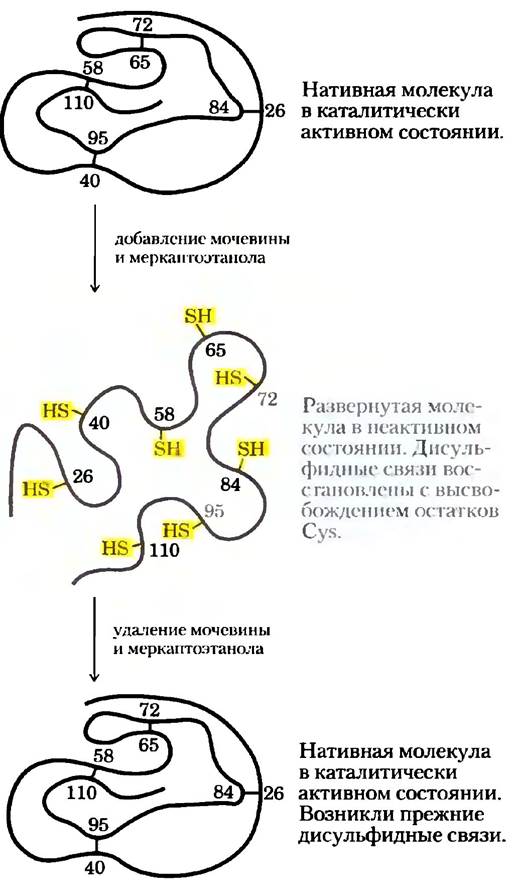
Эксперимент, проведенный Анфинсеном, впервые доказал, что аминокислотная последовательность полипептидной цепи содержит в себе всю информацию, необходимую для формирования нативной трехмерной структуры молекулы. Дальнейшие исследования показали, что верно лишь для незначительного числа белков, многие из которых имеют небольшой размер стабильны по своей природе. Но даже если все белки имеют тенденцию принимать нативную конформацию, многим для этого нужна определенная помощь, о чем мы поговорим далее.
Свертывание полипептидной цепи происходит быстро и поэтапно
В живых клетках процесс сборки белка из отдельных аминокислот происходит с очень высокой скоростью. Например, клетка Е. coli при 37°C способна синтезировать биологически активный белок, состоящий из 100 аминокислотных остатков, за 5 с. Каким образом образующаяся полипептидная цепь принимает нативную конформацию? Предположим, что в среднем каждый аминокислотный остаток может находиться в различных конформационных состояниях; отсюда получаем, что возможное число конформационных состояний полипептидной цепи равно 10100. Также предположим, что самопроизвольное сворачивание белка происходит путем случайного перебора всех возможных конформаций вокруг каждой одинарной связи в полипептидной цепи до тех пор, пока не будет найдена нативная биологически активная конформация. Если каждое конформационное состояние проверяется кратчайшее время (около 10-13 с — период; колебания молекулы), то проверка всех возможных вариантов для такого полипептида займет 1 лет. Таким образом, процесс укладки полипептидной цепи не может осуществляться методом проб и ошибок. Должны существовать какие-то более короткие пути. Впервые внимание этой проблеме уделил Сайрус Левинталь в 1968 г., данное явление иногда называют «парадоксом Левинталя».
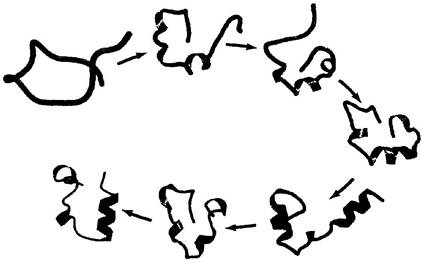
Процесс укладки большой полипептидной цепи, безусловно, подчиняется сложным механизмам, и мы до сих нор не знаем в точности, как же он происходит. Однако интенсивные исследования привели к формулировке нескольких возможных механизмов этого процесса. По одной из гипотез процесс фолдинга имеет определенную иерархию. В первую очередь образуются локальные вторичные структуры. Некоторые аминокислотные последовательности легко образуют α-спирали или β-слои в соответствии с теми ограничениями, о которых мы говорили при обсуждении вторичной структуры белка. Ионные взаимодействия с участием заряженных групп, которые часто располагаются рядом в линейной последовательности полипептидной цепи, могут играть важную роль на этих ранних стадиях укладки белка. Затем происходят взаимодействия между более удаленными частями цепи, скажем, две α-спирали могут образовывать супервторичную структуру. Этот процесс продолжается до окончательного формирования доменов и всего белка (рис. 4-27). Следует заметить, что белки, в которых доминируют близкие взаимодействия (между основаниями, расположенными недалеко друг от друга в полипептидной цепи), обычно сворачиваются быстрее, чем белки с более сложным характером укладки и большим количеством дальних взаимодействий между отдельными фрагментами.
Рис. 4-27. Модель фолдинга белка. Компьютерная модель фолдинга участка из 36 аминокислотных остатков виллина (актинсвязывающего белка, обнаруженного в микроворсинках кишечника). Процесс начинается со скрученной случайным образом пептидной цепи, окруженной оболочкой из 3000 молекул воды. При моделировании наиболее вероятных промежуточных стадий свертывания учитывали движения полипептидной молекулы и влияние оболочки воды. В данном случае процесс фолдинга протекает за 0,1 мс.
В соответствии с другой моделью фолдинг начинается со спонтанного перехода полипептида в компактное состояние; действующей силой этого перехода являются гидрофобные взаимодействия между неполярными остатками. В результате подобного «гидрофобного коллапса» некоторые участки молекулы могут организовать соответствующие вторичные структуры, однако значительная часть боковых цепей аминокислотных остатков не зафиксированы окончательно. Подобное состояние полипептидной цепи называют «расплавленной глобулой». Механизм фолдинга большинства белков, возможно, включает элементы обеих описанных моделей. Вместо того чтобы следовать каким-то одним путем, белковые молекулы используют различные пути, ведущие к одной и той же конечной точке. При этом по мере приближения к нативной конформации реализуется целый ряд конформационных состояний, отвечающих частично упакованным белковым структурам.
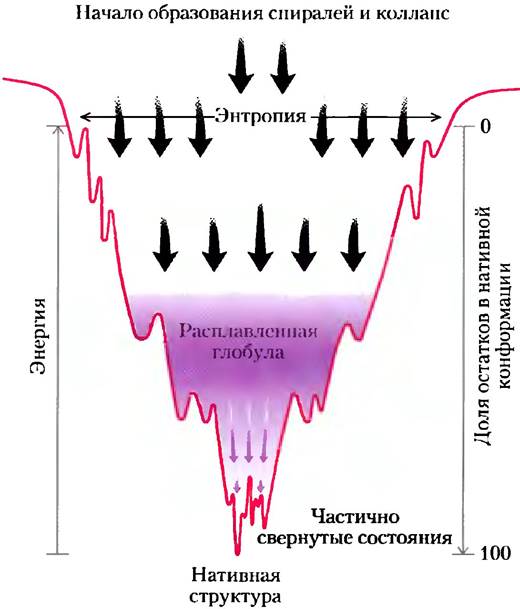
С термодинамической точки зрения, процесс фолдинга можно представить в виде некой «воронки» (рис. 4-28). Развернутые состояния характеризуются высокой конформационной энтропией и сравнительно высокой свободной энергией. По мерс свертывания цепи происходит сужение «воронки», отражающее снижение числа возможных конформационных состояний. Промежуточные энергетические минимумы соответствуют частично свернутым состояниям белка, которые несколько тормозят приближение к окончательному варианту. На дне «воронки» число возможных конформаций снижается до одной-единственной нативной конформации (или одной из небольшого числа возможных нативных конформаций).
Рис. 4-28. Термодинамика процесса фолдинга белка.
В верхней части «воронки» возможно большое число конформаций, следовательно, конформационная энтропия велика. На данном рисунке учтена только малая часть внутримолекулярных взаимодействий, реализующихся в нативной конформации. По мере свертывания белка и продвижения вниз по «воронке» уменьшается число возможных состояний (энтропия уменьшается), увеличивается доля белка в нативной конформации, и уменьшается свободная энергия. Локальные минимумы по краям воронки соответствуют промежуточным частично свернутым состояниям, наличие которых иногда может затормозить процесс фолдинга.
Термодинамическая устойчивость отдельных участков белковой молекулы может различаться — существуют области с высокой и низкой термодинамической устойчивостью. Например, белок может состоять из двух стабильных доменов, соединенных менее устойчивым сегментом; один небольшой участок домена может быть менее стабильным, чем основная структура. Участки с относительно низкой стабильностью позволяют белку изменять свою конформацию, переходя от одного состояния к другому. Как мы увидим в следующих двух главах, различная стабильность участков молекулы белка часто необходима для реализации его функции.
По мере расширения наших знаний о процессе укладки белка и о структуре белка появляются все более сложные компьютерные программы, позволяющие предсказать структуру белка на основании его аминокислотной последовательности. Предсказанием структуры белка занимается биоинформатика, а прогресс в этой области оценивается в ходе проводимых каждые два года соревнований CASP (Critical Assessment of Structural Prediction). Участники со всего мира соревнуются в предсказании (вслепую) структуры определенного белка, чья структура уже определена, но пока не опубликована. Достигшие наилучших результатов команды приглашаются представить свои результаты на конференции CASP. Пока задача предсказания структуры белка не имеет абсолютно надежных решений, однако CASP вносит большой вклад в совершенствование новых методов предсказания и повышение их точности.
Фолдинг некоторых белков протекает при участии молекулярных шаперонов
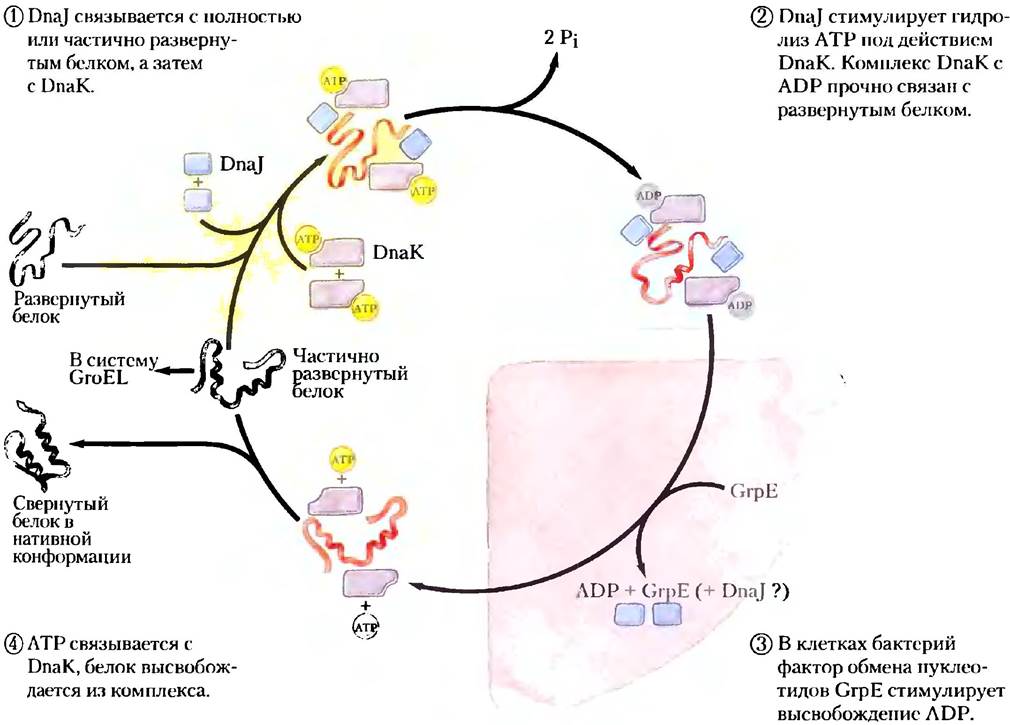
Не все белки самопроизвольно принимают нативную конформацию после синтеза в клетке. В некоторых случаях в фолдинге участвуют молекулярные шапероны — белки, которые взаимодействуют с частично свернутыми или неправильно свернутыми полипептидными цепями и обеспечивают нормальный фолдинг. Хороню изучены два класса молекулярных шаперонов. Оба они обнаружены в самых разных организмах - от бактерии до человека. К первому семейству белков, названному Hsp70, обычно относят белки с молекулярной массой около 70 000, число которых увеличивается при воздействии на клетку повышенной температуры, отсюда и происходит их название — белки теплового шока с Мr = 70 000 (heat shock proteins, Hsp70). Эти белки связываются с участками развернутого полипептида, имеющими много гидрофобных оснований, и предотвращают аномальную агрегацию. Таким образом эти шапероны защищают денатурированные тепловым воздействием белки, а также только что синтезированные и еще не свернутые пептиды. Кроме того, Hsp70 препятствуют фолдингу тех белков, которые должны оставаться в развернутом состоянии до тех пор, пока те не будут транспортированы сквозь мембрану (см. гл. 27). Некоторые шапероны облегчают образование четвертичной структуры олигомерных белков. Вместе с белками Hsp70 в цикле связывания и высвобождения полипептидов участвуют и другие белки (например, Hsp40). На рис. 4-29 показан механизм фолдинга белка Е. coli при участии шаперонов DnaK и DnaJ - гомологов эукариотических шаперонов Hsp70 и Hsp40. Сначала белки DnaK и DnaJ были идентифицированы как участники процесса репликации ДНК некоторых вирусов in vitro(отсюда их название «Dna»).
Рис. 4-29. Участие шаперонов в фолдинге белка. Циклический механизм связывания и высвобождения полипептидной цепи в клетках Е. coli продемонстрирован на примере шаперонов DnaK и DnaJ — гомологов шаперонов эукариот Hsp70 и Hsp40. Действие шаперонов направлено не на активацию фолдинга белка, а на предотвращение агрегации развернутых белков. В конце цикла определенная фракция полипептидов оказывается в нативной конформации. Оставшаяся часть вновь связывается DnaK или разделяется с помощью шаперонинов (GroEL, см. рис. 4-30). У бактерий белок GrpE на короткое время связывается с DnaK на заключительных фазах цикла (стадия 3), способствуя диссоциации ADP и, возможно, DnaJ. Аналог GrpE в эукариотических клетках неизвестен.
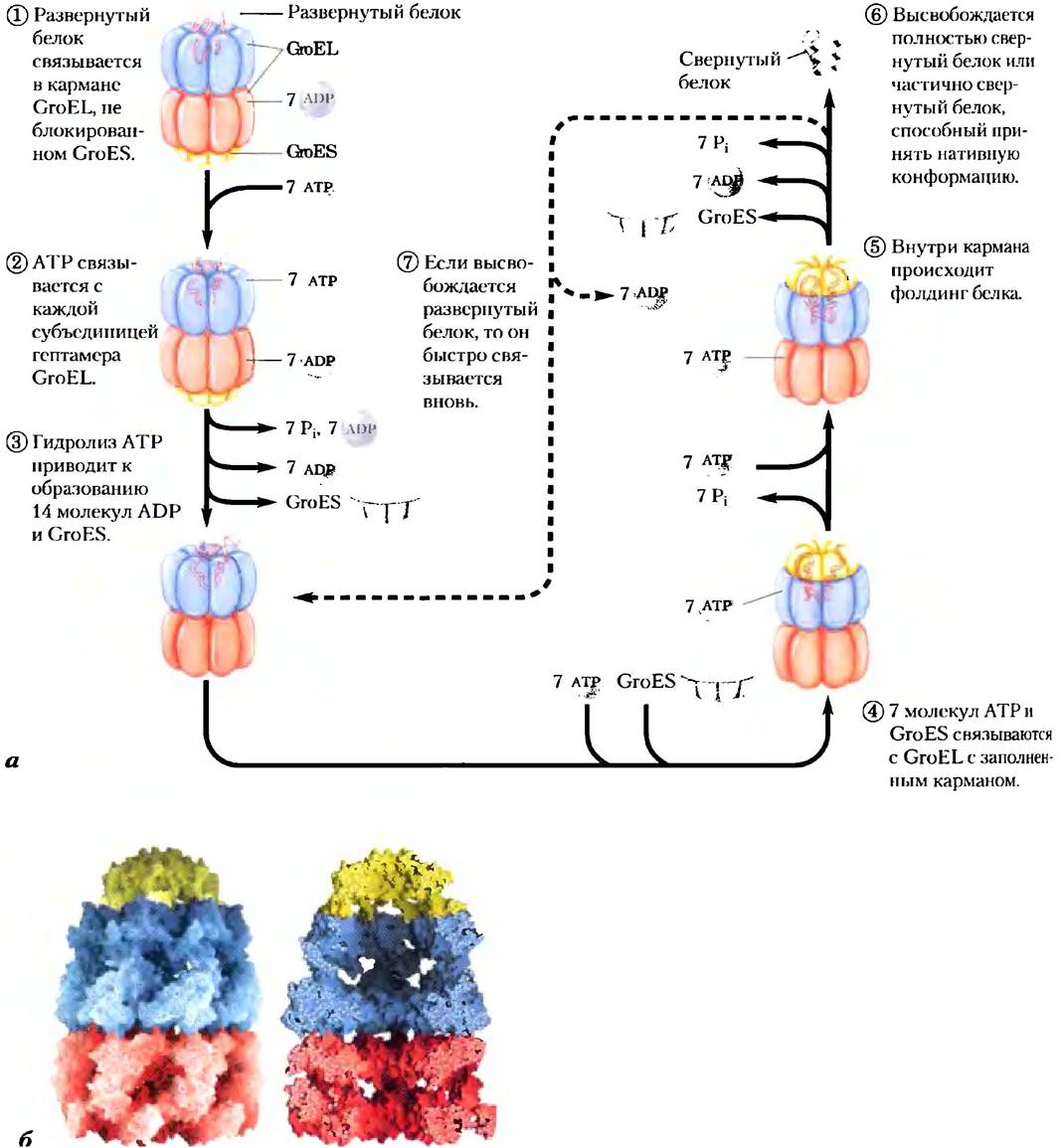
Второй класс шаперонов — шаперонины. Эти белковые комплексы осуществляют фолдинг тех белков, которые не могут сворачиваться самопроизвольно. По оценкам, от 10 до 15% белков Е. coli для нормальной укладки требуют постоянного присутствия системы шаперони- нов, называемой GroEL/GroES, а при тепловом воздействии на клетки в помощи шаперонинов нуждаются 30% белков. Исследователи впервые столкнулись с этими белками, когда выяснилось, что они необходимы для роста некоторых вирусов бактерий («Gro» происходит от англ. growth — рост). Развернутые белки связываются в карманах комплекса GroEL, после чего эти карманы на некоторое время закрываются, как крышкой, белками GroES (рис. 4-30). Затем GroEL подвергается последовательным конформационным изменениям, сопряженным с гидролизом АТР, а также высвобождением GroES, способствующим фолдингу связанного полипептида. Детали механизма, в соответствии с которым шаперонин GroEL/GroES облегчает свертывание белков, пока неизвестны, но ясно, что важную роль в этом процессе играют размер и свойства поверхности той полости, в которой происходит свертывание.
Рис. 4-30. Фолдинг белка с участием шаперонинов. а) Предполагаемый механизм действия шаперонинов GroEL (из семейства белков Hsp60) и GroES в клетках Е. coli. Каждый комплекс GroEL состоит из двух больших карманов, образованных двумя гептамерными кольцевыми структурами (Мr каждой субъединицы = 57 000). GroES тоже представляет собой гептамер (Мr субъединиц = 10 000); он блокирует вход в один из карманов GroEL. б) Изображение поверхности и внутренней части комплекса GroEL/GroES (PDB ID 1A0N). На правом рисунке видно большое внутреннее пространство, необходимое для связывания других белков.
Наконец, некоторым белкам для нормального свертывания требуется помощь двух ферментов, катализирующих реакции изомеризации. Дисульфидизомераза белков(PDI) —это распространенный фермент, катализирующий изменение положения дисульфидных связей до тех пор, пока не возникнут дисульфидные связи, соответствующие нативной конформации. Кроме прочего, PDI катализирует удаление промежуточных продуктов фолдинга с неправильным расположением дисульфидных мостиков. Пептидилпролил- цис-транс-изомераза (PPI) необходима для катализа взаимных превращений цис- и трансизомеров пролина (рис. 4-7, б), поскольку эта стадия может замедлять фолдинг белков, содержащих остатки Pro в цис-конформации.
По всей вероятности, фолдинг белка во внутриклеточной среде протекает более сложно, чем в пробирке. Исследование механизмов фолдинга продолжается, и, возможно, будут открыты новые классы белков, участвующих в этом процессе.
Нарушения фолдинга белка могут быть причиной целого ряда генетических заболеваний человека
Несмотря на существование множества вспомогательных механизмов, предназначенных облегчать свертывание белка, неправильное свертывание все же встречается. Эта проблема постоянно существует в клетке: свыше четверти всех синтезируемых клеткой полипептидов уничтожаются, поскольку оказываются свернутыми неправильно. В некоторых случаях неправильное свертывание является причиной или одной из причин серьезного заболевания.
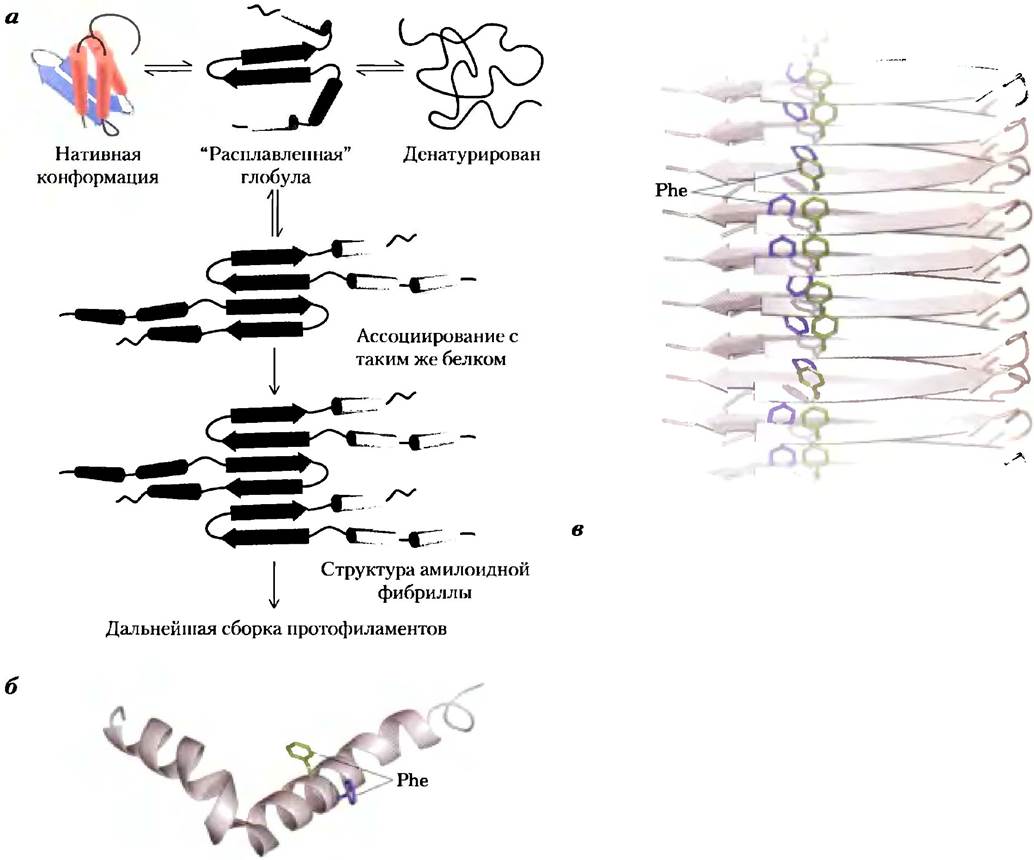
Такие состояния, как диабет II тина, болезни Альцгеймера, Хантингтона, Паркинсона, возникают в результате нарушения нормального процесса свертывания. В большинстве случаев при болезни растворимый белок, который в норме секретируется клеткой, секретируется в неправильно свернутом виде и превращается в нерастворимые внеклеточные амилоидные волокна. Такие заболевания относят к амилоидозам. Образующиеся неразветвленные волокна имеют упорядоченную структуру, диаметр от 7 до 10 нм, и содержат много фрагментов со структурой β-слоев. Эти β-слои ориентированы перпендикулярно оси волокна. В некоторых амилоидных волокнах образуются длинные двухслойные β-структуры, как те, что изображены на рис. 4-31 для β-амилоида.
Многие белки могут иметь структуру амилоидных волокон (как альтернативу нормальной конформации), и у большинства из этих белков в центральной части β-слоя сосредоточены ароматические аминокислотные остатки. Белки секретируются в не полностью свернутом состоянии. Центральная часть β-слоя (или ее фрагмент) формируется до того, как произойдет правильная укладка остального белка, так что β-слои одного или нескольких не полностью свернутых белков могут взаимодействовать между собой, образовывая волокна. Волокна наращиваются во внеклеточном пространстве. Другие части белка сворачиваются независимо, оставаясь вне центральной части β-слоев, образующих волокна (рис. 4-31, а; роль ароматических остатков в стабилизации данной структуры отражена на рис. 4-31, в). Поскольку большая часть молекул белка сворачивается нормально, первые признаки амилоидоза появляются нескоро. Однако, если у ребенка в результате наследования мутации происходит замена какой-то аминокислоты в той части цепи, которая участвует в формировании амилоидных волокон, на ароматическую аминокислоту, симптомы заболевания могут проявиться в очень раннем возрасте. Развитию заболевания также может способствовать нарушение механизма уничтожения неправильно свернутых белков.
Рис. 4-31. Образование амилоидного фиброза, а) Молекулы белка, нормальная структура которых содержит участки частично упакованных β-слоев. У немногих молекул до того, как закончится фолдинг, участки β-слоев одного полипептида ассоциируются с аналогичным участком другого полипептида, формируя ядро амилоида. Следующие молекулы белка постепенно ассоциируются с амилоидом и удлиняют его, образуя фибриллу. б) β-Амилоидный белок, который играет главную роль в возникновении болезни Альцгеймера, происходит из большого трансмембранного белка, который называют белком- предшественником β-амилоида или АРР (от англ. amyloid-β precursor protein). Этот белок обнаружен в большинстве тканей человека. Когда он является частью большого белка, пептид состоит из двух α-спиральных участков, пронизывающих мембрану. Когда внешний и внутренний домены (каждый из которых несет самостоятельные функции) расщепляются специальными протеазами, оставшийся относительно неустойчивый β-амилоидный белок покидает мембрану и теряет свою α-спиральную структуру. После этого он может постепенно сформировать амилоидную фибриллу (в), которая способствует появлению характерных бляшек на поверхности нейронов у людей, страдающих болезнью Альцгеймера. В амилоиде много β-слоев, ориентированных перпендикулярно оси амилоидной фибриллы. В β-амилоидном белке возникают вытянутые двухслойные параллельные β-складки. Остальные участки могут принимать форму левозакрученных β-спиралей (см. рис. 4-21).
Во многих случаях амилоидозы являются системными заболеваниями, протекающими с вовлечением многих тканей. Первичный системный амилоидоз бывает вызван отложением волокон, состоящих из неправильно свернутых легких цепей иммуноглобулина (см. гл. 5), или фрагментов легких цепей, образующихся в результате протеолитического расщепления. Средний возраст людей, у которых регистрируется заболевание, составляет 65 лет. Среди симптомов — утомляемость, хрипота, отеки и снижение массы тела; многие пациенты умирают в течение года после постановки диагноза. Часто в большой степени поражаются сердце и почки. Некоторые типы амилоидоза связаны с другими заболеваниями. У пациентов с определенными хроническими инфекционными или воспалительными заболеваниями, такими как ревматоидный артрит, туберкулез, кистозный фиброз и некоторые формы рака, может резко усилиться секреция полипептида, называемого сывороточным амилоидом А. Этот белок (или его фрагменты) откладывается в соединительной ткани селезенки, почек и печени, а также в области сердца. У пациентов с данным заболеванием, известным как вторичный системный амилоидоз, целый ряд симптомов — в зависимости от того, какие органы были повреждены в первую очередь. Обычно болезнь заканчивается летальным исходом через несколько лет. Более 80 типов амилоидоза связаны с мутациями транстиретина (этот белок связывает и переносит тиреоидные гормоны, доставляя их в различные отделы туловища и в головной мозг). Множество мутаций этого белка приводят к отложению амилоидных волокон в различных тканях, что сопровождается появлением многочисленных симптомов. Кроме того, амилоидозы бывают вызваны наследуемыми мутациями лизоцима, α-цепи фибриногена А, а также аполипопротеинов А-1 и А-Н; все эти белки описаны в следующих главах книги. При некоторых типах заболевания поражаются лишь определенные органы. Амилоидный белок обычно секретируется только пораженной тканью, так что его высокая концентрация вокруг этой ткани приводит к отложению амилоидных волокон именно в этой области (хотя часть белка может распространяться по всему организму). Часто отложение амилоидных волокон происходит вокруг β-клеток панкреатического островка, ответственных за секрецию инсулина и метаболизм глюкозы (рис. 23-27). Секреция β-клетками небольшого пептида (37 аминокислотных остатков), называемого островковым амилоидным полипептидом, или амилином, может приводить к отложению амилоида вокруг панкреатических островков и постепенному разрушению клеток. У здорового взрослого человека от 1 до 1,5 млн панкреатических р-клеток. При прогрессирующем исчезновении этих клеток нарушается гомеостаз глюкозы, а при потере 50% клеток появляются признаки сахарного диабета II типа.
Особый тип амилоидозов связан с отложением амилоида, приводящим к разрушению нервных клеток, в основном у пожилых людей. Болезнь Альцгеймера вызвана отложением внеклеточного амилоида нейронами при участии белка, называемого β-амилоидным пептидом. Отложение амилоида, по-видимому, является основной причиной заболевания, но кроме того, в нейронах у таких больных происходит агрегация белка тау. Наследственная мутация белка тау не приводит к болезни Альцгеймера, но вызывает не менее тяжелые заболевания — лобно-височную деменцию и паркинсонизм (состояние, напоминающее по симптомам болезнь Паркинсона).
При некоторых других нейродегенеративных заболеваниях происходит внутриклеточная агрегация аномально свернутых белков. При болезни Паркинсона аномально свернутая форма белка α-синуклеина образует волокнистые массы, называемые тельцами Леви. В развитии болезни Хантингтона принимает участие белок хантингтин, имеющий длинный полиглутаминовый участок. У некоторых людей этот участок длиннее, чем в норме, в результате чего происходит агрегация белка в клетке. Связь подобных заболеваний с амилоидозом не совсем очевидна, однако известно, что белки, образующие нерастворимые агрегаты, имеют высокое содержание β-структур, т. е. между этими типами заболеваний, безусловно, есть некоторая общность.
Развитие тяжелого заболевания в результате неправильного свертывания белка совсем не обязательно протекает с образованием амилоида. Например, кистозный фиброз возникает в результате дефекта мембранного белка CFTR (cystic fibrosis transmembrane conductance regulator), выполняющего функцию ионного канала для транспорта ионов хлора. Чаще всего возникновение заболевания связано с делецией остатка Phe в положении 508 белка CFTR, которая приводит к появлению неправильно упакованного белка. Большая часть белка уничтожается, и его нормальная функция не выполняется (см. доп. 11-3). Многие мутации коллагена (с. 191), вызывающие нарушение свертывания, также приводят к развитию заболеваний. Ярчайший пример нарушения свертывания белка — прионовая болезнь (доп. 4-6). ■
Дополнение 4-6. МЕДИЦИНА. Смерть из-за неправильного сворачивания белка: прионы
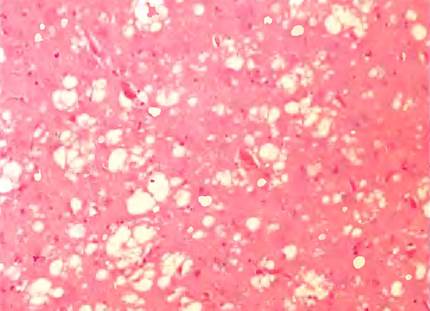
Аномальное сворачивание белков является причиной нескольких редких дегенеративных заболеваний мозга у млекопитающих. Возможно, наиболее известным из них является бычья губчатая энцефалопатия, БГЭ («коровье бешенство»). Среди сходных заболеваний можно назвать болезни куру и Крейцфельда — Якоба у людей, скрепи (почесуха) у овец, а также хроническую изнуряющую болезнь у оленей и лосей, которые так же относят к губчатой энцефалопатии, поскольку мозг больного часто напоминает губку (рис. 1). Прогрессирующее разрушение мозга приводит к спектру неврологических симптомов, включая потерю массы тела, нарушение осанки, равновесия и координации, а также потерю когнитивной функции. Типичными признаками этого смертельного заболевания являются умственные отклонения и нарушения координации.
Рис. 1. Окрашенный срез коры мозга пациента с болезнью Крейцфельда—Якоба. Видна губчатая (вакуолярная) дегенерация ткани — наиболее характерный нейрогистологический признак. Внутри клеток видны желтоватые вакуоли, в основном в отростках пре- и постсинаптических нейронов. В данном образце размеры вакуолей варьируют от 20 до 100 мкм.
В 1960-х гг. ученые обнаружили, что болезнетворный агент не содержит нуклеиновых кислот. Тиква Алпер выдвинула гипотезу, согласно которой этим агентом является белок. Вначале эта идея показалась бессмысленной. Все известные к тому времени болезнетворные агенты (вирусы, бактерии, грибы и др.) содержали нуклеиновые кислоты, а их вирулентность была связана с воспроизведением и распространением генетического материала. Но четыре десятка лет исследований, в частности работы Стенли Прузинера, показали, что губчатая энцефалопатия имеет другой механизм.
Болезнь вызывает один-единственный белок с молекулярной массой 28 000, который Прузинер окрестил прионовым белком (от англ. prion — proteinaceous injections only).Прионовый белок (сокращенно РrР) или просто прион является нормальной составляющей мозговой ткани млекопитающих. Его роль в мозге детально не изучена, по-видимому, он выполняет сигнальную функцию. Штаммы мышей, не имеющих гена РrР (следовательно, и самого белка), нс проявляли никаких признаков заболевания.
Болезнь возникает тогда, когда нормальный клеточный РrР (РrРC) принимает иную конформацию, названную РrРSc (Sс означает скрепи). При взаимодействии РrРSr с РrРCпоследний также переходит в аномальную конформацию, инициируя цепную реакцию, в результате которой все большая часть этого белка в мозге переходит в болезнетворную форму. Пока не удалось установить, каким образом наличие РrРSc приводит к развитию губчатой энцефалопатии.
При наследственной форме заболевания мутация гена РrР приводит к замене одного аминокислотного остатка, что, по всей видимости, способствует переходу нормального белка в форму РrРSc. Для полного понимания механизма заболевания необходима дополнительная информация о воздействии приона на работу мозга. Появляющиеся данные о структуре РrР начали проливать свет на те молекулярные процессы, которые лежат в основе взаимодействия прионовых белков и изменения их конформации (рис. 2).
Рис. 2. Структура глобулярного домена РrР человека в мономерной (слева) и димерной формах (справа). Вторая субъединица выделена серым цветом, для того чтобы подчеркнуть те катастрофические изменения конформации α-спирали, изображенной зеленым цветом, которые происходят при образовании димера.
Краткое содержание раздела 4.4 Денатурация и фолдинг белка
■ Трехмерная структура и функции белков могут нарушаться в процессе денатурации, что еще раз демонстрирует связь между структурой и функциями белка. Некоторые денатурированные белки способны самопроизвольно вернуться в биологически активное состояние; это означает, что третичная структура белка определяется его аминокислотной последовательностью.
■ Фолдинг белка в клетке, возможно, протекает по нескольким путям. В первую очередь образуются участки со вторичной структурой, а затем происходит формирование супервторичных структур. Множество вариантов частично свернутых белков быстро принимают единственную нативную конформацию.
■ Фолдингу многих белков способствуют специализированные белки — шапероны Нsр70 и шаперонины. Специальные ферменты катализируют образование дисульфидной связи и цис-транс-изомеризацию пептидной связи в остатках пролина.
■ Аномальное свертывание белка является молекулярной основой целого ряда заболеваний человека, включая амилоидоз.