ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
4. ТРЕХМЕРНАЯ СТРУКТУРА БЕЛКОВ
Вопросы и задачи
1.Свойства пептидной связи.
При рентгеноструктурном анализе кристаллических пептидов Лайнус Полинг и Роберт Кори обнаружили, что связь С—N пептидной группы по длине (1,32 А) занимает промежуточное положение между типичными одинарными С—N (1,49 А) и двойными С=N (1,27 А) связями. Кроме того, они установили, что пептидная группа имеет плоскую конфигурацию, т. е. все четыре атома, присоединенные к С—N-группс, лежат в одной плоскости, причем два атома углерода, связанные с С—N-группой, всегда находятся в трансположении по отношению друг к другу, по разные стороны от пептидной связи.
а) Какой вывод относительно прочности и кратности пептидной связи (является ли она одинарной, двойной или тройной) можно сделать, исходя из ее длины?
б) Что можно сказать о возможности вращения вокруг пептидной С—N-связи на основании данных Полинга и Кори?
2. Связь структуры и функции фибриллярных белков.
Уильям Астбери первым обнаружил, что рентгенограмма шерсти указывает на наличие структурной единицы волокна, повторяющейся с интервалом около 5,2 А. Рентгенограмма шерсти, растянутой после обработки паром, указывала на наличие периодической структуры, повторяющейся через каждые 7,0 А. После того как растянутая при обработке паром шерсть возвращалась в свое исходное состояние, структурная единица вновь повторялась с периодичностью 5,2 А. Хотя эти наблюдения послужили ключом к пониманию молекулярной структуры шерсти, в то время Астбери не смог их интерпретировать.
а) Исходя из современных данных о структуре шерсти, объясните результаты экспериментов Астбери.
б) Если шерстяные вещи стирать в горячей воде или сушить горячим воздухом, они садятся, а с шелком в подобных условиях ничего не происходит. Объясните это явление.
3. Скорость синтеза а-кератина волос.
Волосы растут со скоростью 15— 20 см в год. Зона роста находится у основания волоса, где в клетках эпидермиса синтезируются и скручиваются нити α-кератина (рис. 4-10). Основным структурным элементом α-кератина является α-спираль, виток которой имеет шаг 5,4 А и содержит 3,6 аминокислотных остатка (рис. 4-4, б). Считая, что лимитирующим фактором роста волос является биосинтез спиралей кератина, рассчитайте скорость образования пептидных связей α-кератина (число пептидных связей в секунду), которая обеспечивает наблюдаемый рост волос.
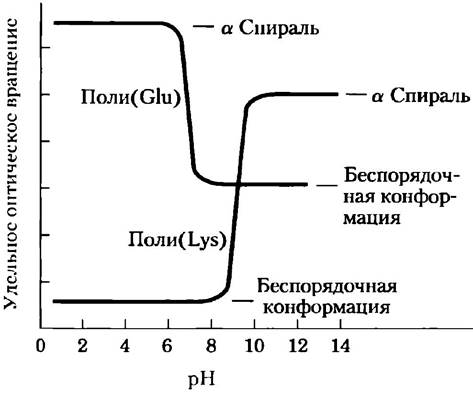
4. Влияние pH на конформацию вторичной α-спиральной структуры.
Разворачивание полипептидной цепи, имеющей α-спиральную структуру, и ее превращение в беспорядочно скрученный клубок сопровождаются сильным снижением удельного оптического вращения, которое является мерой способности раствора вращать плоскополяризованный свет. Поли- глутаминовая кислота (полипептид, состоящий исключительно из остатков L-Glu) при pH 3,0 имеет структуру α-спирали. При повышении pH раствора полиглутаминовой кислоты до 7,0 наблюдается значительное падение удельного оптического вращения. Аналогичным образом, полилизин, состоящий из остатков L-Lys, имеет α-спиральную структуру при pH 10,0, но при снижении pH до 7,0 удельное оптическое вращение его раствора также снижается, как показано на графике.
Как объяснить подобное влияние pH на конформацию полиглутаминовой кислоты и поли- лизина? Почему наблюдаемый переход совершается в таком узком диапазоне pH?
5. Дисульфидные связи определяют свойства многих белков.
В молекулах ряда природных белков содержится много дисульфидных связей, причем механические свойства белков (прочность на разрыв, вязкость, твердость и др.) коррелируют с числом дисульфидных связей. Например, богатый дисульфидными мостиками белок пшеницы глутенин определяет вязкость и эластичность теста, приготовленного из пшеничной муки. Точно так же твердый и прочный панцирь черепахи обязан своими
свойствами сети дисульфидных связей в молекулах α-кератина.
а) Какова молекулярная основа наблюдаемой связи между числом дисульфидных мостиков и механическими свойствами белков?
б) Большинство глобулярных белков денатурируют и теряют активность при кратковременном нагревании до 65 °С. Но для денатурации глобулярных белков, содержащих несколько дисульфидных связей, обычно требуется более длительное нагревание при более высокой температуре. Примером может служить бычий панкреатический ингибитор трипсина, имеющий одну полипептидную цепь из 58 аминокислотных остатков и содержащий три дисульфидных мостика. Если этот белок денатурировать нагреванием, а затем охладить, то его активность восстанавливается. Какова молекулярная основа данного явления?
6. Аминокислотная последовательность и структура белка.
Увеличивающийся объем наших знаний о процессе фолдинга белка позволяет предсказать структуру белка на основании его аминокислотной последовательности.

а) Где в данной аминокислотной последовательности возможно образование изгибов или β-поворотов?
б) Где могут образовываться внутримолекулярные дисульфидные мостики?
в) Если предположить, что данная последовательность является частью более крупного глобулярного белка, то в какой его части (на внешней поверхности или внутри глобулы) будут располагаться следующие аминокислотные остатки: Asp, Ile, Thr, Ala, Gin, Lys? Объясните свои рассуждения. (Подсказка: см. гидропатические индексы в табл. 3-1.)
7. Бактериородопсин — белок пурпурной мембраны.
При благоприятных внешних условиях бактерия Halobacterium halobium, обитающая в соленых водоемах, синтезирует мембранный белок бактериородопсин (Мr = 26 000), имеющий пурпурную окраску благодаря содержащемуся в нем ретиналю (рис. 10-21). Молекулы этого белка образуют в клеточной мембране агрегаты в виде «пурпурных заплаток». Бактериородопсин действует как активируемый светом протонный насос и снабжает клетки энергией. Рентгеноструктурный анализ белка показал, что он состоит из семи параллельно расположенных а-спиральных участков, каждый из которых пересекает мембрану бактериальной клетки (толщина мембраны 45 А). Определите минимальное число аминокислотных остатков, необходимое для образования α-спирального участка, способного полностью пронизывать мембрану. Оцените долю аминокислотных остатков бактериородопсина, задействованных в образовании α-спиралей (считайте, что средняя молекулярная масса аминокислотного остатка равна 110).
8. Терминология в области структуры белка.
Миоглобин — это мотив, домен или завершенная трехмерная структура?
9. Патогенное действие бактерий, вызывающих газовую гангрену.
Патогенная анаэробная бактерия Clostridium perfringens является возбудителем газовой гангрены, при которой происходит разрушение тканей. Данная бактерия секретирует фермент, эффективно катализирующий гидролиз пептидной связи, обозначенной на схеме красным цветом:
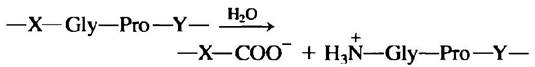
где X и Y — это любые из 20 обычных аминокислот. Каким образом этот фермент помогает бактерии проникнуть в ткани человека? Почему фермент не повреждает саму бактерию?
10. Число полипептидных цепей в олигомерном белке.
Образец (m = 660 г) олигомерного белка с Мr — 132 000 обработали избытком 2,4-динитро- фторбензола в слабощелочной среде до завершения химической реакции. Затем пептидные связи белка подвергли полному гидролизу под
действием соляной кислоты при нагревании. В гидролизате обнаружено 5,5 мг вещества следующего строения:
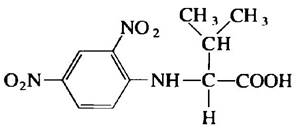
Никаких других 2,4-динитрофенильных производных аминокислот не было обнаружено.
а) Объясните, как на основании данной информации можно определить число полипептидных цепей в олигомерном белке.
б) Определите число полипептидных цепей белка.
в) Какие другие методы анализа помогли бы вам определить, являются ли полипептидные цепи данного белка идентичными или различаются?
11. Предсказание вторичной структуры.
Какой из указанных ниже пептидов с наибольшей вероятностью образует α-спиральную структуру и почему?
(а) LKAENDEAARAMSEA
(б) CRAGGFPWDQPGTSN
12. Амилоидные волокна и болезни человека.
Выяснилось, что некоторые небольшие ароматические молекулы, такие как фенол красный (использующийся в качестве модельного нетоксичного лекарства), в лабораторных модельных системах ингибируют образование амилоида. Свойства таких небольших ароматических соединений изучают с целью создания лекарственных средств, которые могли бы эффективно ингибировать образование амилоида в головном мозге пациентов, страдающих болезнью Альцгеймера.
а) Почему молекулы с ароматическими группами могли бы препятствовать образованию амилоида?
б) Некоторые исследователи полагают, что лекарство, применяемое для лечения болезни Альцгеймера, могло бы оказаться полезным и для лечения сахарного диабета II типа (диабета взрослых). Почему одно и то же лекарство могло бы оказаться эффективным для лечения двух столь разных заболеваний?
Биохимия в Интернете
13. Моделирование белков.
У группы пациентов, страдающих болезнью Крона (воспалительное заболевание кишечника), для выяснения причины заболевания была проведена биопсия слизистой кишечника. Был идентифицирован белок, уровень экспрессии которого у пациентов с болезнью Крона выше, чем в контрольной группе здоровых людей. Белок был выделен, а также была частично определена его амнокислотная последовательность (следует читать слева направо):

а) С помощью имеющихся в Интернете баз данных сможете определить, что это за белок. Для начала используйте такие ресурсы, как Protein Information Resource (PIR, pir.georgetown. edu piruwv), Structural Classification of Proteins P, http://scop.berkelcy.edu) и Prosite (http:// im xpasy.org/prosite).
На выбранном вами сайте найдите страницу, проводится сравнение аминокислотных послевательностей. Введите около 30 аминокислот приведенной здесь последовательности и проведите анализ. Что проведенный анализ говори вам о данном белке?
б) Проведите анализ, вводя различные участки последовательности. Получаете ли вы один и же результат?
в) Существует множество Интернет-сайтов, содержащих информацию о трехмерной струкре белков. Найдите информацию о вторичной, третичной и четвертичной структурах данного пользуясь такими банками данных, как (www.rcsb.org/pdb) или SCOP.
г) В процессе поиска информации о структуре белка попытайтесь также узнать и о его функции в клетке.
Анализ экспериментальных данных
14. «Зеркальные» белки.
Как отмечалось в гл. 3, аминокислотные остатки в молекуле белка представляют собой исключительно L-стереоизомеры. Пока неясно, является эта особенность необходимым условием для нормального функционирования белка или случайным эволюционным событием. Для разъяснения этого вопроса Милтон с коллегами (1992) предприняли работу, посвященную изучению фермента, целиком построенного из D-стереоизомеров аминокислот. Ими был выбран фермент ВИЧ-протеаза — протеолитический фермент ВИЧ, который превращает неактивную форму вирусных белков в активную.
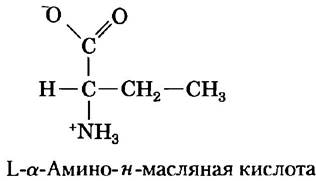
Ранее Влодауер с коллегами (1989) осуществил полный химический синтез ВИЧ-протеазы из L-аминокислот в соответствии со схемой, изображенной на рис. 3-29. Нормальная ВИЧ- протеаза имеет два остатка цистеина — в позициях 67 и 95. Химический синтез белков, содержащих цистеин, довольно сложно осуществить технически, поэтому два остатка Cys были заменены остатками синтетической L-α-амино-н-масляной кислоты (Aba). Авторы объясняли, что их целью было «уменьшить сложность синтеза, связанную со снятием защиты с остатков Cys, и облегчить работу с полученным продуктом».
а) Ниже представлена структура Aba. Почему эта кислота явилась подходящей заменой цистеину? При каких условиях она не была бы подходящей заменой?
Влодауер с сотрудниками подвергли синтезированный белок денатурации, растворив его в 6 М гуанидин-НС1, а затем вновь позволили ему сворачиваться в условиях диализа против нейтрального буфера (10% глицерин, 25 мМ NаН2РO4, pH 7).
б) Можно привести множество причин, по которым синтезированный, денатурированный и свернутый таким образом белок не будет обладать активностью. Приведите три такие причины.
в) Интересно, что образовавшаяся L-протеаза была активна. Что этот факт может сказать о роли дисульфидных связей в нативной молекуле ВИЧ-протеазы?
В новой работе Милтон с сотрудниками синтезировали ВИЧ-протеазу из D-аминокислот, используя тот же протокол, что и в ранней работе. Формально существует три варианта укладки D-протеазы: 1) та же форма укладки, что и в случае L-протеазы; 2) зеркальное отражение L-протеазы; 3) какая-то другая форма укладки, возможно, приводящая к неактивному белку.
г) Рассмотрите каждую возможность и объясните, насколько с вашей точки зрения она вероятна.
На самом деле, D-протеаза оказалась активной: она расщепляла синтетический субстрат и ингибировалась специфическим ингибитором. Для изучения структуры L- и D-ферментов Милтон с сотрудниками проанализировали их активность по отношению к D- и L-формам хиральных пептидных субстратов, а также ингибирование D- и L-формами хиральных ингибиторов, являвшихся аналогами субстратов. Кроме того, обе формы фермента подвергли ингибированию ахиральным ингибитором — синим красителем Эванса. Результаты эксперимента представлены в таблице.
Ингибир |
ование |
||
Гидролиз субстрата |
Пептидный ингибитор |
Синий краситель |
|
ВИЧ- протеаза |
D- L- субстрат протеаза |
D-ин- L-ингибитор гибитор |
Эванса (ахиральный) |
L-протеаза |
- + |
+ |
+ |
D-протеаза |
+ - |
+ - |
+ |
д) Какая из предложенных выше моделей подтверждается этими результатами? Объясните свой ответ.
е) Почему синий краситель Эванса ингибировал обе формы фермента?
ж) Как вы думаете, будет ли химотрипсин расщеплять D-протеазу? Почему?
з) Можно ли полностью осуществить синтез любого белка и его ренатурацию, исходя из D-аминокислот? Почему?