ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
7. УГЛЕВОДЫ И ГЛИКОБИОЛОГИЯ
7.4. Углеводы как информационные молекулы: код сахаров
Гликобиология изучает структуру и функции гликоконъюгатов; сегодня эта наука является одной из наиболее активно развивающихся и удивительных областей биохимии и клеточной биологии. Уже понятно, что клетки используют специфические олигосахариды для кодирования важной информации, касающейся внутриклеточного транспорта белков, межклеточных взаимодействий, развития тканей и передачи внеклеточных сигналов. Мы обратимся лишь к нескольким примерам, иллюстрирующим разнообразие структуры и диапазон биологической активности гликоконъюгатов. В гл. 20 мы обсудим детали биосинтеза полисахаридов, в том числе пептидогликанов, а в гл. 27 — механизмы сборки олигосахаридных цепей в гликопротеинах.
Совершенствование методов анализа структуры олигосахаридов и полисахаридов позволило выявить удивительную сложность и разнообразие олигосахаридных цепей в гликопротеинах и гликолипидах. Взгляните на типичные олигосахариды гликопротеинов, изображенные на рис. 7-29. Наиболее сложный из них содержит 14 моносахаридных остатков четырех видов, связанных между собой связями 1 —> 2, 1 —> 3, 1 —> 4, 1 —> 6, 2 —> 3 и 2 —> 6, некоторые из связей имеют α-, а другие — β-конфигурацию. В олигосахаридах довольно распространены разветвленные структуры, не встречающиеся в нуклеиновых кислотах и белках. Если предположить, что для образования олигосахарида может быть использовано 20 различных моносахаридных звеньев (что вполне возможно), то расчетное число гесксамерных олигосахаридов составит 1,44 • 1015. В то же время количество гексапептидов, построенных из 20 аминокислот, составляет 6,4 • 107 (206), а количество гексануклеотидов, построенных из четырех нуклеотидных звеньев, составляет 4096 (46). Если, кроме того, учесть возможность сульфатирования остатков сахаров, то полученная цифра вырастет еще на два порядка. Олигосахариды необычайно богаты структурной информацией; ее объем не только сравним, но намного превосходит объем информации, содержащейся в молекуле нуклеиновой кислоты среднего размера. Каждый из олигосахаридов, изображенных на рис. 7-29, характеризуется уникальной пространственной структурой «сахарным кодом», который умеют расшифровывать взаимодействующие с ними белки.
Лектины — белки, «читающие» код сахаров и участвующие во многих биологических процессах
Лектины, обнаруженные во всех организмах, представляют собой белки, которые с чрезвычайно высоким сродством и специфичностью связываются с определенными углеводами (табл. 7-3). Лектины принимают участие во многих процессах узнавания, передачи сигнала и адгезии клеток, а также во внутриклеточном транспорте вновь синтезированных белков. В лаборатории, очищенные лектины используют для обнаружения и разделения гликопротеинов с различными олигосахаридными цепями. Здесь мы остановимся лишь на нескольких примерах, иллюстрирующих значение лектинов в животной клетке.
Таблица 7-3. Некоторые лектины и их олигосахаридные лиганды
Лектин и его источник |
Сокращенное обозначение |
Лнганд(ы) |
Растения |
||
Конканавалин А |
Соn А |
Маnα1-ОСH3. |
Лектин 4 из Griffonia simplicifolia |
GS4 |
Тетрасахарид Lewis b (Lеh) |
Агглютинин зародышей пшеницы |
WCA |
Neu5Ас (α2 —> 3) Gal (β1 —> 4) Glс GlсNАс (β1 —> 4) GlсNАс |
Рицин |
Gal (β1—> 4) Glc |
|
Животные |
||
Галектин-1 |
Gal (β1 —> 4) Glc |
|
Маннозоснязывающий белок А |
МBР-А |
Богатый маннозой октасахарид |
Вирусы |
||
Гемагглютинин вируса гриппа А |
НА |
Neu5Ас (α2 —> 6) Gal (β1—> 4) Glс |
Белок вируса полиомы 1 |
VР1 |
Neu5Ас (α2 —> 3) Gal (β1 —> 4 ) Gle |
Бактерии |
||
Эитеротоксин |
LT |
Gal |
Токсин холеры |
СТ |
Пентасахарид GM1 |
Некоторые циркулирующие в крови пептидные гормоны содержат остатки сахаров, определяющие время их жизни. Лютеинизирующий и тиреотропный гормоны (полипептидные гормоны коры надпочечников) содержат присоединенные N-гликозидной связью олигосахариды, имеющие на конце дисахарид GаlNАс4S (β1—> 4) GlсNАс, который узнается лектином (рецептором) гепатоцитов (GаlNАс4S это N-ацетилгалактозамин, сульфатированный по ОН-группе атома С-4). Взаимодействие рецептора с гормоном регулирует захват и разрушение лютеинизирующего и тиреотропного гормонов и, следовательно, их концентрацию в крови. Таким образом, уровень этих гормонов в крови то повышается в результате секреции надпочечниками, то падает в результате постоянного разрушения в гепатоцитах.
Остатки сиаловой кислоты (Nеu5Ас), расположенные на концах олигосахаридных цепей многих гликопротеинов плазмы крови (рис. 7-29), защищают эти белки от разрушения в печени. Например, медьсодержащий сывороточный гликопротеин церулоплазмин имеет несколько олигосахаридных цепей с Nеu5Ас на конце. Удаление остатков сиаловой кислоты ферментом сиалидазой (другое название нейраминидаза) используется клеткой для мечения «старых» белков, которые необходимо уничтожить и заменить другими. Плазматическая мембрана гепатоцитов содержит молекулы лектинов, называемых рецепторами асиалогликопротеинов (т. е. десиалированных гликопротеинов). Эти рецепторы способны специфическим образом связывать олигосахаридные цепи, в которых остатки галактозы больше не защищены концевым остатком Nеu5Ас. Взаимодействие рецептора с церулоплазмином приводит к эндоцитозу и уничтожению церулоплазмина.
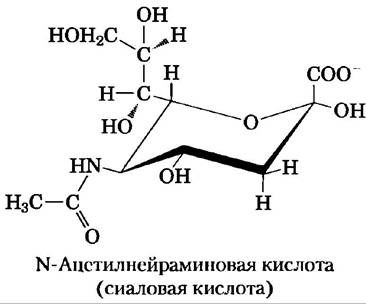
По всей видимости, похожий механизм применяется в организме млекопитающих для удаления из кровотока старых эритроцитов. Молодые эритроциты несут на себе несколько мембранных гликопротеинов с олигосахаридными цепями, заканчивающимися Neu5Ac. Если в эксперименте in vitro удалить остатки сиаловой кислоты из образца крови с помощью сиалидазы, а затем возвратить эту кровь в циркуляцию, то подвергшиеся такой процедуре эритроциты исчезают за несколько часов. Эритроциты с интактными олигосахаридными цепями (те, что были отобраны и возвращены в кровоток без обработки сиалидазой) циркулируют в организме еще несколько дней.
Лектины клеточной поверхности играют важную роль в развитии некоторых заболеваний человека, причем это относится как к лектинам человека, так и к лектинам инфицирующего агента. Селектинами называют лектины плазматической мембраны, обеспечивающие узнавание и адгезию клеток в широком спектре клеточных процессов. Одним из таких процессов является перемещение клеток иммунной системы (нейтрофилов) из крови через стенку капилляра к воспаленным или инфицированным участкам тканей (рис. 7-31). В инфицированном участке Р-селектин, расположенный на поверхности эндотелиальной клетки капилляра, взаимодействует с определенным олигосахаридом гликопротеина циркулирующего нейтрофила. Это взаимодействие замедляет движение нейтрофила и заставляет его «перекатываться» по эндотелию капилляра. Далее происходит взаимодействие между молекулами интегрина (с. 641) на плазматической мембране нейтрофила и адгезионным белком на поверхности эндотелия. Это взаимодействие окончательно останавливает передвижение нейтрофила и позволяет ему проникнуть сквозь стенку капилляра к инфицированной ткани, чтобы начать иммунную атаку. В описанном процессе (так называемом хоуминге лимфоцитов) участвуют еще два типа селектинов: Е-сслектины па эндотелиальных клетках и Е-селектины на нейтрофилах связывают определенные олигосахариды соответственно на нейтрофилах и клетках эндотелия.
Рис. 7-31. Взаимодействия лектинов с лигандами при миграции лимфоцитов к местам воспаления или повреждения. Движение нейтрофила в капилляре замедляется в результате краткосрочных взаимодействий между молекулами Р-селектина на плазматических мембранах эпителиальных клеток капилляра и лигандами Р-селектина на поверхности нейтрофила. По мере взаимодействия нейтрофила с расположенными на поверхности эпителия молекулами Р-селектина его «перекатывание» по стенке капилляра замедляется. В области воспаления более сильное взаимодействие между интегринами на поверхности капилляра и их лигандами на нейтрофиле полностью тормозит движение нейтрофила. Под влиянием сигналов от места воспаления происходит экстравазация — нейтрофил проходит сквозь стенку капилляра к месту воспаления.
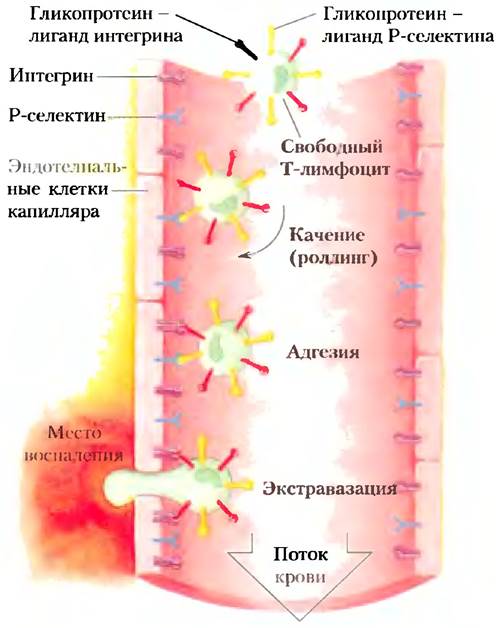
Селектины человека участвуют в формировании воспалительного процесса при ревматоидном артрите, астме, псориазе, рассеянном склерозе и отторжении трансплантированных органов. С этим связана острая необходимость создания лекарств, ингибирующих адгезию клеток, опосредованную селектинами. Многие клетки карциномы экспрессируют антиген, который в норме присутствует только на клетках плода (сиалил-Льюис х, или сиалил-Lex), а при попадании в циркулирующую кровь способствует распространению раковых клеток и метастазированию. Углеводные производные, имитирующие сиалил-Lex в составе сиалогликопротеинов, а также те, что изменяют путь биосинтеза олигосахаридов, могут оказаться эффективными лекарственными препаратами для лечения хронических воспалительных заболеваний или для борьбы с метастазами при раке.
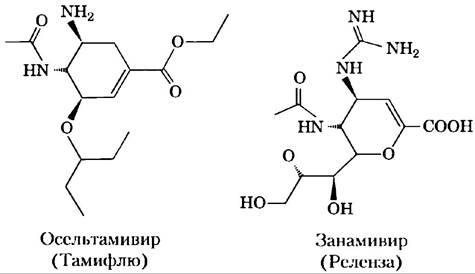
Некоторые вирусы животных, в том числе вирус гриппа, прикрепляются к клеткам хозяина с помощью олигосахаридов, находящихся на поверхности клеток. Лектин вируса гриппа, известный как белок НА (гемагглютенин), играет важную роль в проникновении вируса и развитии инфекции. После того как вирус проник в клетку хозяина и реплицировался, новосинтезированные вирусные частицы выходят из клетки, обернутые кусочками ее плазматической мембраной. Вирусная сиалидаза (нейраминидаза) удаляет концевой остаток сиаловой кислоты с олигосахаридов на поверхности клетки хозяина, освобождая вирусные частицы от клетки и препятствуя их слипанию друг с другом. После этого начинается новая стадия заражения. Для лечения гриппа применяют противовирусные препараты осельтамивир (тамифлю) и занамивир (реленза). Эти лекарства — производные сахаров; они ингибируют вирусную сиалидазу, конкурируя за связывание с олигосахаридами клетки хозяина. Это предотвращает высвобождение вирусов из зараженной клетки и заставляет вирусные частицы слипаться, таким образом блокируя следующую стадию инфекции.
Первой стадией инфекционного цикла вирусов простого герпеса HSV-1 и HSV-2 (возбудители герпеса ротовой полости и гениталий соответственно) является специфическое связывание их лектинов с гепарансульфатом на поверхности клеток хозяина, причем для развития инфекции необходим правильный порядок расположения сульфатных групп в этом полимере.
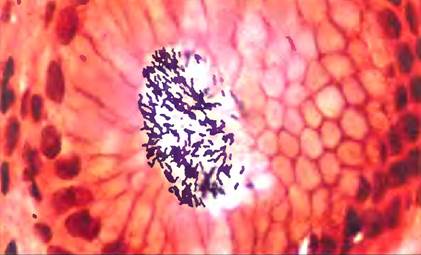
С помощью лектинов некоторые патогенные микробы прикрепляются к клеткам хозяина или вводят в них свой токсин. Причиной развития большинства случаев язвенной болезни желудка, как показали в 1980-х гг. Барри Дж. Маршалл и Дж. Робин Уоррен, является бактерия Helicobacter pylori, которая прикрепляется к внутренней стенке желудка путем взаимодействия между лектинами на бактериальной оболочке и специфическими олигосахаридами в мембранных гликопротеинах эпителия желудка (рис. 7-32). Одним из участков узнавания Н. pylori служит олигосахарид Leb — фрагмент детерминанты группы крови 0. Этот факт помогает объяснить, почему язва желудка в несколько раз чаще возникает у людей с группой крови 0, чем у людей с группами крови А или В. Для лечения данных заболеваний могут оказаться полезными аналоги Leb, синтезированные химическим путем. Конкурируя с гликопротеинами желудка за связывание с бактериальными лектинами, они способны предотвратить адгезию бактерии и, следовательно, развитие инфекции.

Рис. 7-32. Образование язвы желудка. Клетки Helicobacter pylori, прикрепившиеся к стенке желудка. Язва возникает в результате взаимодействия бактериального лектина и олигосахарида Leb (антигена группы крови 0) на поверхности эпителия желудка.
Некоторые наиболее тяжелые паразитарные инфекционные заболевания человека, распространенные в основном в развивающихся странах, вызываются эукариотическими микроорганизмами, имеющими на своей поверхности необычные олигосахариды, которые в некоторых случаях исполняют в клетках паразитов защитную функцию. Среди этих организмов можно назвать трипаносомы, ответственные за африканскую сонную болезнь и болезнь Шагаса, Plasmodium falciparum, вызывающую малярию, и Entamoebahistolytica, являющуюся причиной возникновения амебной дизентерии. В связи с поиском лекарств, останавливающих синтез этих необычных олигосахаридных цепей и репликацию паразитов, был предпринят целый ряд исследований, посвященных путям биосинтеза этих олигосахаридов.
Холерный токсин, вырабатываемый Vibrio cholerae, проникает в клетки кишечника, отвечающие за всасывание воды, и вызывает диарею. Токсин связывается с клетками-мишенями через олигосахарид ганглиозида GM1 — мембранного фосфолипида на поверхности кишечного эпителия (структура GM1 изображена в доп. 10-2,
рис. 1). Аналогичным образом токсин, вырабатываемый возбудителем коклюша Bordetella pertussis, проникает в клетки-мишени только после взаимодействия с одним или, возможно, несколькими олигосахаридами, имеющими на конце цепи остаток сиаловой кислоты. Знание точной структуры участков связывания олигосахаридов в этих токсинах (лектинах) может помочь в создании генно-инженерных аналогов токсинов для вакцинации. Генно-инженерные аналоги токсинов, не имеющие участка связывания углеводов, безопасны для человека, поскольку не могут связываться с клеткой и проникать внутрь, но могут вызывать иммунный ответ, который предохранил бы человека от последующего воздействия природного токсина. Возможно также представить себе лекарство, которое имитирует олигосахариды клеточной поверхности, связывается с бактериальными лектинами и предотвращает их продуктивное связывание с поверхностью клетки.
Лектины проявляют свою активность и внутри клетки. В аппарате Гольджи олигосахарид, содержащий маннозо-6-фосфат, метит вновь синтезированные белки, которые предназначены для транспортировки в лизосомы (рис. 27-39). Общая структурная черта этих гликопротеинов — своеобразный сигнальный участок — обеспечивает их узнавание ферментом, фосфорилирующим остаток маннозы на конце олигосахаридной цепи. Образующийся в результате остаток маннозо-6-фосфата узнается катион-зависимым маннозофосфатным рецептором, представляющим собой мембраносвязанный лектин, который имеет центр связывания маннозофосфата на люменальной поверхности аппарата Гольджи. Когда участок аппарата Гольджи, содержащий этот рецептор, отпочковывается, образуя транспортную везикулу, белки с маннозофосфатными остатками затягиваются в формирующуюся везикулу в результате взаимодействия между маннозо-6-фосфатом и его рецептором. Затем везикулы сливаются с лизосомами и высвобождают свое содержимое. Многие, если не все, гидролитические ферменты лизосом захватываются и переносятся именно по такому механизму. Некоторые рецепторы маннозо-6- фосфата могут захватывать ферменты, содержащие остатки маннозо-6-фосфата, и направлять их в лизосомы. Этот процесс лежит в основе «заместительной ферментативной терапии», целью которой является коррекция нарушений, связанных с активностью лизосом у человека. ■ Кроме того, лектины участвуют в других процессах, связанных с сортировкой белков. Любой вновь синтезированный белок в эндоплазматическом ретикулуме уже связан с определенным олигосахаридом, который может быть присоединен с помощью одного из двух лектинов ЭР (одновременно являющихся шаперонами): мембраносвязанного кальнексина и находящегося в растворе кальретикулина. Эти лектины связывают новый белок с ферментом, который осуществляет быстрый дисульфидный обмен в процессе укладки белка, в конечном итоге приводящий к образованию нативной конформации. В этот момент ферменты в ЭР обрабатывают олигосахаридные остатки таким образом, чтобы они узнавались другим лектином, ЕRGIC53, который направляет сформированный белок (гликопротеин) в аппарат Гольджи для дальнейшего созревания. Если белок упакован неверно, олигосахариды обрабатываются иным образом и узнаются лектином ЕDЕМ, который направляет аномально упакованный белок в цитозоль, где тот уничтожается. Таким образом, гликозилирование белков в ЭР служит определенным сигналом, позволяющим клетке элиминировать неправильно сформированные белки (более подробно этот процесс обсуждается в гл. 27).
Взаимодействие лектина с углеводом очень прочное и высокоспецифичное
Во всех описанных выше функциях лектинов и во многих других, связанных со взаимодействиями между лектинами и олигосахаридами, важна уникальная структура олигосахарида, обеспечивающая высокую специфичность взаимодействия. Информация, содержащаяся в олигосахаридах, выражается в виде своеобразного кода с практически бесконечным набором коротких «слов», распознаваемых отдельными белками. Центры связывания олигосахаридов в молекулах лектинов комплементарны строго определенным углеводным последовательностям, в результате чего взаимодействие лектинов с олигосахаридами отличается чрезвычайно высокой специфичностью. Сродство олигосахарида к каждому углевод- связывающему домену лектина часто невелико (значения Кd находятся в микромолярном диапазоне), однако эффективное сродство многократно усиливается за счет мультивалентности лектинов, поскольку каждая молекула лектина имеет множество углевод-связывающих доменов. В кластерах олигосахаридов (которые обычно образуются на поверхности мембраны), например, каждый олигосахарид может связаться с одним из углевод- связывающих доменов лектина, усиливая взаимодействие. Если па поверхности клетки существует множество рецепторов, авидность взаимодействия может быть очень высокой и обеспечивать такие высококооперативные процессы, как прикрепление и перекатывание клеток (см. рис. 7-31).
Рентгеноструктурный анализ некоторых комплексов лектинов с углеводами позволил в деталях изучить особенности этих взаимодействий (рис. 7-33). Семейство из 11 лектинов, которые связывают олигосахаридные цепи, оканчивающиеся на остаток сиаловой кислоты, выполняет в организме человека несколько важных биологических функций. Все эти лектины связывают сиаловыс кислоты в доменах со структурой ß-сэндвича, подобных тем, что обнаружены в иммуноглобулинах (этот мотив изображен в белке CD8 на рис. 4-21). Все члены семейства носят название siglec (sialic acid-recognizing Ig- superfamily lectins) и имеют номера от 1 до 11; иногда иначе их называют сиалоадгезинами. Во взаимодействии siglec с сиаловой кислотой (N-ацетилнейраминовой кислотой, Neu5Ac) участвуют все заместители в кольце Neu5Ac: ацетогруппа у атома С-5 участвует в образовании водородных связей и ван-дер-ваальсовых взаимодействиях с белком, карбоксильная группа образует солевой мостик с консервативным остатком Arg, а гидроксильные группы остатка глицерина — водородные связи с белком. Лектины siglecs регулируют процессы в иммунной и нервной системе, а также участвуют в развитии клеток крови. Например, siglec-7 связывается со специфическим ганглиозидом (GD3), содержащим два остатка сиаловой кислоты, и подавляет активность естественных клеток-киллеров (NK-клеток), оберегая тем самым клетки, которые должны уничтожаться иммунной системой. Повышение уровня GD3 при некоторых раковых заболеваниях, таких как злокачественная меланома и нейробластома, возможно, позволяет раковым клеткам преодолеть защитный механизм иммунной системы.
Рис. 7-33. Подробности взаимодействия лектина с углеводом, а) Рецептор маннозо-6- фосфата быка с маннозо-6-фосфатом (PDB ID 1М6Р) на поверхности; цветом обозначено распределение электрического заряда: красные области преимущественно заряжены отрицательно, синие — преимущественно положительно. Молекула маннозо-6-фосфата изображена в виде стержневой структуры; ион марганца выделен фиолетовым цветом, б) Центр связывания в увеличенном виде. Маннозо-6-фосфат образует водородную связь с остатком Arg111и координационную связь с ионом Мn2+ (для ясности показан меньшего размера, чем ван-дер-ваальсовый радиус). Остаток His105 образует водородную связь с одним из атомов кислорода в фосфатной группе. Возможно, протонирование этого остатка при более низком значении pH в лизосоме приводит к высвобождению маннозо-6-фосфата рецептором.
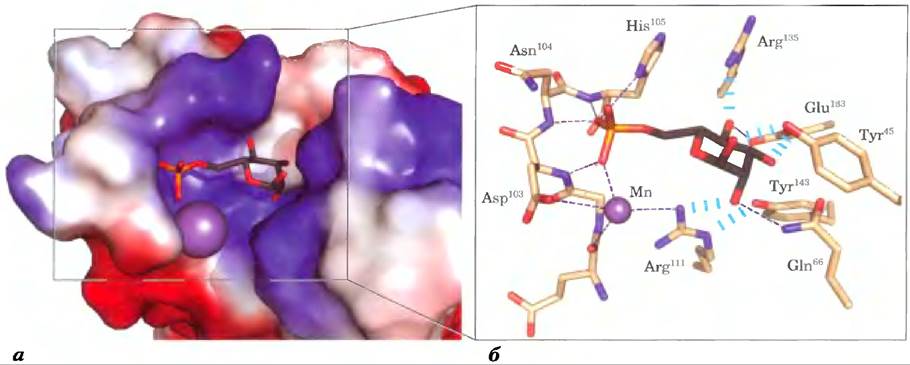
Структура другого лектина — рецептора маннозо-6-фосфата — тоже была определена методом РСА. Удалось выяснить детали взаимодействия этого лектина с маннозо-6-фосфатом, объяснить специфичность связывания и необходимость участия в этом взаимодействии двухвалентного катиона (рис. 7-33, а). Остаток Arg111 в молекуле рецептора образует водородную связь с гидроксильной группой у атома С-2 в остатке маннозы, координированном с помощью иона Мn21. Остаток His105 образует водородную связь с одним из атомов кислорода в фосфатной группе (рис. 7-33, б). При попадании белка, связанного с маннозо-6- фосфатом, в л изосому, где значение pH ниже, чем в аппарате Гольджи, сродство рецептора к маннозо- 6-фосфату снижается. Причиной этого, возможно, является протонирование остатка His105.
Кроме названных специфических взаимодействий существуют и более общие взаимодействия, которые также вносят вклад в связывание многих углеводов с соответствующими лектинами. Например, многие остатки сахаров имеют более полярную и менее полярную стороны (рис. 7-34). Более полярные участки образуют водородные связи с лектином, а менее полярные участвуют в гидрофобных взаимодействиях с неполярными аминокислотными остатками белка. Результатом всех этих взаимодействий становится высокое сродство (часто Кd ≤10-8 М) и высокая специфичность связывания. В этом состоит один из возможных способов передачи информации, который оказывается ключевым во многих внутриклеточных процессах и взаимодействиях между клетками. На рис. 7-35 представлены некоторые биологические процессы, в которых сахара выступают как носители информации.
Рис. 7-34. Гидрофобные взаимодействия остатков сахаров. Мономерные звенья сахаров, таких как галактоза, имеют более полярную сторону (в верхней части кресла, где расположены кислород кольца и гидроксильные группы), участвующую в образовании водородных связей с лектином, и менее полярную сторону, которая может участвовать в гидрофобных взаимодействиях с неполярными аминокислотными остатками, такими как индольное кольцо триптофана.
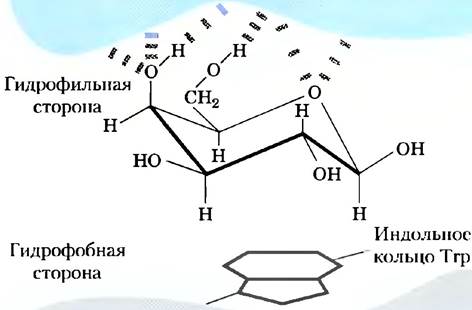
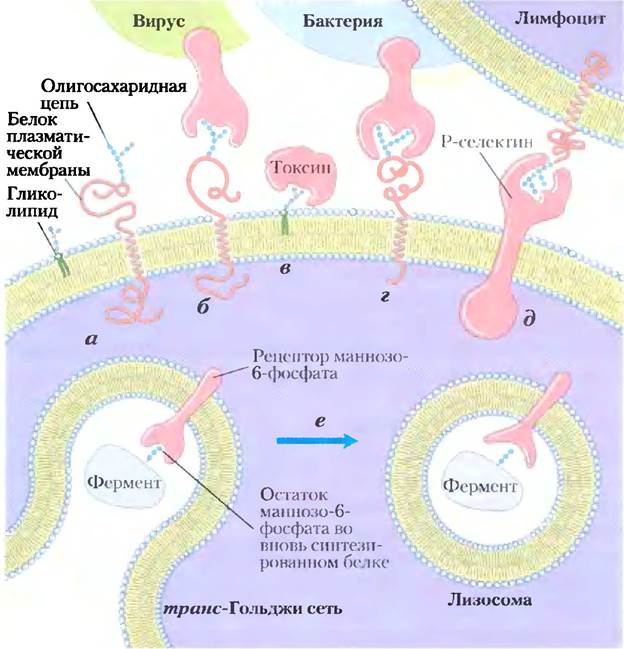
Рис. 7-35. Участие сахаров в процессах узнавания и адгезии на поверхности клеток. а) Олигосахариды с уникальной структурой (изображены в виде последовательности шестичленных колец), входящие в состав различных гликопротеинов или гликолипидов на внешней поверхности плазматической мембраны, с высоким сродством и специфичностью взаимодействуют с внеклеточными лектинами, б) Инфицирующие клетки животных вирусы, такие как вирус гриппа, на первой стадии инфекционного цикла связываются с гликопротеинами на поверхности клетки, в) Бактериальные токсины (например холеры или коклюша) для проникновения в клетку связываются с гликолипидом на клеточной поверхности, г) Некоторые бактерии (в частности, Helicobacter pylori) прикрепляются к клетке хозяина, а затем колонизируют или инфицируют ее. д) Селектины (лектины) в плазматической мембране некоторых клеток выступают в качестве посредников в межклеточных взаимодействиях, в частности во взаимодействии Т-лимфоцитов с эндотелиальными клетками капилляров в участке воспаления. е) Рецептор маннозо-6-фосфата (маннозосвязывающий лектин) в транс-Гольджи сети связывается с олигосахаридом лизосомального фермента и способствует его переносу в лизосому.
Краткое содержание раздела 7.4 Углеводы как информационные молекулы: код сахаров
■ Моносахариды могут быть организованы в виде почти бесконечного разнообразия сочетаний олигосахаридов, которые различаются по стереохимии и положению гликозидной связи, типу и ориентации заместителей, числу и типу разветвлений. Олигосахариды несут в себе гораздо больше информации, чем молекулы нуклеиновых кислот или белков.
■ Лектины — белки со специфическими углевод-связывающими участками — обычно располагаются на внешней поверхности клетки, где инициируют взаимодействия с другими клетками. Лектины позвоночных по олигосахаридным «ярлыкам» узнают некоторые пептидные гормоны, циркулирующие белки плазмы и клетки крови и регулируют их уничтожение.
■ Прикрепление патогенных вирусов, бактерий и некоторых эукариотических паразитов к клеткам организма-хозяина происходит через связывание лектинов на клетках патогенов с олигосахаридами на поверхности клеток хозяина.
■ Внутриклеточные лектины участвуют в доставке внутриклеточных белков к определенным органеллам или к месту их секреции.
■ Рентгеноструктурный анализ позволил детально изучить комплексы лектинов с сахарами и установить комплементарность этих молекул, объясняющую прочность и специфичность их взаимодействий.