ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
8. НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ
8.3. Химия нуклеиновых кислот
Роль ДНК как хранилища генетической информации зависит от стабильности молекулы. Химические превращения, которые с ней происходят, в отсутствие катализа протекают обычно очень медленно. Длительное хранение информации без ее изменения очень важно для клетки, а поэтому даже несколько медленных реакций, которые могут изменить структуру ДНК, имеют важное физиологическое значение. Такие процессы, как образование раковых опухолей или старение, возможно, непосредственно связаны с медленным накоплением необратимых изменений ДНК. Другие, безвредные, изменения, которые могут происходить с ДНК, необходимы для ее функционирования, например, разделение цепей, которое предшествует репликации ДНК или ее транскрипции. Помимо углубления понимания физиологических процессов, изучение химии нуклеиновых кислот позволяет освоить множество методов, применяемых в молекулярной биологии, медицине и судебной медицине. Далее мы рассмотрим химические свойства ДНК и некоторые аспекты их практического применения.
Двойная спираль ДНК и РНК может денатурировать
Растворы бережно выделенных природных ДНК при pH 7,0 и комнатной температуре (25 °С) обладают высокой вязкостью. Когда такие растворы помещают в условия с экстремальными значениями pH или с температурой выше 80 °С, их вязкость резко понижается, что свидетельствует о том, что ДНК подвергается физическим изменениям. Как и глобулярные белки, которые денатурируют при действии на них высоких температур и экстремальных значений pH, так и двойная спираль ДНК подвергается денатурации, или плавлению. Разрушение водородных связей и стекинговых взаимодействий между основаниями вызывает разворачивание двойной спирали с образованием двух одиночных цепей, полностью отделенных друг от друга вдоль всей длины или какого-то участка (частичная денатурация). Ни одна ковалентная связь в ДНК не разрушается (рис. 8-26).
Рис. 8-26. Обратимая денатурация и отжиг (ренатурация) ДНК.
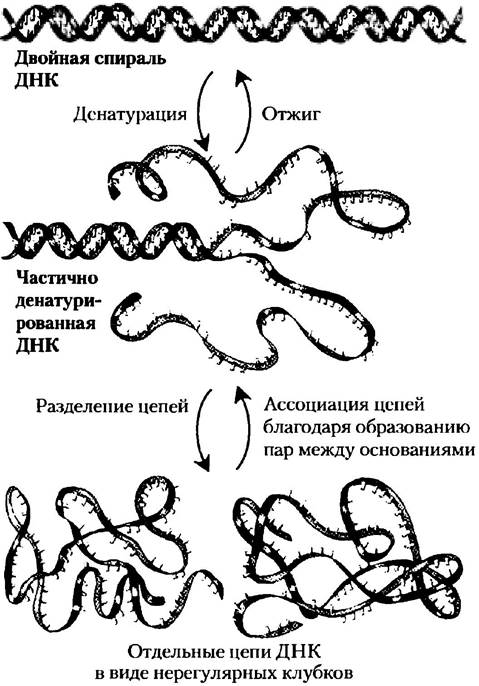
Если две цени все еще образуют сегмент двойной спирали, содержащий 10 или более остатков, то ренатурация молекулы ДНК представляет собой быстрый процесс в одну стадию. Когда температура или pH возвращается к физиологической норме, несвязанные участки двух цепей спонтанно собираются (отжигаются) и снова образуется исходный дуплекс (рис. 8-26). Если две цепи полностью разделены, ренатурация происходит в две стадии. На первой, более медленной, две цепи при случайных флуктуациях «находят» друг друга и формируют короткий сегмент комплементарной двойной спирали. Вторая стадия протекает значительно быстрее: оставшиеся распаренные основания соединяются в пары оснований, и две цепи связываются друг с другом с образованием двойной спирали.
Тесные контакты между соседними основаниями в одной цени нуклеиновой кислоты приводят к тому, что поглощение УФ-излучения по сравнению с раствором, содержащим ту же концентрацию нуклеотидов, уменьшается; еще меньшее поглощение наблюдается при соединении двух комплементарных цепей нуклеиновых кислот. Это называется гипохромным эффектом. При денатурации двойной спирали наблюдается противоположный результат: увеличение поглощения называется гиперхромным эффектом. Таким образом, переход ДНК из формы двойной спирали в форму одиночных цепей можно наблюдать по изменению поглощения УФ-света с длиной волны 260 нм.
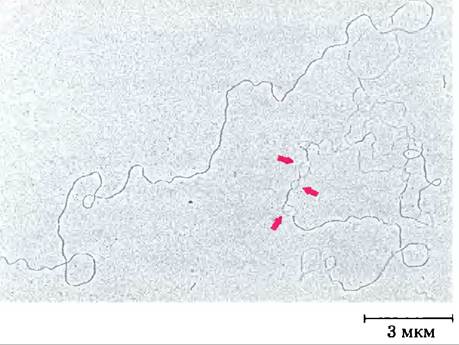
Молекулы ДНК вирусов или бактерий денатурируют в растворе при небольшом нагревании (рис. 8-27). Каждый тип ДНК характеризуется температурой денатурации (температурой плавления,): высокое содержание пар приводит к повышению температуры плавления ДНК. Это происходит из-за того, что в образовании пары G = С участвует три водородные связи, для разрыва которых требуется больше тепловой энергии, чем для диссоциации пар А = Т. При осторожном нагревании регионы, богатые парами А = Т, будут денатурировать, в то время как большая часть ДНК останется в виде двойной спирали. Такие денатурированные регионы (называемые пузырями) можно наблюдать в электронном микроскопе (рис. 8-28). Заметьте, что разделение цепей ДНК, происходящее in vivo в таких процессах, как репликация ДНК или транскрипция, начинается с участков, богатых парами А = Т; мы покажем это далее.
Рис. 8-27. Тепловая денатурация ДНК. а) Кривые денатурации (плавления) для ДНК двух типов. Температура в средней точке перехода (tПЛ) определяет температуру плавления; она зависит от pH, ионной силы раствора и состава ДНК. б) Зависимость tПЛ от содержания в ДНК пар G = С.
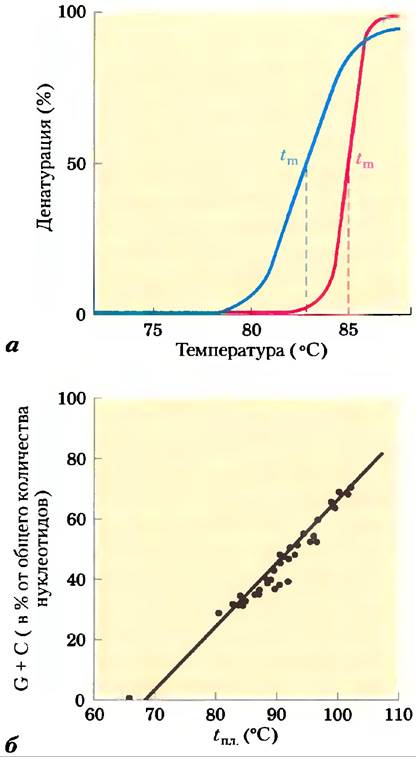
Рис. 8-28. Частично денатурированная ДНК. Эта молекула ДНК была частично денатурирована, а затем зафиксирована для предотвращения процесса ренатурации. Для визуализации ДНК при создании этой фотографии использовался метод оттенения, что увеличило диаметр ДНК примерно в пять раз, и сделало неразличимым большинство деталей спирали. Тем не менее можно измерить длину нитей, а одноцепочечные регионы легко отличить от двухцепочечных. Стрелки показывают некоторые одноцепочечные петли («пузыри»), где уже прошла денатурация. Эти быстро денатурируемые участки богаты парами оснований А = Т и легко восстанавливаются.
Дуплексы двух цепей РНК или одной цепи РНК и одной цепи ДНК (РНК-ДНК-гибриды) также могут подвергаться денатурации. Примечательно, что двухцепочечные РНК более стабильны, чем ДНК. При нейтральных значениях pH для денатурации РНК требуются температуры выше на 20 °С или более, чем для денатурации молекулы ДНК сравнимой последовательности. По стабильности РНК-ДНК-гибриды, как правило, занимают промежуточное положение между дуплексами РНК и дуплексами ДНК. Физические основы для таких различий в тепловой стабильности пока неизвестны.
Нуклеиновые кислоты разных видов могут образовывать гибриды
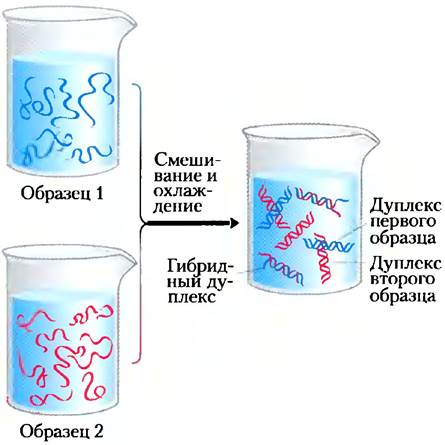
Способность двух комплементарных цепей ДНК образовывать пары друг с другом может быть использована для обнаружения похожих последовательностей ДНК у двух разных видов или в геноме одного вида. Если дуплексы молекул ДНК, изолированных из клеток человека и мыши, полностью денатурировать под действием температуры, а затем выдержать при 25 °С в течение многих часов, большая часть ДНК отожжется. Скорость отжига ДНК зависит от температуры, длины фрагмента ДНК, концентрации ДНК, концентрации солей в реакционной смеси и свойств самой последовательности (например, ее сложности и G + С-состава). Особенно важную роль играет температура. Если температура слишком низкая, короткие последовательности со случайным сходством, расположенные в отдаленных участках молекулы ДНК, будут связываться с матрицей и мешать общему выстраиванию комплементарной последовательности. При слишком высокой температуре будет происходить денатурация ДНК. Почти все цепи ДНК мыши отожгутся с комплементарными цепями мышиной ДНК; похожим образом почти все цепи ДНК человека образуют комплементарные структуры с цепями человеческой ДНК. Тем не менее некоторые тяжи ДНК мыши свяжутся с тяжами ДНК человека с образованием гибридных дуплексов, в которых сегменты нитей ДНК мыши образуют двойные спирали с сегментами нитей ДНК человека (рис. 8-29). Это отражает общее эволюционное происхождение; в различных организмах, как правило, встречаются некоторые белки и молекулы РНК, которые обладают похожими функциями и часто похожим строением. Во многих случаях участки ДНК, в которых закодированы эти белки и молекулы РНК, имеют похожую последовательность. Чем ближе эволюционно находятся друг к другу организмы двух видов, тем с большей вероятностью их молекулы ДНК будут образовывать гибриды. Например, ДНК человека более охотно связывается с ДНК мыши, чем с ДНК дрожжей.
Рис. 8-29. Гибридизация ДНК. Два образца ДНК можно сравнить, если полностью денатурировать их под действием температуры. Если оба раствора смешать и медленно охлаждать, большинство цепей ДНК каждого образца образуют обычные, те же, что были и до плавления, комплементарные двойные спирали. Если же две последовательности нитей ДНК из разных образцов обладают значительным сходством, они могут образовывать дуплексы, или гибриды, друг с другом: чем больше похожи молекулы ДНК, тем больше образуется гибридов. Существует нескольких методов, с помощью которых можно измерить количество образованных гибридов. Один из образцов ДНК обычно метят радиоактивным изотопом для упрощения измерений.
Способность к гибридизации нитей ДНК из разных источников дало основу для широкого набора методов, необходимых для развития современной молекулярной генетики. Специфические последовательности ДНК или ген можно обнаружить даже в присутствии большого количества других последовательностей, при наличии подходящей комплементарной нити ДНК (обычно меченной каким-либо образом), которая может образовывать гибриды с искомой (гл. 9). Комплементарные нити ДНК можно взять из разных видов, или из одного и того же вида, или синтезировать химическими методами в лаборатории с использованием технологий, которые будут описаны дальше в этой главе. Для обнаружения специфической РНК, а не ДНК, методы гибридизации могут быть изменены. На этих методах основаны выделение и идентификация специфических генов и молекул РНК. Их применение делает возможным идентифицировать конкретного человека по одному волосу, оставленному на месте преступления, или предсказать риск заболевания за десятилетия до проявления симптомов (доп. 9-1).
Нуклеотиды и нуклеиновые кислоты подвергаются неферментативным превращениям
Ковалентная структура пуринов и пиримидинов в составе нуклеотидов, частью которых они являются, подвергается ряду спонтанных изменений. Скорость этих реакций обычно очень низкая, но они имеют физиологическое значение из-за малой устойчивости клетки к изменениям генетической информации. Изменения в структуре ДНК, которые приводят к постоянным изменениям закодированной в ней генетической информации, называются мутациями, и существует ряд данных, свидетельствующих в пользу существования тесной связи между накоплением мутаций в организме и процессами старения и образования рака.
Некоторые основания нуклеотидов могут случайно терять аминогруппы, не включенные в гетероцикл (в реакции дезаминирования) (рис. 8-30, а). Например, при физиологических условиях дезаминирование цитозина (в ДНК) до урацила происходит в одном из 107 остатков ци- тидина за 24 часа. Это соответствует примерно 100 случайным превращениям за день в клетке млекопитающих. Дезаминирование аденина и гуанина происходит со скоростью, примерно в 100 раз меньше этой.
Рис. 8-30. Некоторые хорошо изученные неферментативные реакции, в которых участвуют нуклеотиды, а) Реакции дезаминирования. Показаны только основания, б) Реакция депуринизации, в которой происходит гидролиз N-β-гликозидной связи и отщепление (потеря) пурина. Потеря пиримидиновых оснований в результате сходной реакции также может иметь место, но протекает гораздо медленнее. Образующиеся повреждения, в которых сохраняется дезоксирибоза, но нет основания, называют АР-сайтами (апуриновые или, редко, апиримидиновые сайты). Дезоксирибоза, оставшаяся после этой реакции, легко переходит из β-фураноэной в альдегидную форму (рис. 8-3). Другие неферментативные реакции показаны на рис. 8-31 и рис. 8-32.
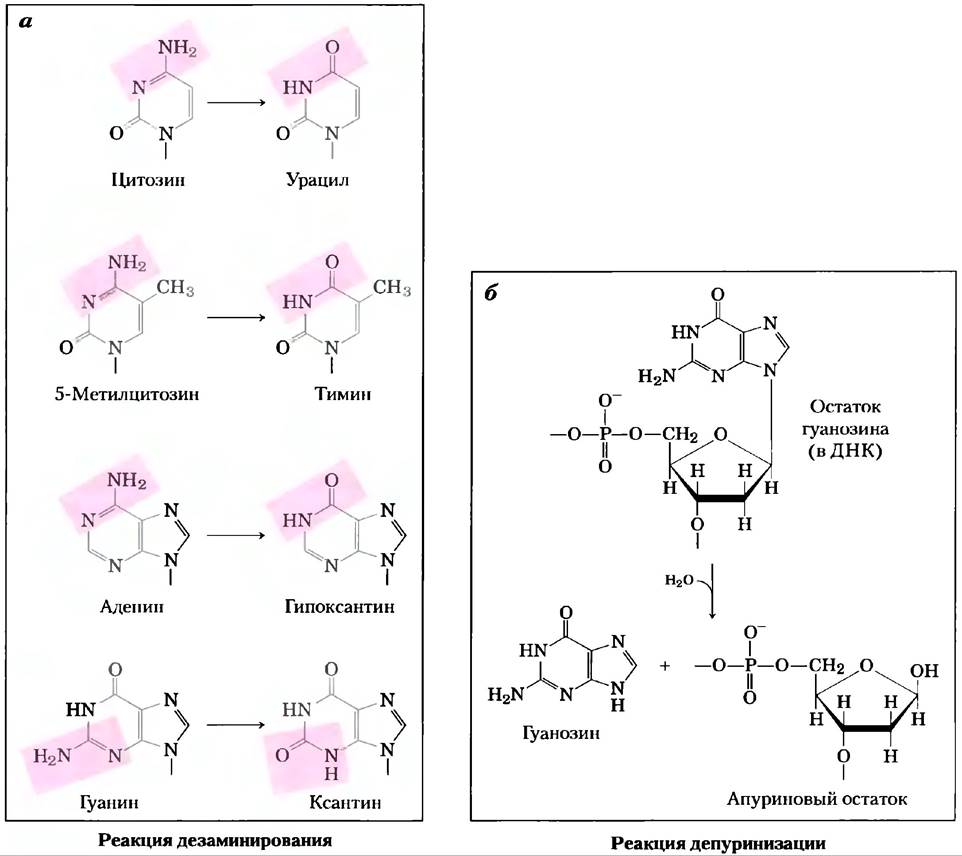
Медленное дезаминирование цитозина кажется достаточно безвредным, но почти наверняка именно по этой причине ДНК содержит тимин вместо урацила. Продукт дезаминирования цитозина (урацил) легко узнается как чуждый элемент в ДНК и удаляется системой репарации (гл. 25). Если бы ДНК в норме содержала урацил, узнавание продуктов дезаминирования цитозина усложнилось бы, а неустраненные остатки урацила могли бы привести к изменению последовательности нуклеотидов, так как они образуют пару с аденинами в процессе репликации. Дезаминирование цитозина постепенно привело бы к уменьшению содержания пар G = С и увеличению содержания пар А = Т в ДНК всех клеток. За миллионы лет дезаминирование цитозина могло бы привести к полному вытеснению пар G = С и изменению генетического кода. Использование тимина в качестве одного из четырех оснований ДНК могло быть, таким образом, решающим моментом в эволюции, что сделало возможным длительное хранение генетической информации.
Другая важная реакция дезоксирибонуклеотидов — это гидролиз N-β-гликозидной связи между основанием и пентозой (рис. 8-30, 6). С пуринами это происходит чаще, чем с пиримидинами. При обычных условиях в клетке каждые 24 часа из ДНК теряется примерно один из 105 пуринов (10 000 на клетку млекопитающего).
Депуринизация рибонуклеотидов и РНК происходит намного медленнее и считается физиологически незначимой. В пробирке скорость потери пуринов может быть ускорена добавлением кислоты. Инкубация ДНК при значениях pH около 3 вызывает выборочное удаление пуриновых оснований, в результате чего образуется производное, которое называется апуриновой кислотой.
Другие реакции обусловлены различными видами излучения. УФ-излучение вызывает конденсацию двух этиленовых групп с образованием циклобутанового кольца. В клетке такая же реакция может происходить между соседними пиримидиновыми основаниями в нуклеиновых кислотах с образованием циклобутановых пиримидиновых димеров. Наиболее часто это происходит между тиминовыми остатками, расположенными по соседству в одной и той же цепи ДНК (рис. 8-31). Второй тип пиримидиновых димеров, так называемый 6,4-фотопродукт, также образуется под воздействием УФ-излучения. Ионизирующее излучение (рентгеновские и улучи) может вызывать раскрытие цикла и фрагментацию оснований, так же, как и разрыв ковалентных связей в остове нуклеиновых кислот.
Рис. 8-31. Образование пиримидиновых димеров под действием УФ-излучения. а) В результате одной реакции (слева) образуется четырехуглеродный цикл, в состав которого входят атомы С-5 и С-6 соседних пиримидиновых остатков. В другой реакции (справа) формируется 6,4-фотопродукт, в котором связаны атомы С-6 и С-4 соседних пиримидиновых остатков, б) Появление циклобутановых пиримидиновых димеров вызывает образование изгиба или петли в молекуле ДНК.
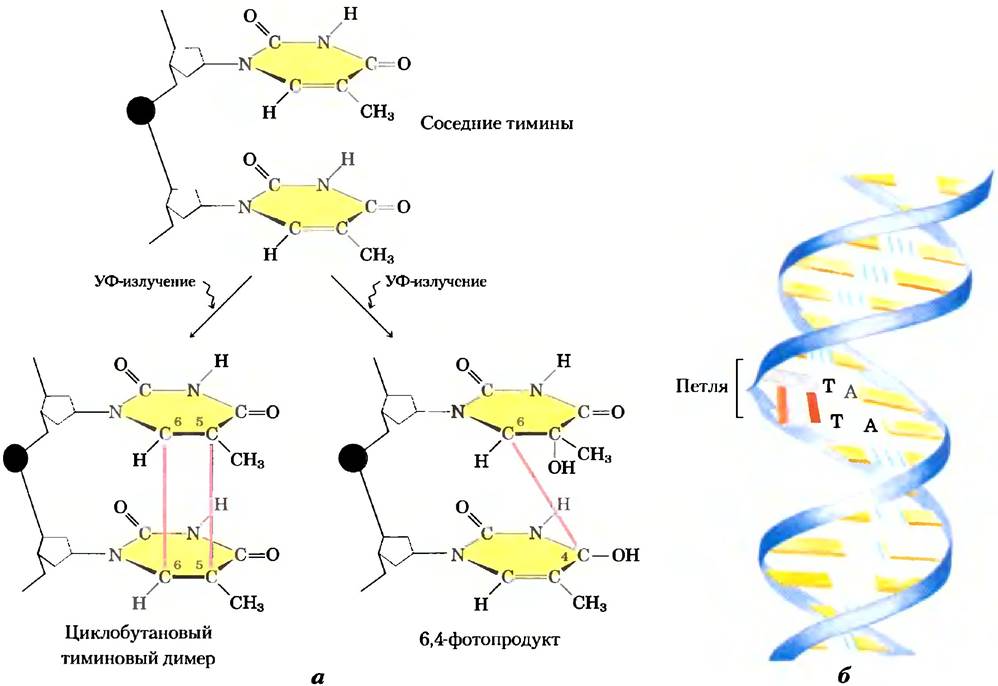
Фактически все формы жизни подвергаются действию высокоэнергетического излучения, способного вызывать химические повреждения в ДНК. Известно, что излучение в области, близкой к УФ (с длинами волн от 200 до 400 нм), которое составляет значительную часть солнечного спектра, способно вызывать образование пиримидиновых димеров и другие химические изменения в ДНК бактерий и в клетках нашей кожи. Мы находимся под постоянным воздействием ионизирующего излучения в виде космических лучей и радиации, излучаемой радиоактивными элементами, такими как радий, плутоний, уран, радон, 14С и 3Н. Рентгеновские лучи с целью медицинской и стоматологической диагностики, а также в радиационной терапии рака и других заболеваний также относятся к ионизирующему излучению. Приблизительно 10% всех повреждений ДНК, вызываемых внешними агентами, происходит под действием УФ и ионизирующего излучений.
Молекула ДНК также может быть повреждена под действием химикатов из промышленных отходов. Эти вещества сами по себе, возможно, безвредны, но они могут метаболизироваться в клетке в токсичные продукты. Существуют два наиболее важных класса таких веществ (рис. 8-32): (1) дезаминирующие агенты, в частности азотистая кислота (НNO2) или соединения, которые могут быть превращены в азотистую кислоту или нитриты, и (2) алкилирующие агенты.
Рис. 8-32. Химические реагенты, которые вызывают повреждения ДНК. а) Предшественники азотистой кислоты, которая ускоряет реакции дезаминирования. б) Алкилирующие агенты.
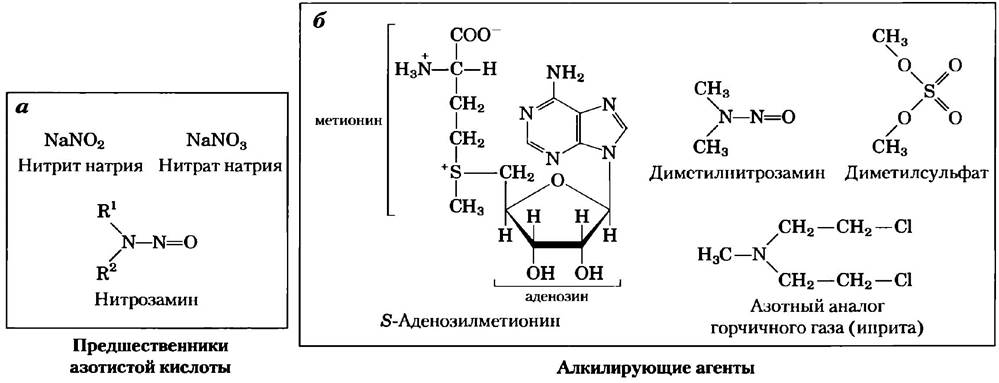
Азотистая кислота, образованная из органических предшественников, таких как нитрозамины, нитриты и нитраты, сильно ускоряет реакции дезаминирования оснований. Похожее действие оказывает бисульфит. Оба реагента используются в качестве консервантов при хранении продуктов для того, чтобы предотвратить размножение токсичных бактерий. При таком использовании они не вызывают значительного увеличения риска развития рака, возможно, потому что используются в небольших количествах, и вносят минимальный вклад в процессы повреждения ДНК. (Если не использовать эти консерванты, испорченные продукты могут нанести намного больший вред здоровью.)
Алкилирующие агенты способны изменять определенные основания ДНК. Например, высокоактивное соединение диметилсульфат (рис. 8-32, б) может метилировать гуанин с образованием О6-метилгуанина, который не образует пару с цитозином.
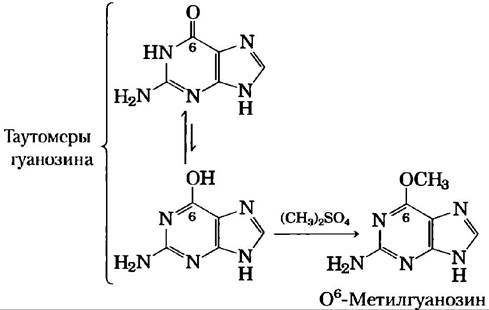
В клетке под действием природных соединений, таких как S-аденозилметионин, в норме протекает много похожих реакций.
Самым главным источником мутационных изменений в ДНК служит окислительное повреждение. Активные формы кислорода — пероксид водорода, гидроксильные радикалы и супероксид- анионы — образуются под действием излучения или в качестве побочных продуктов реакций аэробного метаболизма. Наибольший вклад в окислительные повреждения ДНК вносят именно гидроксильные радикалы. Клетки обладают довольно развитой системой защиты от активных форм кислорода; она включает в себя в том числе различные ферменты, такие как каталаза и супероксиддисмутаза, которые превращают эти формы кислорода в безопасные вещества. Часть окислителей, тем не менее, обходит эту систему защиты и повреждает ДНК, вступая во множество разнообразных реакций, начиная с окисления дезоксирибозы и оснований и заканчивая разрывом цепи. Точная оценка количества таких повреждений пока невозможна, но в любой клетке человека ДНК каждый день участвует в тысячах подобных разрушающих реакций окисления.
Это только часть наиболее изученных реакций, при которых повреждается ДНК. Большое количество канцерогенных веществ в пище, воде или воздухе индуцируют изменения оснований ДНК, что вызывает рак. Тем не менее целостность ДНК как полимера поддерживается намного лучше, чем РНК или белка, потому что ДНК — это единственная макромолекула, которая защищена системой биохимической репарации. Процессы репарации (описанные в гл. 25) значительно снижают степень повреждения ДНК. ■
ДНК метилирована по некоторым основаниям
Определенные основания нуклеотидов в молекуле ДНК ферментативно метилируются. Метилированные аденин и цитозин встречаются гораздо чаще, чем метилированные гуанин и тимин. Метилирование обычно происходит в определенных последовательностях или участках молекулы ДНК. В некоторых случаях функциональное значение метилирования хорошо изучено; в других оно остается неясным. Все известные метилазы ДНК используют S-аденозилметионин в качестве донора метильной группы (рис. 8-32, б). У Е. coli существуют две известные системы, обеспечивающие метилирование ДНК. Одна из них служит частью механизма защиты, который позволяет клетке отличать свою ДНК от чужой, помечая свою собственную ДНК метальными группами и разрушая (чужую) ДНК, которая не содержит метальных групп (эта система известна как система рестрикции-модификации, см. гл. 9). Другая система выполняет метилирование остатков аденозина с образованием N6-метиладенозина в последовательности (5') GATC (3') (рис. 8-5, а). Этот процесс опосредован Dam-метилазой (от англ. DNA adenine méthylation), компонентом системы, которая восстанавливает случайно пропущенные основания при репликации ДНК (см. с. 435).
В эукариотических клетках около 5% остатков цитидина ДНК метилированы до 5-метил- цитидина (рис. 8-5, а). Метилирование происходит чаще всего в CpG-последовательностях (CpG-островки), в результате чего образуются симметричные метил-СрG-последовательности на обеих цепях ДНК. Степень метилирования CpG-островков варьирует по участкам больших молекул эукариотических ДНК.
Последовательность нуклеотидов ДНК можно определить
Способность ДНК хранить информацию связана с такой важнейшей ее характеристикой, как последовательность нуклеотидов. Определение последовательностей нуклеиновых кислот даже из пяти или десяти нуклеотидов до конца 1970-х гг. было сложным и очень трудоемким исследованием. Развитие двух новых методов в 1977 г. (авторами одного являются Алан Максам и Вальтер Гильберт, а другого — Фредерик Сейгер) сделало возможным секвенирование, т. с. определение последовательности, даже более длинных молекул ДНК с легкостью, которую несколько десятилетий назад нельзя было даже представить. Методы основаны на более глубоком понимании химии нуклеотидов и метаболизма ДНК, а также на электрофоретическом разделении фрагментов ДНК, различающихся только по одному нуклео
тиду. Электрофорез ДНК похож на электрофорез белков (рис. 3-18). В качестве основы геля при работе с короткими молекулами ДНК (до нескольких сотен пар оснований) часто используется полиакриламид; агароза обычно используется для более длинных последовательностей ДНК.
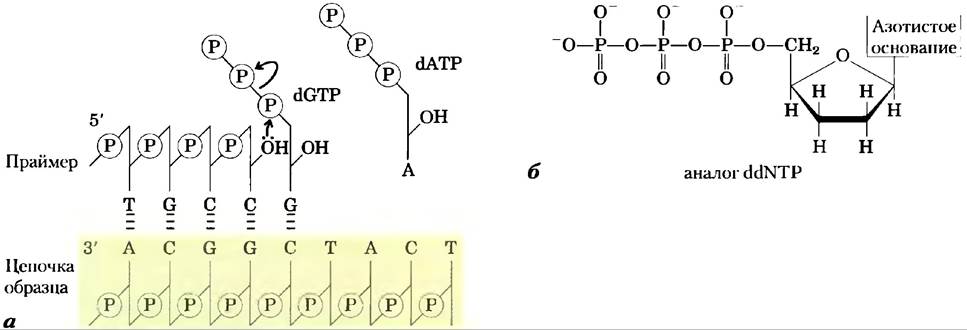
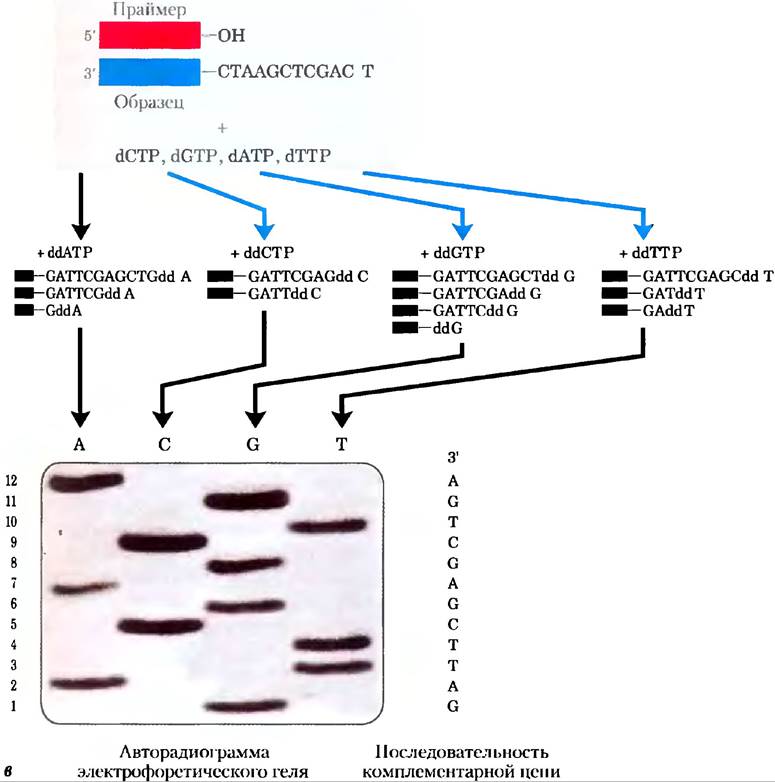
В методах секвенирования по Сенгеру, и Максаму-Гильберту основным принципом является получение четырех наборов меченых фрагментов ДНК. Реакция образования каждого фрагмента, принадлежащего к одному набору, специфична по определенному основанию, которое находится на 3'-конце, таким образом получается, что длина фрагмента соответствует положению, в котором находится конкретное основание. Например, из олигонуклеотида, имеющего последовательность рААТСGАСТ, меченного по 5'-концу (левый конец), в реакции расщепления по остатку С получаются два меченых фрагмента: один будет содержать четыре нуклеотида, другой — семь; в реакции расщепления по остатку G получается только один меченый фрагмент из пяти нуклеотидов. Так как все олигонуклеотиды мечены только по одному 5'-концу, видны будут только те фрагменты ДНК, которые содержат концевой 5'-нуклеотид. Размер фрагментов соответствует положению С и G остатков относительно 5'-конца. Если наборы фрагментов, соответствующие каждому из четырех нуклеотидов, разделить электрофорезом на соседних дорожках, они образуют полосы, по которым можно сразу «прочитать» последовательность (рис. 8-33). Мы описали здесь только метод Сенгера, потому что он легче и более широко применяется. Для его осуществления нужны радиоактивно меченные праймеры, дидезоксинуклеотиды и проведение ферментативного синтеза цепи ДНК, комплементарной анализируемой ДНК.
Рис. 8-33. Секвенирование ДНК по методу Сенгера. В этом методе используется способность ДНК-полимераз синтезировать ДНК (гл. 25). а) Для работы ДНК-полимеразы необходим праймер (короткий олигонуклеотидный фрагмент), к которому добавляются нуклеотиды, и матрица, по которой происходит подбор каждого нового нуклеотида. В пробирках 3'-гидроксильная группа праймера взаимодействует с добавленными дезоксирибонуклеозидтрифосфатами (dNТР) с образованием фосфодиэфирной связи, б) Секвенирование по методу Сенгера происходит с использованием аналогов дидезоксинуклеозидтрифосфатов (ddNТР) для остановки синтеза ДНК. (Метод Сенгера также известен как дидезокси-метод.) Когда ddNТР встает на место (dNТР, рост цепи прекращается, так как у него отсутствует 3'-гидроксильная группа, необходимая для осуществления следующего шага синтеза, в) ДНК, последовательность которой нужно расшифровать, используется в качестве матрицы, а короткие праймеры, меченные радиоактивной или флуоресцентной меткой, отжигаются на ней. Если добавить небольшие количества ddNТР одного типа, например, ddCТР, к стандартной реакционной смеси, то синтез цепи будет преждевременно останавливаться на тех нуклеотидах, где в норме встраиваются dС. При избытке dСТР по сравнению с ddCТР шанс включения аналога на место dС довольно мал. Концентрацию ddCТР подбирают таким образом, чтобы с большой вероятностью этот нуклеотид встраивался по какому-то одному положению в каждой синтезируемой цепи. В результате в растворе образуется смесь меченых фрагментов, каждый из которых заканчивается на остаток С. Каждый остаток С в последовательности приводит к накоплению набора фрагментов определенной длины, так что фрагменты разной длины, разделенные электрофорезом, показывают локализацию остатков С. Процедура повторяется по отдельности для каждого из четырех ddNТР, и последовательность можно прочитать прямо по авторадиограмме геля. Так как более короткие фрагменты ДНК мигрируют быстрее, то те из них, которые расположены рядом с нижним краем геля, соответствуют ближайшим к праймеру нуклеотидам (5'-конец), а последовательность следует читать (в направлении 5' —> 3') снизувверх. Обратите внимание на то, что полученная таким образом последовательность комплементарна анализируемой цепи.
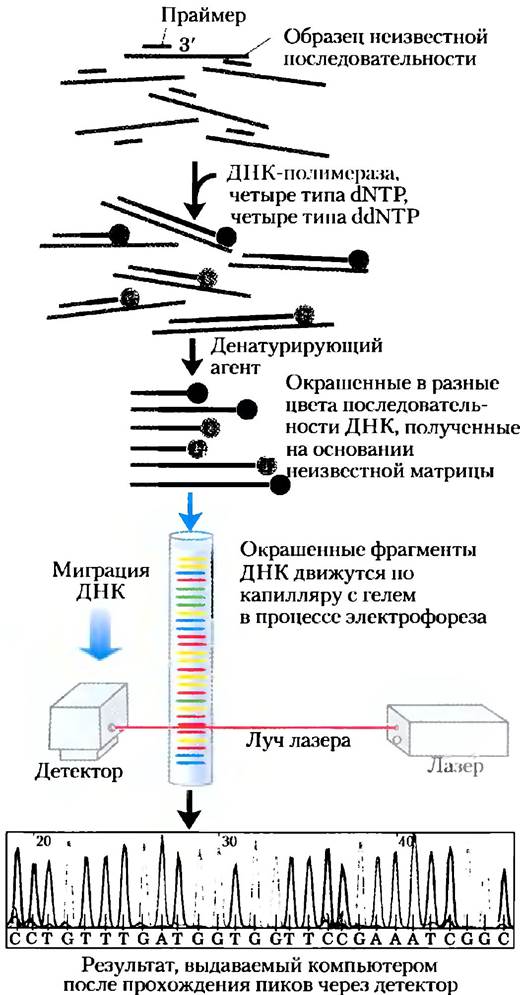
Секвенирование ДНК может быть автоматизировано с помощью небольшого изменения метода Сенгера, в котором дидезоксинуклеотиды, используемые для каждой реакции, метят разными флуоресцентными зондами (рис. 8-34). Этот метод позволяет определить последовательность ДНК, содержащую тысячи нуклеотидов, за несколько часов. На данный момент полностью секвенированы геномы многих организмов (см. табл. 1-2), и огромное число проектов секвенирования ДНК еще продолжается. Пожалуй, наиболее претенциозный из них — это проект «Геном человека», в котором исследователи секвенировали свыше 3,2 миллиардов пар оснований ДНК человеческой клетки (гл. 9). Дидезоксисеквенирование ДНК
Рис. 8-34. Способ автоматизации реакций определения последовательности ДНК. Каждый дидезоксинуклеотид, используемый в методе Сенгера, можно связать с флуоресцентной молекулой, которая окрашивает все фрагменты ДНК, заканчивающиеся на конкретный нуклеотид, в один и тот же цвет. Все четыре меченных разными метками ddNTР добавляют в одну пробирку. Образующиеся окрашенные фрагменты ДНК затем разделяются по размеру в электрофоретическом геле, содержащемся в капилляре (усовершенствование электрофоретического геля, которое позволяет осуществлять более быстрое разделение). Все фрагменты одной длины мигрируют по капилляру с одной скоростью и в конечном итоге образуют один пик, а цвет каждого пика определяется позже с помощью луча лазера. Последовательность ДНК читают после определения последовательности цветов пиков, которые проходят через детектор. Эта информация передается непосредственно на компьютер, который определяет последовательность.
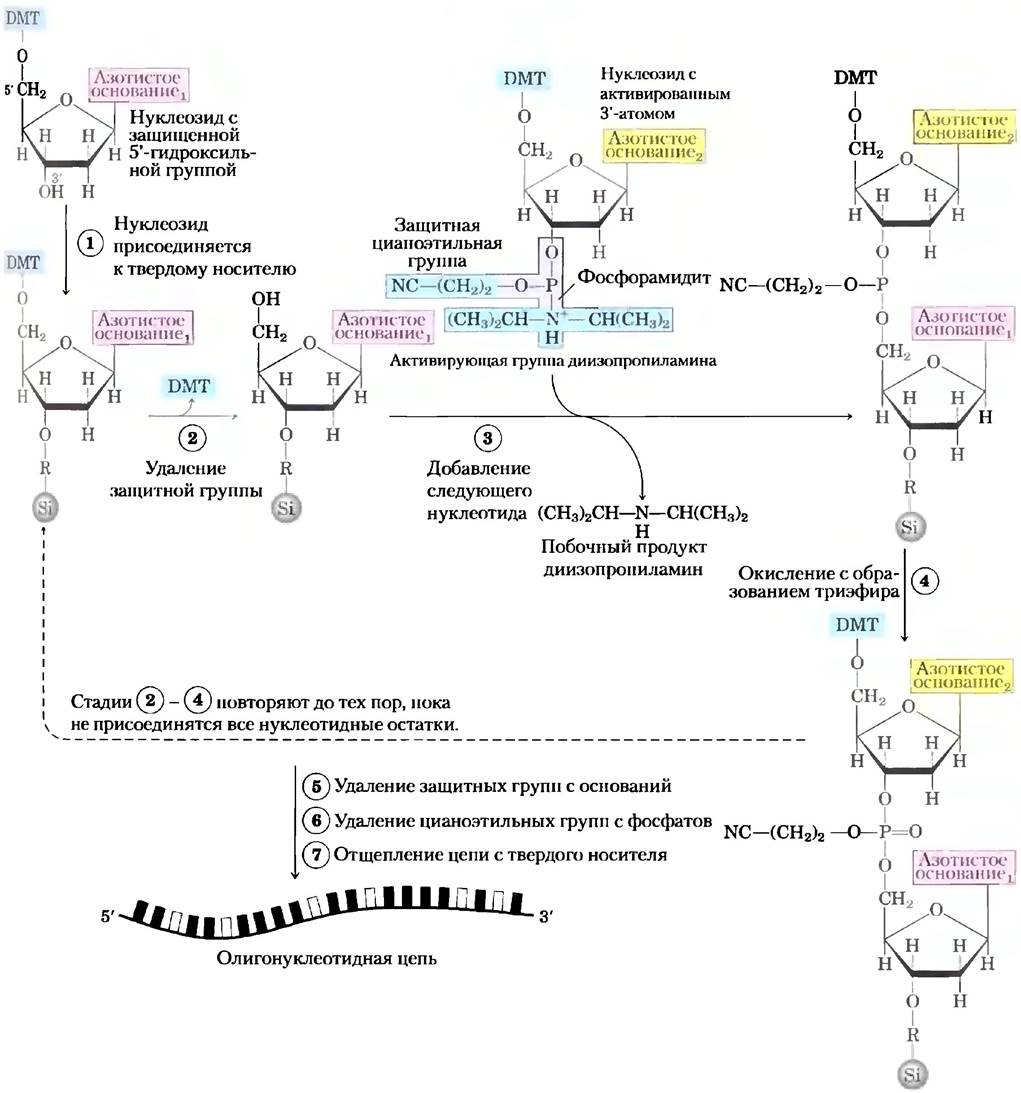
Автоматизирован химический синтез ДНК
Другой очень важный в химии нуклеиновых кислот метод - это быстрый и точный химический синтез коротких олигонуклеотидов любой заданной последовательности. Химические методы синтеза были разработаны X. Гобиндом Корана и его коллегами в 1970-х гг. Усовершенствования, сделанные Робертом Летсингером и Марвином
Карутерсом, позволили широко использовать химический метод, который получил название фосфорамидитного метода (рис. 8-35). Синтез осуществляется путем наращивания цепочек, прикрепленных к твердому носителю, с использованием принципов, лежащих в основе синтеза пептидов по Меррифилду (рис. 3-29). Продуктивность каждого последующего шага довольно высока, что позволяет синтезировать полимеры, содержащие от 70 до 80 нуклеотидов, а в некоторых специально оборудованных лабораториях — и более длинные цепи. Доступность относительно недорогих полимеров ДНК с запланированной последовательностью вносит огромный вклад в развитие всех областей биохимии (гл. 9).
Рис. 8-35. Химический синтез ДНК фосфорамидитным методом. Автоматизированный синтез ДНК похож на синтез полипептидов на твердом носителе. Олигонуклеотиды синтезируются на твердом носителе (силикагель) в многостадийном процессе, на каждом этапе которого присоединяется по одному нуклеотиду. В повторяющихся химических реакциях по одному добавляются соответствующие нуклеотидные предшественники с защищенными группами, которые блокируют фрагменты оснований, не участвующих в реакции. 1 Первый нуклеозид (который будет крайним с 3'-конца) присоединяется к силикагелю при помощи 3'-гидроксила (через связывающую группу R), а 5'-гидроксильная группа защищается неустойчивой к действию кислот диметокситритильной группой (DMT). 2 Защитная группа удаляется при промывании колонки кислотой (DMT-группа окрашена, поэтому эту реакцию можно наблюдать спектрофотометрически). (D Следующий нуклеотид на 3'-конце имеет активную фосфорамидитную группу — соединение трехвалентного фосфора фосфит (в отличие от более окисленного фосфата, где фосфор пятивалентен; в нуклеиновых кислотах обычно присутствует пятивалентный фосфор), в котором один кислород заменен аминогруппой или замещенным амином. В представленном типичном варианте один кислород фосфорамидитной группы связан с дезоксирибозой, другой защищен цианэтильной группой, а третья позиция занята быстро замещаемой диизопропиламиногруппой. В результате реакции с иммобилизованным нуклеотидом образуется 5',3'-связь, а диизопропиламиногруппа удаляется. На стадии 4 связь с фосфитом окисляется иодом, что дает в итоге фосфодиэфирную связь. Реакции 2-4 повторяются до тех пор, пока не будут добавлены все нуклеотиды. На каждой стадии избыток непрореагировавших нуклеотидов удаляют перед добавлением в смесь нуклеотидов другого типа. На стадиях 5 и 6 оставшиеся защитные группы на основаниях и фосфатах удаляются; на стадии (7) олигонуклеотид отделяют от твердого носителя и отчищают. Химический синтез РНК в некотором смысле более сложен, потому что в этом случае необходимо защищать 2'-гидроксильную группу, не влияя никак на реакцион- носпособность 3'-гидроксила.
Краткое содержание раздела 8.3 Химия нуклеиновых кислот
■ Природная ДНК подвергается обратимому раскручиванию и разделению цепей (плавлению) при повышении температуры или при экстремальных значениях pH. Температура плавления ДНК, содержащей большое количество пар G=С, выше, чем температура плавления ДНК, в которой преобладают пары А=Т.
■ Денатурированные одноцепочечные молекулы ДНК из двух организмов разных видов могут образовывать гибридный дуплекс, вероятность образования которого зависит от сходства последовательностей. Гибридизация служит основой важных методов, используемых для изучения и выделения специфических генов и молекул РНК.
■ Молекула ДНК — это относительно стабильный полимер. Случайные реакции, такие как дезаминирование определенных оснований, гидролиз N-гликозидных связей между сахаром и основанием, образование пиримидиновых димеров под действием радиации и окислительные повреждения, протекают с очень низкими скоростями, что имеет большое значение для клеток, поскольку им необходимо сохранять свой генетический материал.
■ Последовательность ДНК можно определить, а полимеры ДНК синтезировать простыми автоматизированными способами, в которых используются химические и ферментативные методы.