ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
1. ОСНОВЫ БИОХИМИИ
1.3. Физические основы биохимии
Для обеспечения жизнедеятельности и самовоспроизведения живые организмы должны выполнять определенную работу. Реакции синтеза, протекающие в клетках, как и процессы синтеза на производстве, требуют энергетических затрат. Энергия расходуется при движении бактерии и беге спринтера на Олимпийских играх, при полете светляков и при электрическом разряде угря. Хранение и передача информации также требуют энергии, без которой богатые информацией молекулы неизбежно утратили бы свою структуру и значение.
В процессе эволюции клетки создали высокоэффективные механизмы использования энергии солнечного света или топливных молекул для осуществления многочисленных процессов, протекающих с затратой энергии. Одной из задач биохимии является описание процессов получения, передачи и расходования энергии живыми клетками в химических и количественных терминах. Превращения энергии в клетке, как и все другие процессы преобразования энергии, можно рассматривать с учетом законов термодинамики.
Живые организмы находятся в динамическом стационарном состоянии, но не в равновесии с окружающей средой
Молекулы и ионы в живых организмах по типу и концентрации отличаются от тех, что находятся в окружающей среде. Парамеция в пруду, акула в океане, бактерия в почве, яблоня в саду — все они отличаются по составу от окружающего их мира. Кроме того, по достижении зрелости они поддерживают свой состав более или менее постоянным, несмотря на непрерывно меняющиеся внешние условия.
Хотя характерный состав живого организма слабо изменяется со временем, популяция молекул внутри него вовсе не находится в статическом состоянии. Небольшие молекулы, макромолекулы и надмолекулярные структуры непрерывно синтезируются и распадаются в химических реакциях, сопровождающихся постоянным оборотом вещества и энергии в системе. Молекулы гемоглобина, которые вот в этот самый момент переносят кислород от наших легких к мозгу, были синтезированы в прошлом месяце. К следующему месяцу они будут уничтожены и полностью заменены новыми. Глюкоза, которую ваш организм получил при последнем приеме пищи, сейчас циркулирует у вас в кровотоке. До конца дня эти молекулы глюкозы превратятся во что-то еще, возможно, в углекислый газ или жир и будут заменены новой глюкозой, так что ее концентрация в крови остается более или менее постоянной на протяжении всего дня. Количество гемоглобина и глюкозы в крови относительно постоянно, поскольку скорость синтеза или захвата каждого из этих веществ совпадает со скоростью их разложения, потребления или превращения в другие продукты. Постоянство концентрации является результатом динамического стационарного состояния, которое далеко от равновесия. Поддержание этого стационарного состояния требует затрат энергии. Если клетка не может более производить энергию, она погибает и начинает разлагаться, приходя к равновесию с окружающей средой. Ниже мы подробнее обсудим суть понятий «стационарное состояние» и «равновесие».
Организмы перерабатывают энергию и вещества из окружающей среды
Систему, в которой происходит химическая реакция в растворе, можно описать как сумму всех реагирующих веществ, продуктов реакции и растворителя, а также непосредственно окружающей их атмосферы, короче говоря, всего, что содержится в определенной области пространства. Система и окружающая среда вместе составляют вселенную. Если система не обменивается веществом и энергией с окружающей средой, ее называют изолированной. Если система обменивается с окружающей средой энергией, но не обменивается материей, ее называют закрытой. Если происходит обмен энергией и материей, такую систему называют открытой.
Живой организм представляет собой открытую систему: он обменивается с окружающей средой энергией и материей. Живые организмы могут получать энергию двумя способами: 1) путем захвата из окружающей среды химического топлива (например, глюкозы) и его окисления (см. дополнение 1-3, случай 2); 2) путем поглощения солнечного света.
Первый закон термодинамики постулирует принцип сохранения энергии: при любых химических или физических изменениях общее количество энергии в системе остается постоянным, хотя форма энергии может изменяться. Клетки способны виртуозно трансформировать химическую, электромагнитную, механическую и осмотическую энергию с очень высокой эффективностью (рис. 1-24).
Рис. 1-24. Некоторые пути превращения энергии в живых организмах. Энергетические превращения в процессе метаболизма сопровождаются ростом хаотичности системы и окружающего ее пространства, выраженной в терминах энтропии, по мере снижения потенциальной энергии сложных молекул питательных веществ. а) Живые организмы получают энергию из окружающей среды; б) переводят некоторое количество энергии в необходимую клеткам форму; в) возвращают некоторое количество энергии в виде тепла в окружающую среду; г) выделяют конечные продукты, молекулы которых менее организованы, чем исходные топливные молекулы, что повышает энтропию системы. Одним из результатов этих превращений является д) рост упорядоченности (снижение хаотичности) в системе, что связано с синтезом сложных макромолекул. В гл. 13 мы вернемся к разговору о количественном выражении энтропии.
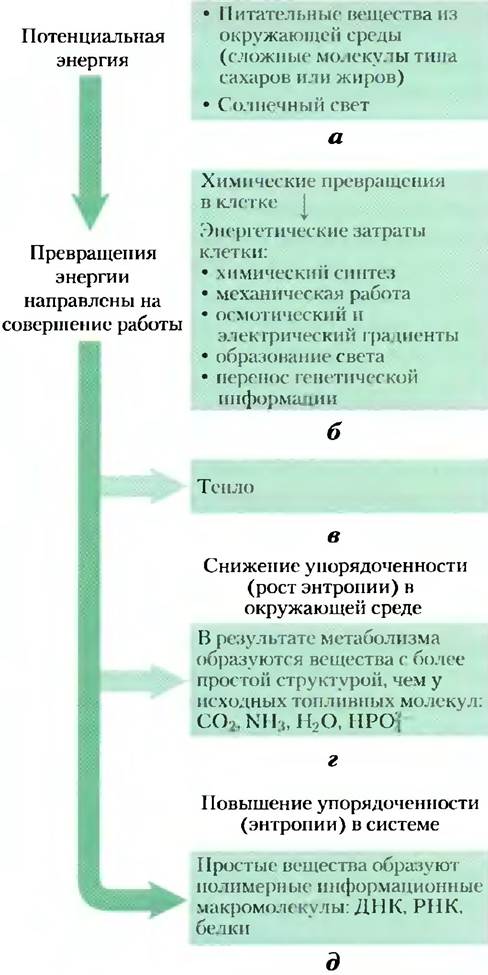
Дополнение 1-3. Энтропия: преимущество беспорядка
Термин «энтропия», буквально означающий «изменение внутри», впервые был использован в 1851 г. Рудольфом Клаузиусом, автором одной из формулировок второго начала термодинамики. Точное количественное определение энтропии требует привлечения математической статистики и теории вероятности, однако суть этого понятия на качественном уровне можно объяснить с помощью трех простых примеров, каждый из которых иллюстрирует один из аспектов энтропии. Здесь такие основные определения энтропии, как «хаотичность» и «беспорядок», проявляются с разных сторон.
Пример 1: Горячий чайник и рассеяние тепла
Нам известно, что пар, образующийся при кипении воды, может совершать полезную работу. Однако предположим, что мы выключаем конфорку иод чайником с кипящей (температура 100 °С) водой (это наша «система») на кухне («окружающая среда») и даем чайнику остыть. По мере остывания никакой видимой работы не совершается, но тепло от горячего чайника поступает в окружающую среду, повышая температуру на кухне на бесконечно малую величину, пока не установится равновесие. В момент равновесия чайник (с водой), воздух и предметы на кухне имеют одинаковую температуру. Свободная энергия, сосредоточенная в чайнике с кипятком, потенциально способна совершать работу. Эквивалентная этой энергии тепловая энергия все еще присутствует в кипятке (чайнике) и на кухне (т. е. во «вселенной»), однако в полностью рассеянном виде. Эту энергию больше нельзя использовать для совершения работы, поскольку' температура везде на кухне одинакова. Более того, повышение энтропии окружающей среды (на кухне) необратимо. Из собственного опыта мы все знаем, что тепло никогда не вернется из окружающего воздуха в чайник и температура воды в чайнике не может самопроизвольно подняться до 100 °С (и даже на несколько градусов).
Пример 2: Окисление глюкозы
Энтропия характеризует состояние не только энергии, но и вещества. Аэробные (гетеротрофные) организмы используют свободную энергию полученной из внешней среды глюкозы путем ее окисления кислородом, также полученным из внешней среды. Конечные продукты этого окислительного метаболизма СО2 и Н2О возвращаются в окружающую среду. В результате данного процесса в окружающей среде происходит рост энтропии, в то время как внутри самого организма сохраняется стационарное состояние, и в его внутреннем порядке не происходит никаких изменений. Некоторый рост энтропии связан не только с выделением тепла, но и с другим типом беспорядка, как следует из уравнения окисления глюкозы:
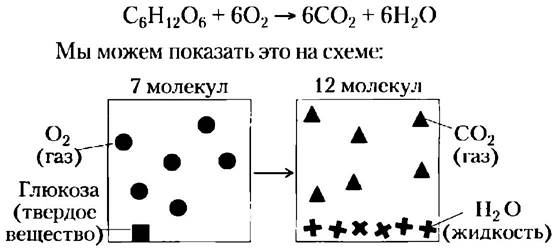
В результате реакции окисления атомы, составлявшие 1 молекулу глюкозы и 6 молекул кислорода (всего 7 молекул), рассредоточились в менее упорядоченной системе, так как теперь число молекул равно 12 (6СО2 + 6Н2О).
В любой химической реакции, приводящей к увеличению числа молекул (или к превращению твердого вещества в жидкое или газообразное, молекулы которого перемещаются более свободно), упорядоченность молекул снижается, следовательно, повышается энтропия.
Пример 3: Энтропия и информация
Приведенный ниже короткий фрагмент монолога Брута, произносимый им при приближении армии Марка Антония («Юлий Цезарь», акт IV, сцена 3), представляет собой содержащий информацию осмысленный набор слов, составленный из 25 букв английского алфавита:
There is a tide in the affairs of men,
Which, taken at the flood, leads on to fortune:
Omitted, all the voyage of their life
Is bound in shallows and in miseries.*
*В делах людей прилив есть и отлив,
С приливом достигаем мы успеха.
Когда ж отлив наступит, лодка жизни
По отмелям несчастий волочится.
(Перевод М. Зенкевича)
Кроме явного смысла слов здесь многое скрыто — имеется указание на сложное сплетение событий, разыгрываемых в пьесе, а также отражены взгляды автора на сам конфликт, амбиции героев и их жажду к превосходству (первенству). Этот маленький фрагмент, пронизанный шекспировским пониманием человеческой природы, очень насыщен информацией.
Однако если использованные в этом фрагменте 125 букв расставить в случайном порядке, как показано в рамке, они вообще не будут иметь никакого смысла.

В данном случае 125 букв не несут практически никакой информации, но характеризуются очень высокой энтропией. Подобные рассуждения помогают нам понять, что информация является формой энергии, ее называют «отрицательной энтропией». Действительно, раздел математики, называемый теорией информации и лежащий в основе логики компьютерного программирования, тесно связан с теорией термодинамики. Живые организмы являются высокоупорядоченными структурами, чрезвычайно насыщенными информацией, и потому характеризуются низкой энтропией.
Поток электронов обеспечивает организм энергией
Практически все живые организмы прямо или косвенно добывают энергию из солнечной радиации, являющейся результатом термоядерных реакций на Солнце. В процессе фотосинтеза происходящее под действием солнечного света расщепление воды приводит к высвобождению электронов для восстановления СО2 и к выделению в атмосферу молекулярного кислорода:
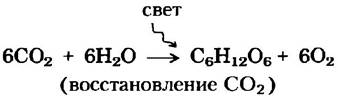
Нефотосинтезирующие клетки и организмы получают необходимую им энергию путем окисления энергетически богатых продуктов фотосинтеза и передачи электронов этих молекул на атмосферный кислород с образованием воды, СО2 и других конечных продуктов, что приводит к их рециркуляции в окружающей среде:
С6Н12О6 + О2 —> 6СО2 + 6Н2О + энергия
(окисление глюкозы с высвобождением энергии)
Автотрофы и гетеротрофы участвуют в глобальных циклах углерода и кислорода, управляемых в конечном итоге солнечным светом, в результате чего эти две большие группы организмов являются взаимозависимыми. Практически все преобразования энергии в клетке можно проследить по потоку электронов от одной молекулы к другой в направлении от более высокого к более низкому электромеханическому потенциалу. В таком случае этот процесс по формальным признакам аналогичен потоку электронов в электрической цепи, работающей от батарейки. Все реакции с переносом электронов являются окислительновосстановительными: один реагент окисляется (отдает электроны), а другой восстанавливается (принимает электроны).
Создание и поддержание порядка требуют работы и затрат энергии
Как уже было сказано, ДНК, РНК и белки представляют собой информационные макромолекулы; последовательность составляющих их мономерных звеньев несет в себе определенную информацию — как последовательность слов в предложении. Клетка затрачивает энергию нс только на создание ковалентных связей между звеньями этих полимеров, но и на построение их в строго определенном порядке. Чрезвычайно важно, чтобы аминокислоты из смеси выстроились в специфической последовательности в определенную белковую молекулу. Это приведет к увеличению упорядоченности в популяции молекул. Однако в соответствии со вторым началом термодинамики в природе существует тенденция к усилению беспорядка: общая энтропия Вселенной постоянно растет. Таким образом, для осуществления синтеза макромолекул из мономерных единиц система (в данном случае клетка) должна получить свободную энергию.
Ключевые договоренности. Для количественного выражения хаотичности или беспорядка среди компонентов химической системы используют параметр энтропии (S) (см. дополнение 1-3). Любые изменения хаотичности системы выражаются как изменения энтропии (∆S), которые в соответствии с принятыми договоренностями считают положительными при росте энтропии. Дж. Уиллард Гиббс, развивший теорию энергетических изменений в процессе химической реакции, показал, что свободную энергию(энергию Гиббса, G) любой закрытой системы можно описать тремя параметрами: энтальпией (Н), отражающей число и тип связей, энтропией (S) и абсолютнойтемпературой (T), выраженной в кельвинах. Уравнение для свободной энергии выглядит следующим образом: G = H — TS. Если химическая реакция протекает при постоянной температуре, то изменение свободной энергии (∆G) определяется изменением энтатьпии (∆Н), отражающим тип и число образующихся и разрушающихся химических связей и нековалентных взаимодействий, а также изменением энтропии (∆S), отражающим изменение хаотичности в системе:
∆G = ∆Н- T∆S
где ∆Н по определению отрицательно для реакции с выделением теплоты, а ∆S положительно для реакции, в которой увеличивается хаотичность системы. ■
Дж. Уиллард Гиббс, 1839-1903

Реакция может протекать самопроизвольно лишь в случае отрицательного значения ∆G (если свободная энергия в процессе высвобождается). Однако функционирование клетки в значительной степени зависит от таких молекул, как белки и нуклеиновые кислоты, которые характеризуются положительной свободной энергией образования: они менее стабильны и гораздо более упорядочены, чем смесь их мономерных звеньев.
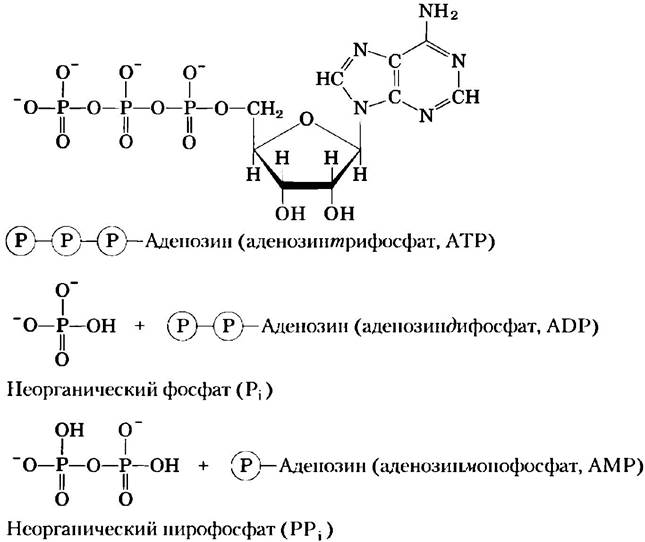
Для осуществления невыгодных с термодинамической точки зрения (эндергонических) реакций клетка сопрягает их с другими реакциями, которые протекают с высвобождением свободной энергии (экзергонические реакции), так что суммарный процесс становится энергетически выгодным: общее изменение свободной энергии отрицательное. Обычным источником свободной энергии в сопряженных биологических реакциях является гидролиз фосфоангидридных связей, например, в молекуле аденозинтрифосфата (АТР, рис. 1-25) и гуанозинтрифосфата (GTP). Здесь буквой![]() обозначены фосфорильные группы:
обозначены фосфорильные группы:

Рис. 1-25. Молекула аденозинтрифосфата (АТР) как источник энергии. Здесь буквой![]() обозначены фосфорильные группы. Удаление от АТР концевой фосфорильной группы (выделена розовым цветом) в результате расщепления фосфоангидридной связи приводит к образованию аденозиндифосфата (ADP) и неорганического фосфат-иона (НРO2-4). Этот экзергонический процесс сопряжен со многими эндергоническими процессами в клетке (как в примере на рис. 1-26, 6). Кроме того, АТР является источником энергии для многих клеточных процессов в результате реакции расщепления, в которой АТР теряет две концевые фосфорильные группы, что приводит к образованию неорганического пирофосфата (H2P2O2-7), часто обозначаемого РРi.
обозначены фосфорильные группы. Удаление от АТР концевой фосфорильной группы (выделена розовым цветом) в результате расщепления фосфоангидридной связи приводит к образованию аденозиндифосфата (ADP) и неорганического фосфат-иона (НРO2-4). Этот экзергонический процесс сопряжен со многими эндергоническими процессами в клетке (как в примере на рис. 1-26, 6). Кроме того, АТР является источником энергии для многих клеточных процессов в результате реакции расщепления, в которой АТР теряет две концевые фосфорильные группы, что приводит к образованию неорганического пирофосфата (H2P2O2-7), часто обозначаемого РРi.
При сопряжении этих двух реакций сумма ∆G1 и ∆G2 отрицательна, т. е. весь процесс в целом является экзергоническим. Используя такую стратегию сопряжения, клетки синтезируют и поддерживают богатые информацией молекулы, необходимые для их жизни.
Энергетическое сопряжение в биологических реакциях
При изучении биоэнергетики (науки о превращениях энергии в живых системах) основное внимание уделяется сопряженным процессам, в которых энергия, получаемая при метаболизме топливных молекул или от солнечного света, расходуется на осуществление реакций, идущих в клетке с затратами энергии. В связи с этим полезно рассмотреть простую механическую задачу (рис. 1-26, а). Предмет, находящийся на вершине наклонной плоскости, обладает определенной потенциальной энергией, поскольку он поднят на некоторую высоту. Предмет скользит вниз по плоскости и при этом теряет свою потенциальную энергию. Если с помощью блока соединить этот скользящий предмет с меньшим по размеру предметом, то самопроизвольное скольжение большого предмета будет поднимать маленький, т. е. совершится определенная работа. Количество энергии, доступное для совершения работы, равно изменению свободной энергии Гиббса (∆G).
Рис. 1-26. Энергетическое сопряжение при механических и химических процессах, а) Движение предмета вниз высвобождает потенциальную энергию, с помощью которой можно осуществить механическую работу. Потенциальная энергия, высвобождаемая в результате спонтанного движения вниз (экзергонический процесс, показан розовым цветом), может быть использована для подъема другого предмета (эндергонический процесс, показан голубым цветом). б) Образование глюкозо-6-фосфата из глюкозы и неорганического фосфата (Рi) по реакции 1 приводит к образованию продукта, более богатого энергией, чем исходные вещества. В этой эндергонической реакции ∆G >0. Экзергонический процесс гидролиза АТР (реакция 2) характеризуется большим отрицательным значением ∆С2. Суммарная реакция, составленная из реакций 1 и 2, характеризуется изменением свободной энергии ∆G3 = ∆G1 + ∆G2. Поскольку ∆G3 <O, суммарная реакция является экзергонической и может протекать самопроизвольно.
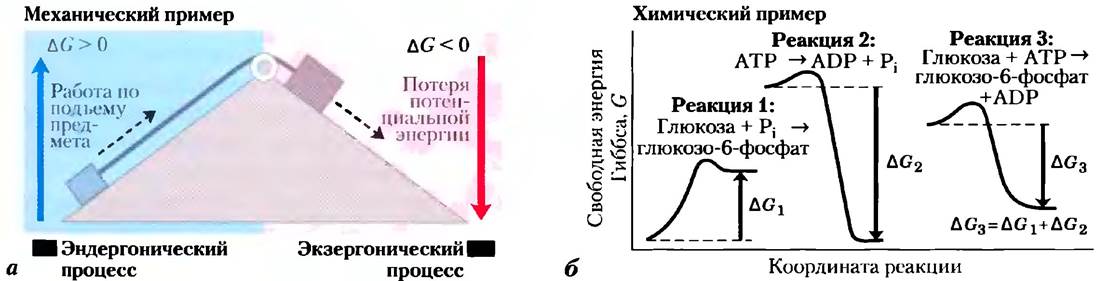
Эта величина всегда несколько меньше теоретического значения высвобождаемой энергии, поскольку часть ее рассеивается в виде тепла. Чем выше поднят большой предмет, тем больше энергии (∆G) высвобождается по мере его скольжения вниз, и тем большую работу можно выполнить за счет этой энергии. Более крупный объект может поднять более мелкий объект лишь за счет того, что вначале более крупный объект был далек от положения равновесия: в какой-то более ранний момент времени он был поднят над землей с затратой определенной энергии.
Как все сказанное применить к химической реакции? В закрытых системах химические реакции протекают спонтанно до достижения состояния равновесия. При равновесии скорость образования продуктов реакции в точности равна скорости их обратного превращения в исходные вещества. Таким образом, не наблюдается изменений концентраций реагирующих веществ и продуктов реакции: достигается стационарное состояние. Изменение энергии системы от исходного состояния к равновесию (при постоянной температуре и давлении) определяется изменением свободной энергии (∆G). Величина ∆G зависит от конкретной химической реакции и от удаленности исходной системы от состояния равновесия. Каждое вещество, участвующее в реакции, обладает определенной потенциальной энергией, которая зависит от типа и числа имеющихся в нем связей. В спонтанных реакциях энергия образующихся продуктов меньше, чем у реагирующих веществ, так что в результате реакции энергия высвобождается, и ее можно использовать на совершение работы. Это экзергонические реакции, в которых разность свободной энергии реагирующих веществ и продуктов — отрицательная величина. Для осуществления эндергонических реакций необходимо затратить энергию, ∆G — положительная величина. Аналогично тому, как это происходит в механическом процессе, только часть энергии, высвобождаемой в экзергонической химической реакции, может быть использована для совершения работы. В живых системах часть энергии излучается в виде тепла или теряется с ростом энтропии.
В живых организмах, как и в примере на рис. 1-26, а, для осуществления энергетически невыгодной реакции экзергоническая реакция может быть сопряжена с эндергонической. На рис. 1-26, б в виде графиков, называемых энергетическими диаграммами, продемонстрировано превращение глюкозы в глюкозо-6-фосфат — первый этап метаболического пути окисления глюкозы. Простейшим способом получения глюкозо-6-фосфата является следующий:
Реакция 1:
Глюкоза + Рi —> глюкозо-6-фосфат
(∆G >0, эндергонический процесс).
Здесь под Рi подразумевается неорганический фосфат НРO42-. Сейчас не будем останавливаться на выяснении структуры участвующих в реакции соединений, мы подробно поговорим об этом позже. Данная реакция не может протекать самопроизвольно, поскольку ∆G >0. Напротив, вторая реакция является экзергонической и может протекать в любых клетках:
Реакция 2:
АТР —> ADP + Рi
(∆G <0, экзергонический процесс).
Обе эти реакции протекают с участием вещества Pi, которое потребляется в первой реакции и выделяется во второй. Следовательно, эти две реакции можно объединить в одну суммарную (вещество Рi вычитаем из обеих сторон уравнения):
Реакция 3:
Глюкоза + АТР —> глюкозо-6-фосфат + ADP.
В реакции 2 выделяется больше энергии, чем расходуется в реакции 1, поэтому изменение свободной энергии в реакции 3 (∆G3) отрицательное, следовательно, синтез глюкозо-6-фосфата по этой реакции может протекать.
Сопряжение экзергонических и эндергонических реакций, имеющих общие промежуточные продукты, — важнейший принцип энергетического обмена в живых организмах. Как мы увидим, в результате реакций, протекающих с распадом АТР (как реакция 2 на рис. 1-26, б), высвобождается энергия, позволяющая протекать многим эндергоническим реакциям в клетке. Распад АТР в клетке является экзергоническим процессом по той причине, что во всех живых клетках концентрация АТР превышает его равновесную концентрацию. Именно это отклонение от равновесия делает АТР основным источником химической энергии в клетке.
На возможность спонтанного протекания реакции указывают Кeq и ∆G°
Способность реакции протекать до конца можно выразить с помощью константы равновесия. Для реакции, где а молей вещества А взаимодействует с b молями вещества В с образованием с молей вещества Cud молей вещества D
а А + bВ —> сС + dD
константа равновесия Кeq или просто К определяется по уравнению
![]()
где [Аeq] — концентрация А, [Вeq] — концентрация В и т. д. в состоянии равновесия. Высокое значение К означает, что реакция протекает до тех пор, пока реагирующие вещества практически полностью не превратятся в продукты реакции.
Гиббс показал, что ∆G (изменение свободной энергии) любой химической реакции является функцией стандартного изменения свободной энергии (∆G°), характеристического параметра реакции, и концентраций исходных веществ и продуктов реакции:
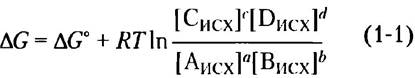
где [Аисх] — исходная концентрация А и т. д., R - универсальная газовая постоянная, T — абсолютная температура.
∆G — это мера отклонения системы от положения равновесия. При достижении равновесия осуществление работы невозможно: ∆G = 0. В данном случае [Аисх] = [Аeq] и т. д. для всех реагирующих веществ и продуктов реакции, так что
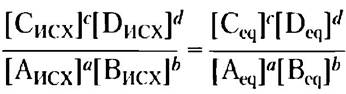
Подставляя в уравнение 1-1 ∆G = 0 и К = [Сисх]c[Dисх] d/[Aисх] a [Bисх] b, получаем соотношение
∆G° = - RT InKeq
из которого видно, что ∆G° — это еще один способ (кроме Kеq) выражения движущей силы реакции. Поскольку Кeq можно измерить эксперименталь-
но, мы можем вычислить ∆G°, термодинамический параметр, характеристический для реакции.
Единицей измерения ∆G и ∆G° является Дж/моль или кал/моль. При Кeq » 1 ∆G° — большое отрицательное число, при Keq « 1 ∆G° — большое положительное число. Из таблиц экспериментальных значений Кeq или ∆G° можно легко определить, какие реакции идут до конца, а какие нет.
Следует сделать одно замечание относительно интерпретации ∆G°: термодинамические константы подобного рода указывают, где устанавливается окончательное равновесие для данной реакции, но они ничего нам не говорят о том, как быстро достигается это равновесие. Скорости реакций подчиняются законам кинетики, на которых мы остановимся в гл. 6.
Ферменты способствуют продвижению химических реакций
Все биологические макромолекулы гораздо менее стабильны с точки зрения термодинамики, чем их мономерные звенья, но с точки зрения кинетики они весьма стабильны: без катализатора их распад протекает настолько медленно (длительность процесса измеряется годами), что во временной шкале, в которой существуют живые организмы, их можно считать устойчивыми. Практически все химические реакции в клетке протекают со значительными скоростями только благодаря наличию ферментов — биологических катализаторов, которые, как и любые другие катализаторы, многократно повышают скорость специфических химических реакций и при этом в данных реакциях не расходуются.
Путь от реагирующего вещества (или веществ) к продукту (продуктам) практически неизбежно проходит через энергетический барьер, называемый активационным барьером (рис. 1-27). Для протекания реакции необходимо преодолеть этот барьер. Разрыв существующих и создание новых связей обычно требует деформации существующих связей, приводящей к возникновению переходного состояния с более высокой свободной энергией, чем у реагирующих веществ и продуктов реакции. Переходное состояние характеризуется наивысшей точкой на энергетической диаграмме, а разница в энергии между реагирующим веществом в его основном состоянии и в переходном состоянии называется энергией активации ∆G*. Фермент катализирует реакцию путем создания подходящих условий для достижения переходного состояния, он комплементарен структуре переходного состояния по стереохимии, полярности и заряду. Связывание фермента с веществом в переходном состоянии является экзергоническим процессом; энергия, которая выделяется в результате этого связывания, снижает энергию активации данной реакции и значительно повышает скорость процесса.
Рис. 1-27. Изменения энергии при химической реакции. Активационный барьер (характеризующий переходное состояние, см. гл. 6) в реакции превращения исходного вещества А в продукт В должен быть преодолен, даже при условии, что продукты реакции более стабильны, чем исходные вещества (большое отрицательное значение ∆G). Энергию, необходимую для преодоления активационного барьера, называют энергией активации (∆G*). Ферменты катализируют реакцию, снижая активационный барьер. Они связываются с молекулами, находящимися в переходном состоянии, и эта энергия связывания снижает энергию активации со значения ∆G*некат (синяя кривая) до ∆G'кат(красная кривая). (Заметьте, что энергия активации не связана с изменением свободной энергии ∆G.)
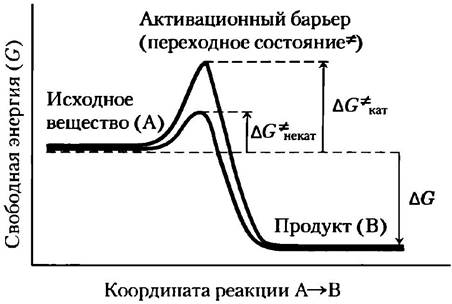
Еще одним достоинством ферментативного катализа является возможность связывания двух или большего числа реагирующих веществ на поверхности фермента на близком расстоянии друг от друга и в стереоспецифической ориентации, благоприятствующей протеканию реакции. Это на несколько порядков повышает вероятность продуктивных столкновений между реагирующими веществами. В результате действия перечисленных и некоторых других факторов, обсуждаемых в гл. 6, скорости ферментативных реакций примерно в 1012 раз превышают скорости некатализируемых реакций. (Это в миллион миллионов раз быстрее!).
Биологические катализаторы, за редкими исключениями, представляют собой белки (иногда каталитические функции может выполнять молекула РНК, см. гл. 26 и 27). Опять же за немногими исключениями, каждый фермент катализирует специфическую реакцию, и каждая реакция в клетке катализируется особым ферментом. Понятно, что каждой клетке необходимы тысячи различных ферментов. Многообразие ферментов, их специфичность (способность различать реагирующие вещества) и возможность регуляции позволяют клетке селективно снижать активационные барьеры. Эта селективность чрезвычайно важна для эффективной регуляции клеточных процессов. Позволяя тем или иным реакциям протекать со значительными скоростями в определенные периоды времени, ферменты регулируют перенос веществ и энергии в клеточных процессах.
Тысячи ферментативных химических реакций в клетке организованы в многочисленные последовательности, называемые метаболическими путями, в которых продукт одной реакции является исходным веществом для другой. Некоторые метаболические пути служат для разложения органических веществ до простых конечных продуктов, а высвобождаемая химическая энергия направляется на необходимые клетке, нужды. Вместе все реакции разложения, протекающие с высвобождением свободной энергии, называют катаболизмом. Энергия, выделяющаяся в реакциях катаболизма, расходуется для синтеза АТР. В результате внутриклеточная концентрация АТР значительно превышает его равновесную концентрацию, так что для реакции распада АТР ∆G — большая отрицательная величина. Аналогичным образом в результате метаболизма образуются переносчики электронов в восстановленной форме — NADH и NADPH, причем обе молекулы могут отдавать электроны в процессах, идущих с образованием АТР, или способствовать протеканию восстановительных стадий в реакциях биосинтеза.
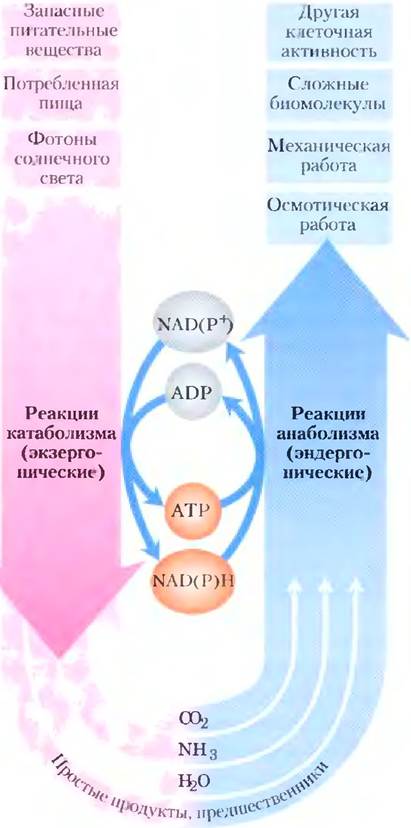
Другие метаболические пути начинаются от небольших молекул-предшественников и превращают их во все более крупные и сложные молекулы, в том числе белки и нуклеиновые кислоты. Такие синтетические реакции, которые неизбежно протекают с затратами энергии, вместе называют анаболизмом. Общая сеть ферментативных реакций составляет метаболизм клетки. АТР, а также эквивалентные ему по энергетическому содержанию нуклеозидтрифосфаты цитидин- трифосфат (СТР), уридинтрифосфат (UTP) и гуанозинтрифосфат (GTP) являются связующим звеном между катаболическими и анаболическими элементами этой сети (см. схему на рис. 1-28). Метаболические пути, затрагивающие основные компоненты клетки — белки, жиры, углеводы и нуклеиновые кислоты, — практически идентичны во всех живых организмах.
Рис. 1-28. Роль АТР в метаболизме. АТР является интермедиатом многих процессов, идущих с потреблением и с выделением энергии. Его значение для клетки сравнимо со значением денег для экономики: он «зарабатывается/производится» в экзергонических реакциях и «тратится/потребляется» в эндергонических реакциях. Никотинамидаден индинуклеотид(фосфат) NAD(P)H - переносчик электронов, который принимает электроны, высвобождающиеся в окислительных реакциях, а затем отдает их в различных восстановительных реакциях биосинтеза. В клетке этот важный для анаболических процессов кофактор присутствует в сравнительно низкой концентрации, поэтому он должен постоянно генерироваться в процессах катаболизма.
Сбалансированная и экономичная работа клетки достигается путем регуляции метаболизма
Живые клетки не только постоянно синтезируют тысячи различных типов углеводов, белков, жиров, нуклеиновых кислот и их мономеров, но производят их ровно в том количестве, которое необходимо клетке в конкретных условиях. Например, в условиях быстрого роста необходимо большое количество предшественников белков и нуклеиновых кислот, а при отсутствии роста их нужно гораздо меньше. Ключевые ферменты всех метаболических путей регулируются таким образом, чтобы каждый тип молекул-предшественников синтезировался в необходимом в данный момент количестве.
Рассмотрим метаболический путь синтеза аминокислоты изолейцина в клетках Е. coli. Этот метаболический путь имеет пять стадий, которые катализируют пять различных ферментов (интермедиаты процесса обозначены буквами от А до F):
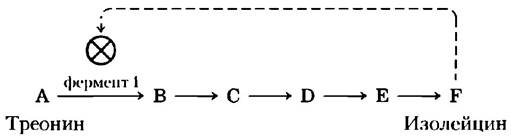
Если клетка начинает производить изолейцина больше, чем нужно для синтеза белка, то неиспользованные молекулы изолейцина накапливаются и ингибируют каталитическую активность первого фермента данного метаболического пути, что немедленно приводит к снижению уровня синтеза изолейцина. Такая регуляция по принципу обратной связи поддерживает баланс между образованием и расходом метаболитов. (По всей книге символом![]() обозначено ингибирование ферментативной реакции.)
обозначено ингибирование ферментативной реакции.)
Концепция дискретных метаболических путей важна для нашего понимания метаболизма, но она очень сильно упрощает реальную ситуацию. В клетке присутствуют тысячи метаболитов, многие из которых задействованы далеко не в одном метаболическом пути. Метаболизм правильнее представлять, как сеть взаимосвязанных и взаимозависимых путей. Изменение концентрации лишь одного метаболита может сказаться на других метаболических путях и привести к переходу на другие пути преобразования веществ. Кажется, невозможным понять и количественно описать столь сложный комплекс взаимосвязей между метаболитами и метаболическими путями, однако существуют новые подходы к решению этой проблемы (гл. 15), которые уже вносят важный вклад в понимание системы общей регуляции метаболизма. Кроме того, клетки регулируют синтез своих собственных катализаторов — ферментов — в ответ на возрастание или снижение потребности в том или ином продукте метаболизма; этот вопрос рассматривается в гл. 28. Экспрессия генов (перевод информации, содержащейся в ДНК, в клеточные белки) и синтез ферментов являются дополнительными уровнями контроля клеточного метаболизма, которые также необходимо учитывать при описании полной системы регуляции метаболизма в клетке.
Краткое содержание раздела 1.3 Физические основы биохимии
■ Живые клетки — это открытые системы, которые обмениваются с окружающей средой веществом и энергией и используют энергию для поддержания внутри себя динамического стационарного состояния, далекого от равновесия с окружающей средой. Клетки добывают энергию из солнечного света или топливных молекул и превращают ее из потока электронов в химические связи в молекуле АТР.
■ Способность химической реакции приходить к равновесию можно выразить с помощью изменения свободной энергии Гиббса (∆G), которая имеет две составляющие: изменение энтальпии (∆Н) и изменение энтропии (∆S). Эти переменные связаны между собой уравнением: ∆G = ∆Н — T∆S.
■ Если ∆G реакции — отрицательная величина, такая реакция называется экзергоггической и протекает до образования конечных продуктов; если ∆G — положительная величина, реакция называется эндергонической и протекает в обратном направлении. ∆G суммарного процесса есть сумма величин ∆G всех реакций.
■ Превращение АТР в Pi и ADP или в РРi и АМР является экзергоническим процессом (большое отрицательное значение ∆G), поэтому многие эггдергонические реакции могут протекать благодаря сопряжению с этим вьсокоэкзергоническим процессом.
■ Стандартное изменение свободной энергии реакции (∆G°) — термодинамический параметр, связанный с константой равновесия: ∆G° = -RTInKeq.
■ Большинство экзергонических реакций в клетке протекают со значительными скоростями только благодаря катализу ферментами. Ферменты стабилизируют переходное состояние, снижают энергию активации ∆С* и тем самым повышают скорость реакции гга порядки величигг. Каталитическая активность ферментов в клетке регулируется.
■ Метаболизм представляет собой совокупность многочисленных взаимосвязанных реакций, в которых происходит последовательное превращение клеточных метаболитов. Каждая последовательность реакций регулируется таким образом, чтобы обеспечивать клетку всем необходимым в данный момент времени с наименьшими затратами энергии.