ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
1. ОСНОВЫ БИОХИМИИ
1.2. Химические основы биохимии
Биохимия ставит своей целью объяснить биологические принципы в химических терминах. В конце XVIII в. химики пришли к выводу, что составы живой и неживой материи принципиальным образом различаются. Антуан Лавуазье (1743-1794) отмечал относительную химическую простоту «минерального мира» в отличие от сложности «мира растений и животных», который, как он знал, был построен из соединений, богатых такими элементами, как углерод, кислород, азот и фосфор.
В первой половине XX в. биохимические исследования разложения глюкозы, проведенные параллельно в дрожжах и в мышечных клетках животных, выявили удивительное химическое сходство этих двух, казалось бы, таких непохожих типов клеток: разложение глюкозы в обоих случаях проходило с образованием десяти одних и тех же промежуточных продуктов и при участии десяти тех же самых ферментов. Последующее изучение многих других биохимических процессов во множестве различных организмов подтвердило общность этого наблюдения, что было метко сформулировано в 1954 г. Жаком Моно: «Что верно для Е. coli, то верно и для слона». Установившаяся сегодня точка зрения об общности происхождения всех организмов от одного эволюционного предшественника частично основана на этой повсеместно наблюдаемой универсальности химических превращений и промежуточных продуктов, которую часто называют «биохимическим единством».
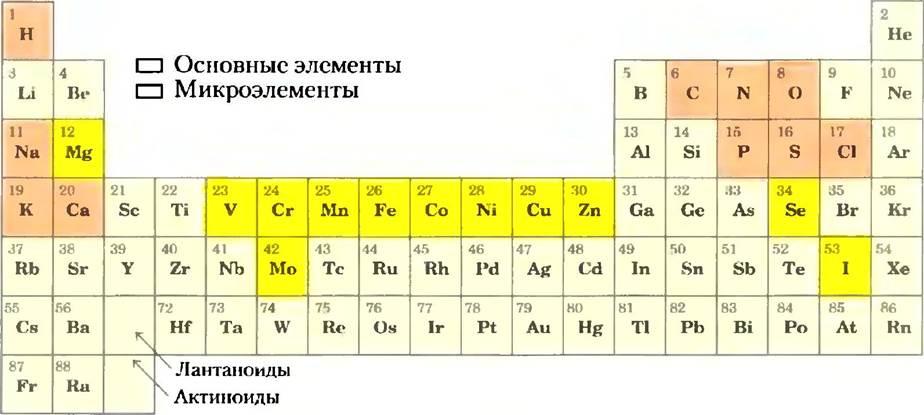
Для живых организмов важными являются лишь менее 30 из более чем 90 существующих в природе химических элементов. Большинство элементов живой материи имеют небольшой атомный номер: лишь пять имеют атомные номера выше 34 (селен) (рис. 1-12). В клетках преобладают четыре элемента: водород, кислород, азот и углерод; в большинстве клеток на их долю приходится более 99% массы. Эти наиболее легкие элементы способны образовать соответственно одну, две, три и четыре устойчивые связи, причем в соответствии с общим правилом чем легче элемент, тем более прочные связи он образует. Микроэлементы (рис. 1-12) составляют очень малую долю массы человеческого тела, однако они играют важную роль, поскольку обычно необходимы для функционирования специфических белков, в том числе и многих ферментов. Например, способность молекулы гемоглобина переносить кислород полностью зависит от наличия четырех ионов железа, которые составляют лишь 0,3% массы этой молекулы.
Рис. 1-12. Элементы, необходимые для жизни и здоровья животных. Основные элементы (отмечены оранжевым цветом) являются структурными компонентами клеток и тканей; ежедневная потребность в них исчисляется в граммах. Потребность в следовых элементах (отмечены желтым цветом) гораздо ниже: человеку требуется в день несколько миллиграммов Fе, Сu и Zn, а остальных элементов еще меньше. Потребность в элементах у растений и микроорганизмов аналогична тому, что изображено на данном рисунке, однако способы получения этих элементов различаются.
Биомолекулы представляют собой органические соединения, содержащие различные функциональные группы
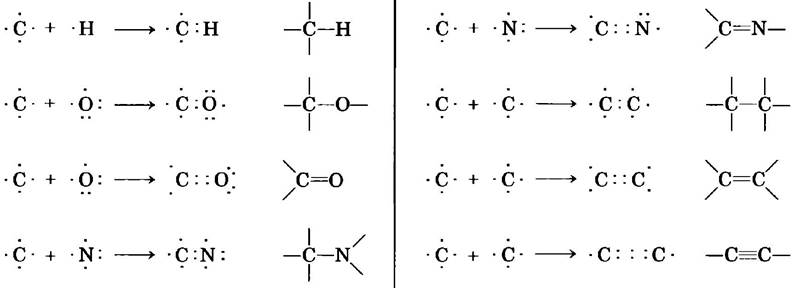
Химические свойства живых организмов в первую очередь связаны с тем, что они содержат углерод, на долю которого приходится более половины сухой массы клеток. Углерод способен образовывать одинарные связи с атомами водорода, одинарные и кратные (двойные и тройные) между атомами в углеродной цепи, а также связи с атомами кислорода (одинарные и двойные), азота (одинарные, двойные и тройные) и с другими элементами (рис. 1-13). Для биологии наиболее важное значение имеет способность атомов углерода образовывать очень стабильную одинарную связь с четырьмя другими атомами углерода. Кроме того, два атома углерода могут «обобществить» две или три пары электронов, в результате чего возникает двойная или тройная связь.
Рис. 1-13. Многообразие углеродных связей. Углерод может образовывать одинарные, двойные и тройные ковалентные связи (все показаны красным цветом), в том числе и с другими атомами углерода. Тройные связи в биомолекулах встречаются редко.
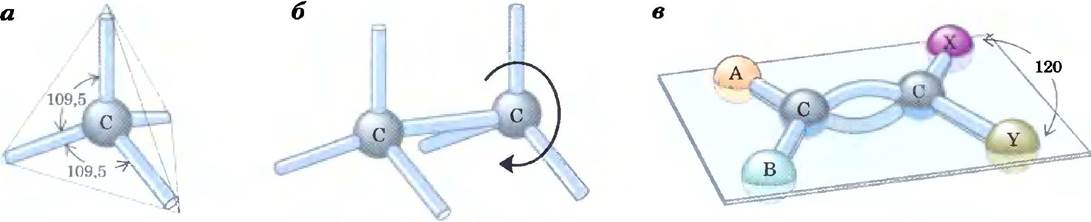
Четыре одинарные ковалентные связи, образуемые атомом углерода, направлены в пространстве к вершинам правильного тетраэдра, причем угол между двумя любыми связями составляет около 109,5° (рис. 1-14), а длина связей примерно равна 0,154 нм. Все атомы или группы в таких тетраэдрических молекулах могут свободно вращаться вокруг одинарных связей, за исключением тех случаев, когда к двум соседним атомам углерода присоединены очень большие или высокозаряженные группы атомов. Двойная углерод-углеродная связь короче одинарной (около 0,134 нм) и более жесткая, так что вокруг нее вращение практически невозможно.
Рис. 1-14. Геометрия углерод-углеродных связей, а) Четыре одинарные связи, которые образует атом углерода, располагаются в пространстве в виде правильного тетраэдра; б) вокруг одинарных связей углерод-углерод возможна полная свобода вращения, как это показано на примере молекулы этана (СН3-СН3); в) двойная углерод-углеродная связь короче и не допускает свободного вращения. Оба атома углерода, образующие двойную связь, а также атомы А, В, X и Y лежат в одной плоскости.
Связанные ковалентной связью атомы углерода в составе биомолекул могут образовывать линейные цепи, разветвленные цепи и циклические структуры. Возможно, что в процессе возникновения и эволюции живых организмов способность углерода образовывать разные типы связей с атомами углерода и других элементов стала решающим фактором, определившим выбор именно соединений углерода в качестве основного строительного материала клеток. Никакой другой химический элемент нс способен создавать молекулы с таким разнообразием размеров, форм и функциональных групп.
Большинство биомолекул можно рассматривать в качестве производных углеводородов, в которых атомы водорода заменены функциональными группами, которые придают различные химические свойства молекуле. При этом образуются различные классы органических соединений. Типичные классы органических соединений: спирты содержат одну или несколько гидроксильных групп; амины — аминогруппы; альдегиды и кетоны — карбонильные группы; карбоновые кислоты — карбоксильные группы (рис. 1-15). Многие биомолекулы полифункциональны, т. с. содержат две или несколько разных функциональных групп (рис. 1-16), каждая из которых имеет свои химические характеристики и участвует в специфических реакциях. Химическая «индивидуальность» соединения определяется химией его функциональных групп и их расположением в трехмерном пространстве.
Рис. 1-15. Некоторые характерные функциональные группы биомолекул. На данном рисунке и далее в книге буквой R обозначается любой заместитель (функциональная группа). Это может быть простой атом водорода, но обычно это какой-либо углеродсодержащий остаток. Если в молекуле несколько заместителей, их обозначают как R1, R2 и т. д.
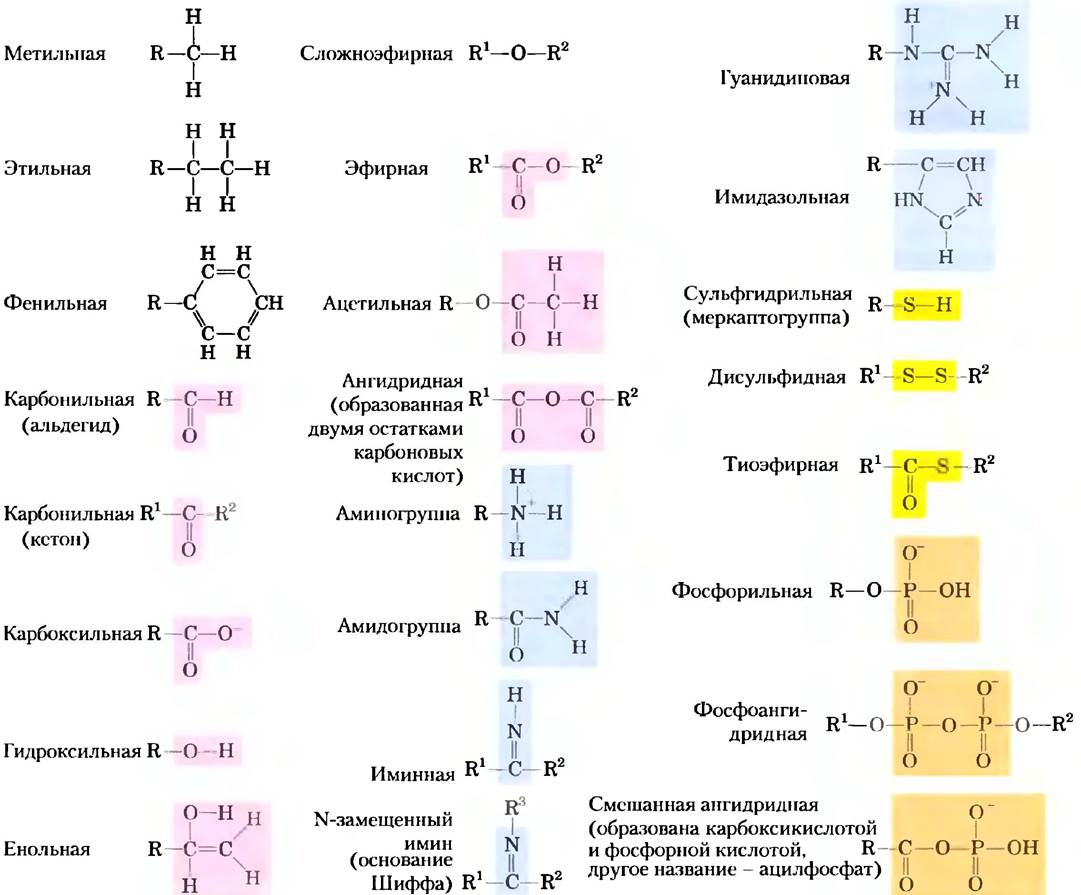
Рис. 1-16. Некоторые характерные функциональные группы одной молекулы. Ацетилкофермент А (ацетил-СоА) является переносчиком ацетильных групп в некоторых ферментативных реакциях. На структурной формуле молекулы показаны функциональные группы. Как мы увидим в гл. 2, некоторые из этих функциональных групп могут существовать в протонированной и непротонированной формах в зависимости от pH среды. В пространственной модели атомы N изображены синим цветом, С черные, Р оранжевые, О красные, а Н белые. Желтым цветом слева обозначен атом серы в тиоэфирной связи между ацетильным остатком и коферментом А.
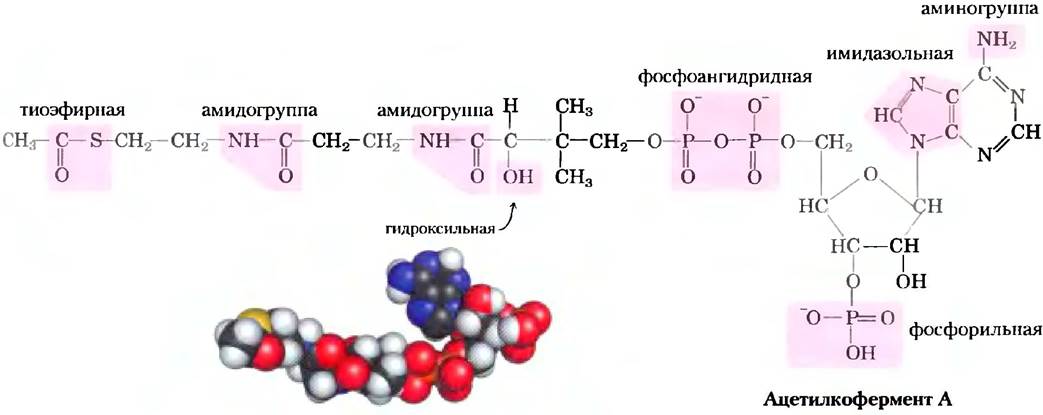
Клетки содержат универсальный набор небольших молекул
В водной фазе (цитозоле) каждой клетки растворено около тысячи различных небольших органических молекул с молекулярной массой от -100 до -500 (в дополнении 1-1 объясняются различные способы выражения молекулярных масс). Ключевые метаболиты основных метаболических путей, сохранившихся в ходе эволюции, обнаруживаются практически во всех клетках. Этот набор молекул включает основные аминокислоты, нуклеотиды, сахара и их фосфорилированные производные, а также ряд моно-, ди- и трикарбоновых кислот. Все эти молекулы полярны или заряжены, растворимы в воде и присутствуют в микромолярных или миллимолярных концентрациях. Они удерживаются внутри клетки, поскольку не могут самостоятельно проникнуть сквозь плазматическую мембрану. Только специфические мембранные транспортные структуры обеспечивают перемещение некоторых молекул в клетку или из нее, а также между различными компартментами в эукариотической клетке. Единый набор одних и тех же веществ в клетках живых организмов является проявлением универсальности метаболических принципов и отражает эволюционный консерватизм метаболических процессов, возникших в самых первых клетках.
Однако некоторые небольшие биологические молекулы встречаются только в определенных типах клеток или организмов. Например, сосудистые растения кроме обычного набора молекул содержат небольшие молекулы — вторичные метаболиты, которые играют специфическую роль в жизни растений. К этим метаболитам относятся соединения, придающие растениям характерные запахи, и такие вещества, как морфин, хинин, никотин и кофеин, которые люди высоко ценят за их физиологическое действие, а растения используют совсем для других целей. Для обозначения полного набора небольших молекул в конкретной клетке был предложен термин «пул метаболитов» или «метаболом» по аналогии с термином «геном» (см. выше и более подробно — в разд. 1.5).
Основными компонентами клеток являются макромолекулы
Многие биологические молекулы представляют собой макромолекулы, т. е. полимеры с молекулярной массой свыше 5000, которые построены из относительно простых предшественников. Короткие полимеры называют олигомерами (от греч. oligos — несколько). Белки, нуклеиновые кислоты и полисахариды — все это макромолекулы, состоящие из мономеров с молекулярной массой 500 и ниже. На синтез макромолекул клетка расходует основной запас своей энергии. Далее макромолекулы могут собираться в надмолекулярные комплексы, формируя такие функциональные структуры, как рибосомы. В табл. 1-1 представлены основные классы биомолекул в клетках бактерии Е. coli.
Таблица 1-1. Молекуяярный состав клетки Е. coli
Процент от общей массы клетки |
Примерное число типов молекул |
|
Вода |
70 |
1 |
Белки |
15 |
3 000 |
Нуклеиновые кислоты |
||
ДНК |
1 |
1-4 |
РНК |
6 |
>3 000 |
Полисахариды |
3 |
10 |
Липиды |
2 |
20 |
Мономерные молекулы и промежуточные соединения |
2 |
500 |
Неорганические ионы |
1 |
20 |
Дополнение 1-1. Абсолютная и относительной молекулярная масса. Единицы измерения
Обычно для описания молекулярных масс используют два эквивалентных способа. Оба способа можно встретить в этой книге. Во-первых, относительная молекулярная масса, обозначаемая М (или Мr). Относительная молекулярная масса соединения определяется как отношение массы его молекулы к одной двенадцатой массы атома углерода-12 (12С). Поскольку М определена как отношение, это величина безразмерная. Во-вторых, абсолютная молекулярная масса, обозначаемая т. Это просто-напросто масса одной молекулы, т. е. отношение молярной массы (массы 1 моль вещества) к числу Авогадро (числу молекул в 1 моль). Абсолютная молекулярная масса измеряется в дальтонах (Да). Один дальтон (1 Да) равен одной двенадцатой массы атома углерода-12.1кДа = 1000 Да, 1 МДа = 1 000 000 Да.
Рассмотрим молекулу, молекулярная масса которой в 1000 раз превышает молекулярную массу воды. Одинаково правильно записать М = 18 000 или m = 18 000 Да = 18 кДа. Однако неправильно: М = 18 000 Да.
При описании масс некоторых атомов или молекул их массу указывают в атомных единицах массы (обозначается как а.е.м. или а. е.). Одна атомная единица массы (1 а. е. м.) определяется как одна двенадцатая массы атома углерода-12. Поскольку экспериментально определенная масса атома 12С составляет 1,9926 • 10-23 г, 1 а. е. м. = 1,6606 • 10-24г. Атомные единицы массы принято использовать для описания масс пиков в масс-спектрометрии (см. доп. 3-2).
Белки, представляющие собой длинные полимеры, построенные из аминокислотных звеньев, составляют самую большую фракцию веществ клетки (после воды). Некоторые белки выполняют каталитическую функцию (ферменты), другие служат в качестве структурных элементов, рецепторов или переносчиков, участвующих в перемещении веществ в клетку и из нее. Белки, вероятно, являются наиболее многочисленными среди всех типов биомолекул; перечисление их многочисленных функций заняло бы слишком много места. Вместе все белки, функционирующие в данной клетке, называют протеомом клетки. Нуклеиновые кислоты (РНК и ДНК) представляют собой полимеры, построенные из нуклеотидов. С их помощью в клетке хранится и передается генетическая информация; кроме того, некоторые молекулы РНК выполняют структурные или каталитические функции в надмолекулярных комплексах. Полисахариды построены из простых сахаров, таких как глюкоза; они выполняют три основные функции: запасают энергию в клетке, составляют жесткий каркас клеточной стенки (у растений и бактерий) и служат внеклеточными элементами узнавания со специфическими участками связывания определенных белков других клеток. Короткие полимерные сахара (олигосахариды), связанные с белками или липидами на клеточной поверхности, играют роль специфических сигнальных молекул. Липиды (жиры или эфиры жирных кислот — производные нерастворимых в воде углеводородов) являются структурными компонентами мембран, запасными топливными веществами, пигментами или внутриклеточными сигнальными молекулами. Число мономерных звеньев в молекулах белков, нуклеиновых кислот, полисахаридов и липидов очень велико: молекулярные массы белков составляют от 5000 до миллиона, полисахаридов типа крахмала — до нескольких миллионов, нуклеиновых кислот — до нескольких миллиардов. Молекулы липидов имеют меньшие размеры (мол. масса от 750 до 1500), и их обычно не рассматривают в качестве макромолекул. Однако многие молекулы липидов способны к образованию крупных надмолекулярных структур, связанных нековалентными связями. Клеточные мембраны построены из гигантских агрегатов липидных и белковых молекул.
Поскольку последовательность белков и нуклеиновых кислот несет в себе много информации, эти молекулы часто называют информационными макромолекулами. Как упоминалось выше, некоторые олигосахариды также служат в качестве информационных молекул.
Трехмерная структура характеризуется конфигурацией и конформацией
Принципиальное значение для функционирования биомолекул, безусловно, имеет ковалентная структура и наличие функциональных групп, однако не менее важным является расположение в пространстве составляющих молекулу атомов, т. е. стереохимия молекулы. Углеродсодержащие вещества обычно существуют в виде стереоизомеров — молекул с одинаковыми химическими связями, но различной стереохимией, т. е. конфигурацией, определяющейся фиксированным расположением атомов в пространстве. Взаимодействия между биомолекулами неизбежно происходят стереоспецифически, т. е. требуют специфической конфигурации реагирующих молекул.
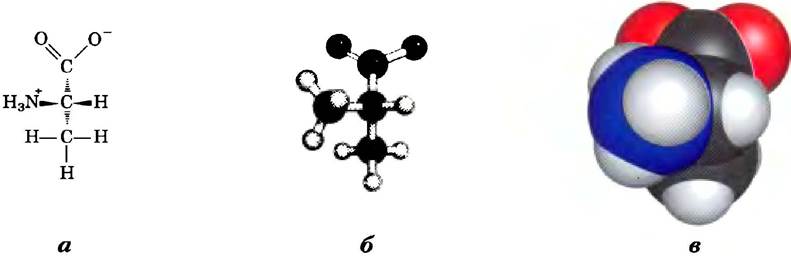
На рис. 1-17 представлено три способа стереохимического изображения структур простых молекул. Перспективная модель однозначным образом отражает специфическую стереохимическую структуру молекулы, однако углы взаимного расположения связей и длина связей доходчивее изображаются с помощью шаростержневых моделей. В СРК-моделях* радиусы всех атомов пропорциональны их вандерваальсовым радиусам, а контур молекулы описывает занимаемое ею пространство (т. е. часть пространства, из которого исключены атомы, входящие в состав других молекул).
*По первым буквам имен Р. Кори (R. Cory), Л. Полинга (L. Poling) и У. Л. Колтуна (W. L Koltun); другое название — spacefilling модели. — Прим. перев.
Рис. 1-17. Способы изображения молекул. Три модели показывают строение аминокислоты аланина, а) Перспективное изображение структурной формулы: темный клинышек (—) обозначает связь, в которой расположенный на широком конце атом выходит из плоскости рисунка по направлению к читателю; заштрихованный клинышек (>) обозначает связь, уходящую под поверхность рисунка; б) шаростержневая модель, на которой хорошо видны относительные длины связей и углы между ними; в) СРК-модель, в которой относительные размеры всех атомов соответствуют их ван-дер-ваальсовым радиусам.
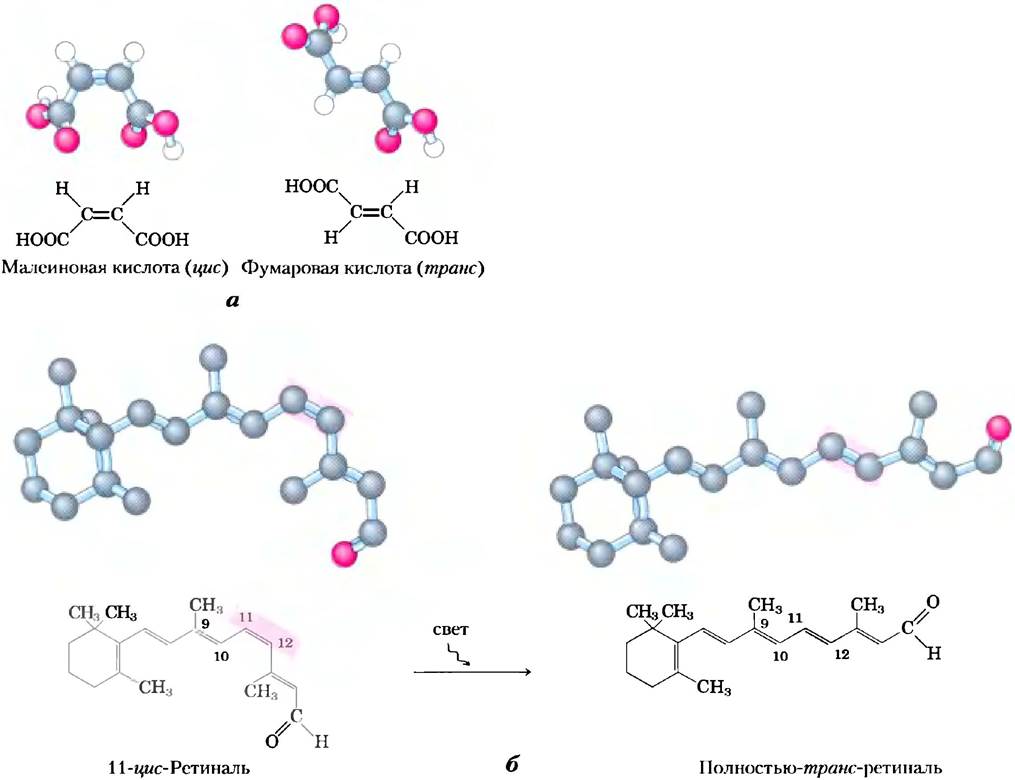
Конфигурация молекулы определяется наличием 1) двойной связи, вокруг которой невозможно свободное вращение, или 2) хирального центра, относительно которого замещающие группы расположены определенным образом. Отличительной особенностью конфигурационных изомеров является их неспособность превращаться друг в друга без разрыва одной или нескольких ковалентных связей. На рис. 1-18 представлены модели малеиновой кислоты и ее изомера — фумаровой кислоты. Эти соединения — геометрические изомеры или цис- транс-изомеры; они различаются расположением заместителей относительно двойной связи (от лат.
cis — на этой стороне, т. е. с одной стороны от двойной связи, trans — через, т. е. по разные стороны от двойной связи). Таким образом, малеиновая кислота (в нейтральной среде цитоплазмы в виде малеата) — циc-изомер, а фумаровая (фумарат) — трансизомером. Оба вещества хорошо изучены, имеют характерные свойства и могут быть отделены друг от друга. Участок связывания одной из этих молекул (например, на молекуле фермента) не подходит для связывания другой, что объясняет различную биологическую роль двух соединений со сходной химической структурой.
Рис. 1-18. Конфигурация геометрических изомеров. а) Такие изомеры, как малеиновая и фумаровая кислоты, не могут превращаться друг в друга без разрыва ковалентных связей, требующего больших затрат энергии. б) На начальном этапе восприятия света в сетчатке позвоночных происходит поглощение видимого света 11-цис-ретиналем. Энергия поглощенного света (около 250 кДж/моль) способствует превращению 11-цис-ретиналя в полностью транс-ретиналь, что запускает электрические изменения в клетке сетчатки и приводит к возникновению нервного импульса. (Обратите внимание, что в шаростержневых моделях ретиналя атомы водорода не изображены.)
В другом типе стереоизомерии четыре различных заместителя, связанные с тетраэдрическим атомом углерода, могут располагаться в пространстве двумя различными способами. В результате возникают две конфигурации (рис. 1-19) и два стереоизомера с похожими или идентичными химическими свойствами, но с определенными физическими или биологическими особенностями. Атом углерода с четырьмя различными заместителями называют асимметрическим.
Рис. 1-19. Молекулярная асимметрия: хиральные и ахиральные молекулы, а) Если атом углерода связан с четырьмя разными группами или атомами (А, В, X, Y), то последние могут расположиться двумя способами. При этом образуются две структуры, представляющие собой несовместимые зеркальные отражения друг друга (энантиомеры). Такой асимметрический атом углерода называют хиральным атомом или хиральным центром, б) Когда атом углерода связан только с тремя разными группами или атомами (т. е. один и тот же заместитель встречается дважды), возможна лишь одна пространственная конфигурация. Такую молекулу называют симметрической или ахиральной. В таком случае молекулу можно совместить с ее зеркальным отражением: молекулу, изображенную перед зеркалом (слева), нужно повернуть против часовой стрелки (ось вращения проходит сверху вниз от А к С), и она совместится с молекулой в зеркале.
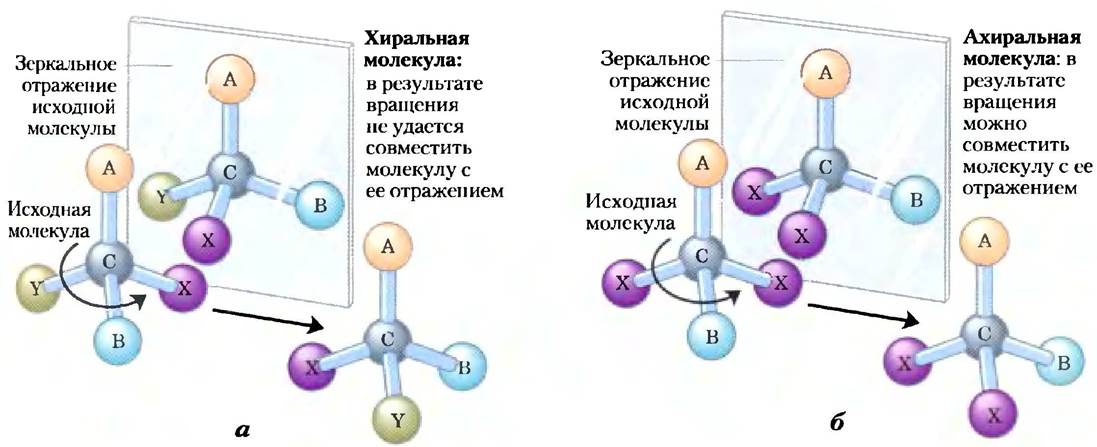
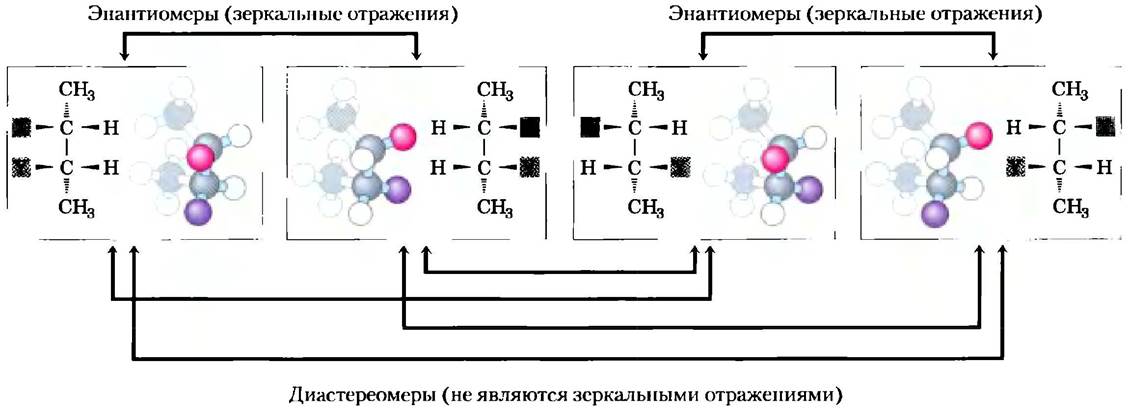
Такой атом является хиральным центром (от трем. chiros — рука; для некоторых хиральных молекул очень подходят модели левой и правой руки). Молекула с единственным хиральным атомом углерода может иметь два стереоизомера; при наличии двух или более (n) хиральных атомов возможно существование 2n стереоизомеров. Структуры некоторых стереоизомеров являются зеркальными отражениями друг друга; их называют энантиомерами (рис. 1-19). Пары стереоизомеров, не являющихся зеркальными отражениями, называют диастереомерами (рис. 1-20).
Рис. 1-20. Два типа стереоизомеров. Приведены изображения четырех различных 2,3-дизамещенных бутанов (число асимметричных атомов углерода n = 2, следовательно, возможно существование 2n = 4 стереоизомеров). Каждое вещество представлено в отдельной рамке с помощью перспективного изображения структурной формулы и шаростержневой модели, которая повернута различным образом, чтобы дать возможность читателю увидеть все группы. Две пары стереоизомеров являются зеркальными отражениями друг друга, т. е. энантиомерами. Другие не являются зеркальными отражениями, они - диастереомеры.
Луи Пастер в 1848 г. первым обнаружил, что энантиомеры имеют практически идентичные химические свойства, но их можно различить при пропускании луча плоскополяризованного света (см. дополнение 1-2). Растворы индивидуальных (отделенных друг от друга) энантиомеров вращают плоскость поляризации света в противоположных направлениях, но их эквимолярные растворы (рацемические смеси) не обладают оптической активностью. Соединения, не имеющие хиральных центров, не способны вращать плоскость поляризации плоскополяризованного света.
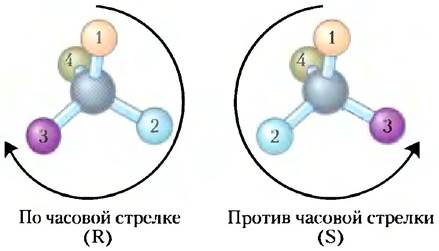
Ключевые договоренности. Учитывая важность стереохимической структуры в реакциях между биомолекулами (см. ниже), биохимик обязан называть и изображать структуру каждой молекулы таким образом, чтобы ее стереохимия была очевидной. Для соединений, содержащих более одного хирального центра, наиболее подходящей системой номенклатуры является R/S-система, где определен приоритет каждого атома, соединенного с хиральным атомом углерода. Тогда наиболее распространенные заместители можно расположить в следующем порядке:
-ОСН2 > -ОН > -NH2 > -СООН > -CHO > -СН2ОН > -CH3 > H
В соответствии с R/S-системой молекулу нужно изображать таким образом, чтобы хиральный атом оказывался перед функциональной группой с наименьшим приоритетом (4 на схеме молекулы; с. 37). Если приоритет остальных трех групп (от 1 до 3) снижается по часовой стрелке, то атом имеет R-конфигурацию (от лат. rectus — правый); если приоритет трех групп снижается против часовой стрелки, то мы имеем дело с S-конфигурацией (от лат. sinister — левый). Таким образом, каждый хиральный атом обозначается как R или S. При записи формулы вещества необходимо указывать эти обозначения, и тогда становится понятна стереохимия каждого хирального центра.
Дополнение 1-2 Луи Пастер и оптическая активность: In vino veritas
Луи Пастер столкнулся с явлением оптической активности в 1843 г. в процессе исследования кристаллических осадков, образующихся па дне бочек с вином (осадок в вине оказался винной кислотой, иначе называемой рацемической, от лат. racemus — кисть винограда). С помощью тонкого пинцета он разделял два типа кристаллов, которые были идентичны по форме, но как зеркальные отражения друг друга. Оба типа кристаллов имели все химические свойства винной кислоты, однако раствор одного типа кристаллов вращал плоскополяризованный свет влево (левовращающая форма), а раствор других кристаллов — вправо (правовращающая форма). Позднее Пастер описывал свой эксперимент:
В изомерных телах элементы и их пропорции одинаковы, различается лишь расположение атомов... Нам известно, что, с одной стороны, молекулярная организация двух винных кислот асимметрична, а с другой стороны — что эта организация абсолютно идентична, за исключением направления этой асимметрии. Расположены атомы правовращающей формы кислоты в виде правозакрученной спирали или в вершинах неправильного тетраэдра, а может, они размещены каким-то другим асимметричным образом? Ним это неизвестно. *
* Из лекции Пастера па заседании Химического общества в Париже в 1883 г; [DuBos, R. (1976) Louis Pasteur: Free lance of Science, p. 95, Charles Scribner’s Sons, New York].
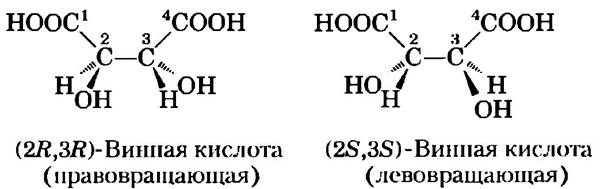
Теперь мы это знаем. Рентгенография кристаллов, осуществленная в 1951 г., подтвердила, что структуры лево- и правовращающих форм винной кислоты являются зеркальными отражениями друг друга; была также установлена абсолютная конфигурация каждой формы (рис. 1). С помощью того же подхода было продемонстрировано, что, хотя аминокислота аланин имеет две стереоизомера (L и D), аланин в белках всегда присутствует только в виде одной из них (L-изомер, гл. 3).
Луи Пастер, 1822-1895

Рис. 1. Пастер разделил кристаллы двух стереоизомеров винной кислоты и показал, что растворы отдельных форм вращали плоскополяризованный свет в одинаковой степени, но в противоположных направлениях. Эти правовращающая и левовращающая формы были позднее названы (R, R)- и (S, S)-изомерами. Принцип R/S-номенклатуры изложен в тексте.
Еще одна система номенклатуры стереоизомеров — D/L-система — рассматривается в гл. 3. Молекула с одним хиральным центром (например, два изомера глицеральдегида) может быть однозначно описана с помощью любой из этих систем.
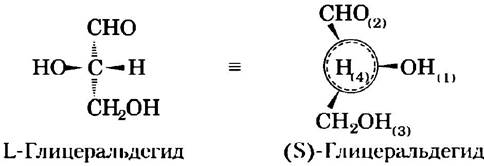
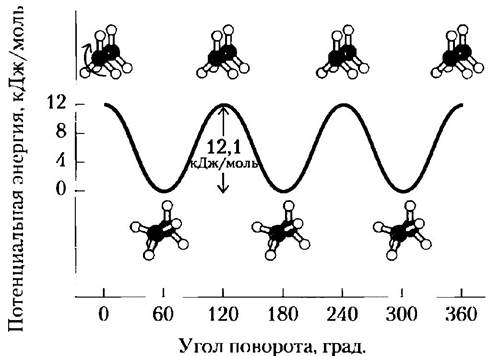
Следует различать конфигурацию и конформацию молекулы — положение в пространстве заместителей в результате свободного вращения вокруг одинарных связей без разрыва каких-либо связей. Например, в молекуле простого углеводорода этана возможно практически свободное вращение относительно связи углерод-углерод. В результате в зависимости от угла поворота возможно существование нескольких переходящих друг в друга конформаций молекулы этана (рис. 1-21). Две конформации представляют особый интерес: заторможенная, наиболее стабильная и, следовательно, преобладающая, и заслоненная, наименее стабильная. Невозможно выделить вещество в одной из этих конформаций, поскольку переходы из одной конформации в другую происходят постоянно. Однако если один или более атомов водорода у каждого углерода заменить функциональной группой, которая имеет большой объем или несет заряд, то свобода вращения вокруг связи С-С ограничивается, что в свою очередь снижает число возможных устойчивых конформаций производных этана.
Рис. 1-21. Конформации. Благодаря свободе вращения вокруг связи С-С в молекуле этана возможно существование многих конформаций. Как показано на шаростержневой модели, если поворачивать ближайший к читателю атом углерода с тремя прикрепленными к нему атомами водорода относительно дальнего атома углерода, то потенциальная энергия молекулы достигает максимума в полностью заслоненной конформации (угол поворота 0°, 120° и т. д.) и минимума в полностью заторможенной конформации (угол поворота 60°, 180° и т. д.). Поскольку энергетические различия сравнительно невелики, то происходят быстрые взаимопревращения двух форм (миллионы раз в секунду), так что их нельзя выделить по одной.
Взаимодействия между биомолекулами являются стереоспецифическими
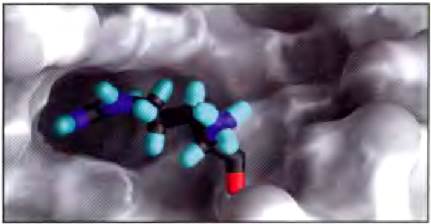
Биологические взаимодействия между молекулами стереоспецифичны: они возможны лишь в случае «правильной» стереохимической структуры реагирующих веществ. Трехмерная структура мелких и крупных биологических молекул, т. е. структура с учетом конфигурации и конформации молекулы, играет весьма важную роль в биологических взаимодействиях, например, между реагентом и его ферментом, гормоном и его рецептором на клеточной поверхности или антигеном и специфическим антителом (рис. 1-22). Изучение стереохимии биомолекул с помощью высокоточных физических методов является важной частью современных исследований в области структуры клетки и ее биохимических функций.
Рис. 1-22. Комплементарность макромолекулы и малой молекулы. Связывание белка с участком РНК из регуляторной области TAR в геноме вируса иммунодефицита человека (показан серым цветом) представлено на примере связывания амида аргинина (окрашенная молекула). Структура амида аргинина соответствует карману на поверхности РНК и удерживается в такой ориентации под действием нескольких нековалентных связей с РНК. Данное изображение молекулы РНК получено с помощью компьютерной программы GRASP, которая способна моделировать форму внешней поверхности макромолекулы, исходя из вандерваальсовых радиусов всех атомов в молекуле или из параметра «исключенного объема», т. е. объема, в который не может проникнуть молекула воды.
В живых организмах хиральные молекулы обычно присутствуют лишь в одной из возможных форм. Например, все аминокислоты в составе белков присутствуют исключительно в виде L-изомсров, а глюкоза встречается только в виде D-изомера. (Принципы номенклатуры стереоизомеров аминокислот изложены в гл. 3, сахаров — в гл. 7; для многих биомолекул наиболее удобна R/S-номенклатура, изложенная выше.) Напротив, при лабораторном синтезе соединения с асимметричным атомом углерода обычно образуются все возможные хиральные формы, например, смесь L- и D-изомеров. Живые клетки создают только одну хиральную форму биомолекул, поскольку синтезирующие их ферменты также являются хиральными.
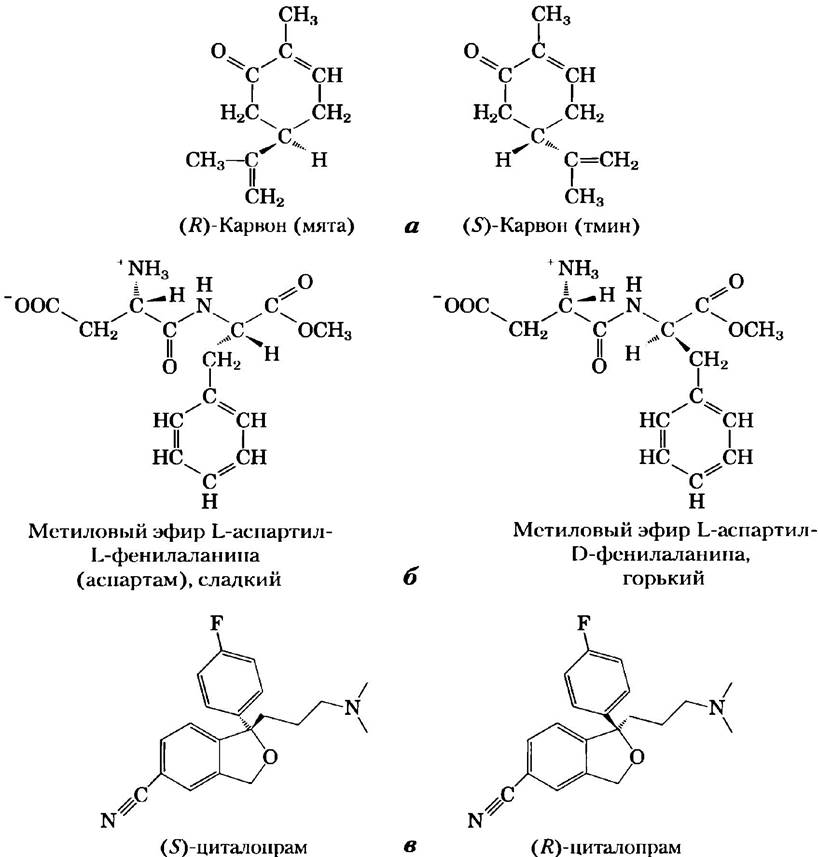
Стереоспецифичность, т. е. способность различать стереоизомеры, свойственна ферментам и другим белкам и является характерным элементом молекулярной «логики» живых организмов. Если участок связывания в молекуле белка комплементарен одному изомеру хирального соединения, он не может быть комплементарным другим изоформам по той же причине, по какой левая перчатка не годится для правой руки. На рис. 1-23 представлены два замечательных примера, иллюстрирующих способность биологических систем различать стереоизомеры.
Рис. 1-23. Стереоизомеры, различаемые человеком, а) Два стереоизомера карвона: (R)-карвон, выделяемый из масла мяты, имеет специфический мятный аромат; (S)-карвон из семян тмина пахнет тмином, б) Аспартам — это искусственный заменитель сахара, поступающий в продажу под разными торговыми названиями. Вкусовые рецепторы легко отличают его от горького стереоизомера, несмотря на то что эти вещества различаются лишь конфигурацией у одного из двух хиральных атомов углерода, в) Антидепрессант циталоп- рам (Целекса™) — селективный ингибитор обратного захвата серотонина — представляет собой рацемическую смесь двух стереоизомеров, из которых только (S)-циталопрам оказывает терапевтическое действие. Стереохимически чистый (S)-циталопрам (эсциталопрам оксалат) продается под торговым названием Лексапро. Как можно догадаться, эффективная доза Лексапро составляет половину эффективной дозы Целексы.
Основные классы химических реакций, встречающихся в биохимии, рассмотрены в гл. 13 в качестве введения перед обсуждением реакций метаболизма.
Краткое содержание раздела 1.2. Химические основы биохимии
■ Благодаря многообразию связей углерода возможно существование широкого набора углеродных скелетов с различными функциональными группами, придающими биомолекулам их биологическую и химическую специфичность.
■ В живых клетках встречается практически универсальный набор из нескольких сотен небольших молекул. Основные пути взаимных метаболических превращений этих молекул мало изменились в процессе эволюции.
■ Белки и нуклеиновые кислоты представляют собой линейные полимеры, состоящие из простых мономерных звеньев; их последовательность несет информацию, определяющую трехмерную структуру и биологические функции каждой молекулы.
■ Конфигурация молекулы изменяется только с разрывом ковалентной связи. Если атом углерода имеет четыре различные замещающие группы (хиральный атом), то эти заместители могут располагаться в пространстве двумя различными способами, образуя различающиеся по свойствам стереоизомеры. Биологической активностью обладает только один стереоизомер. Конформация молекулы определяет положение составляющих ее атомов в пространстве, которое может изменяться путем вращения атомов вокруг одинарных связей без разрыва ковалентных связей.
■ Взаимодействия между биомолекулами практически всегда стереоспецифичны: они требуют точной комплементарности реагирующих молекул.