ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.11. Регуляция клеточного цикла протеинкиназами
Одна из самых существенных функций фосфорилирования белков у эукариот заключается в регуляции клеточного цикла. Во время роста эмбриона и на стадиях более позднего развития клеточное деление происходит практически во всех тканях. Во взрослом организме большинство тканей находятся в состоянии покоя. «Решение» клетки делиться или не делиться имеет принципиальное значение для организма. Когда регуляторные механизмы, которые ограничивают клеточное деление, повреждены, клетка подвергается бесконтрольному делению, это приводит к катастрофическому результату — раку. Нормальное клеточное деление требует происходящих в строго определенном порядке биохимических стадий, гарантированно обеспечивающих каждую дочернюю клетку полным комплектом молекул, необходимых для жизни. Исследования регуляции клеточного деления в разных эукариотических клетках позволили выявить универсальные регуляторные механизмы. Сигнальные механизмы, подобные рассмотренным выше, играют ключевую роль в определении того, будет ли клетка делиться и когда это произойдет, а также обеспечивают правильный порядок прохождения стадий клеточного цикла.
Клеточный цикл протекает в четыре стадии
У эукариот клеточное деление проходит четыре хорошо изученные фазы (рис. 12-43). В фазе S (синтез) ДНК реплицируется, образуя копии для обеих дочерних клеток. В фазе G2 (G от англ.gap — промежуток между делениями) синтезируются новые белки, и клетка увеличивается в размере примерно вдвое. В стадии М (митоз), разрушается ядерная оболочка материнской клетки, парные хромосомы оттягиваются к противоположным полюсам клетки, каждый набор дочерних хромосом окружается вновь образованной ядерной оболочкой, в процессе цитокинеза клетка пережимается пополам, образуя две дочерние клетки (см. рис. 24-25). В эмбриональной или быстро пролиферирующей ткани каждая дочерняя клетка снова делится, но только после периода ожидания (G1). В культурах тканей животных клеток весь процесс занимает около 24 ч.
Рис. 12-43. Клеточный цикл у эукариот. Продолжительность (в часах) четырех фаз варьирует, но приведенные здесь времена типичны.
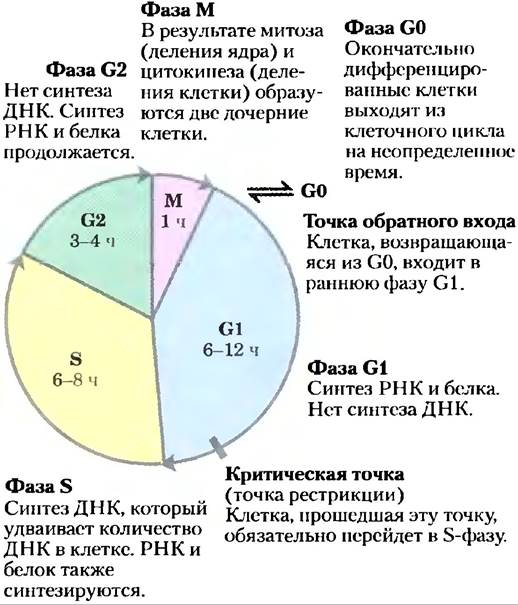
После прохождения через стадию митоза и G1 клетка либо продолжает следовать по циклу, вступая в следующее деление, либо прекращает делиться, оставаясь в фазе покоя (G0), которая может длиться часы, дни или все время жизни клетки. Когда находящаяся в фазе G0 клетка снова начинает делиться, она снова вступает в цикл в фазе G1. Дифференцированные клетки, такие как гепатоциты или адипоциты, уже приобрели свою специфическую форму и функцию; они остаются в фазе G0. Стволовые клетки сохраняют способность к делению и к дифференцировке в любые клетки в пределах определенного спектра клеток.
Уровни циклинзависимых протеинкиназ осциллируют (испытывают периодические изменения)
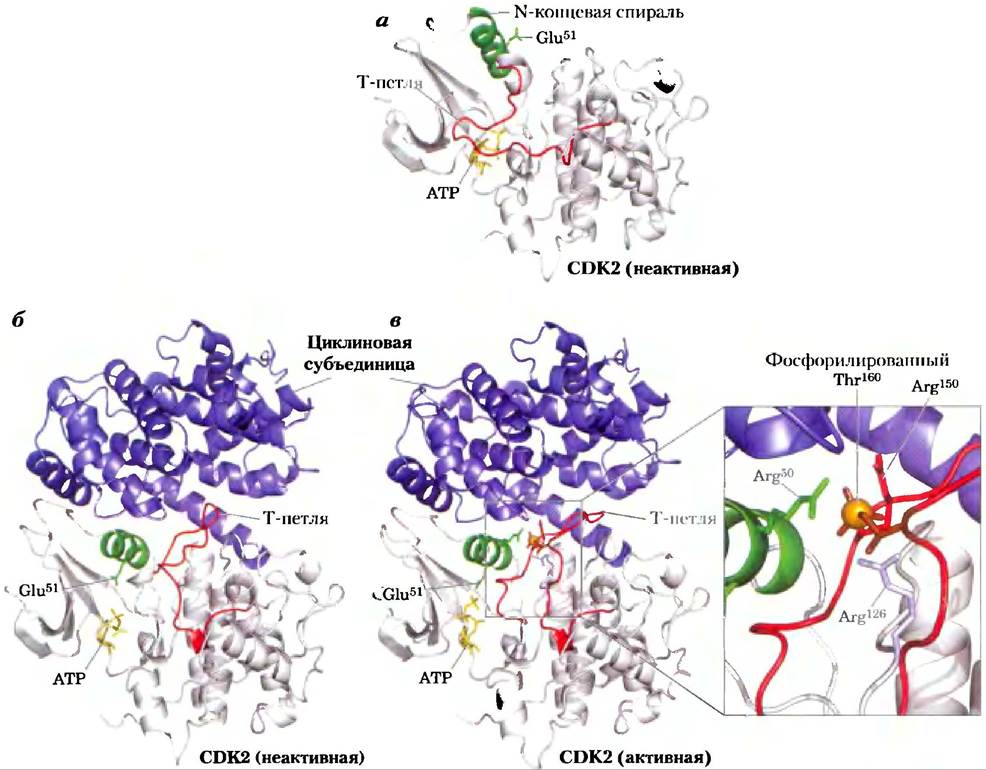
Временная регуляция клеточного цикла осуществляется семейством протеинкиназ, активность которых изменяется в ответ на клеточные сигналы. Фосфорилируя специфические белки в точно определенные моменты времени, эти протеинки- назы управляют метаболическими процессами в клетке, надлежащим образом обеспечивающими клеточное деление. Эти киназы являются гетерогримерами, содержащими регуляторную субъединицу циклин и каталитическую субъединицу — циклинзависимую протеинкиназу (СDК — от англ. cyclin-dependent protein kinase). В отсутствие циклина каталитическая субъединица практически неактивна. Когда циклин присоединяется, открывается каталитический центр и становится доступным нужный для катализа аминокислотный остаток (рис. 12-44), а активность каталитической субъединицы возрастает в 10 000 раз. В клетках животных есть по крайней мере 10 различных циклинов (обозначаемых А, В и т. д.) и как минимум восемь циклинзависимых протеин- киназ (СDК1-СDК8), которые работают в различных комбинациях на соответствующих фазах клеточного цикла. Растения также используют семейство СDК для регуляции деления клеток меристемы корней и побегов — основных тканей, в которых происходит деление.
Рис. 12-44. Активация циклинзависимых протеинкиназ (СDК) циклином и фосфорилирование. CDK (циклинзависимые протеинкиназы), семейство родственных ферментов; они активны, только если связаны с циклинами — белками другого семейства. Кристаллическая структура CDK2, связанной и не связанной с циклином, показывает, что необходимо для этой активации, а) Без циклина (PDB ID 1 НСК) CDK2 укладывается таким образом, что один сегмент (Т-петля) заслоняет участок связывания белковых субстратов и таким образом ингибирует активность протеинкиназы. Участок связывания АТР также находится вблизи Т-петли. б) Связывание циклина (PDB ID 1 FIN) вызывает конформационные изменения, отодвигающие Т-петлю от активного центра, и переориентирует N-концевую спираль, при этом ключевой для катализа остаток (Glu51) переносится в активный центр. в) Фосфорилирование остатка Thr в Т-петле дает отрицательно заряженный остаток, который стабилизируется путем взаимодействия с тремя остатками Arg, удерживая CDK в активной конформации (PDB ID 1JST).
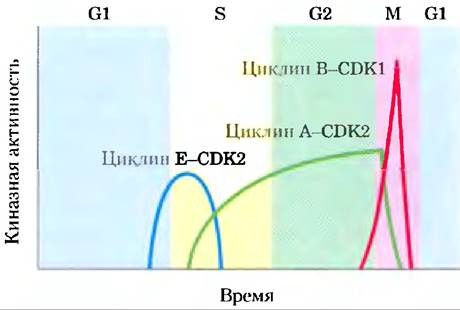
В популяции животных клеток при синхронном делении наблюдаются колебания (осцилляции) активности некоторых СDК (рис. 12-45). Эти колебания являются результатом регуляции активности СОК: фосфорилирования или дефосфорилирования СDК, контролируемой деградации циклиновой субъединицы, периодического синтеза СD-киназ и циклинов и действия специфических, ингибирующих СDК белков. Обычно активные СDК позволяют клетке войти в определенную стадию клеточного цикла.
Рис. 12-45. Колебания активности специфических CD-киназ у животных в процессе прохождения клеточного цикла. Активность циклиновой Е-СDК2 достигает пика вблизи границы фаз G1 и S, когда активный фермент запускает синтез ферментов, необходимых для синтеза ДНК (см. рис. 12-48). Активность циклиновой А-СDК2 возрастает в фазах S и G2, затем резко падает в фазе М, когда наблюдается пик активности циклиновой В-СDК1.
Регуляция СD-киназ посредством фосфорилирования. Активность СОК очень сильно зависит от фосфорилирования и дефосфорилирования двух ключевых остатков в белке (рис. 12-46, а). Фосфорилирование Туr15 вблизи N-конца делает СDК2 неактивной; остаток Ⓡ-Туr находится в АТР-связывающем центре киназы, и отрица-
тельно заряженная фосфатная группа блокирует вход АТР. Специфическая фосфатаза дефосфорилирует этот фосфотирозиновый остаток, обеспечивая связывание АТР. Фосфорилирование Thr160 в Т-петле CDK, катализируемое CDK- активирующей киназой, вытесняет Т-петлю из субстратсвязывающей щели, делая возможными связывание субстрата и проявление каталитической активности (рис. 12-44, е).
Одним из стимулов, запускающих этот механизм регуляции, является наличие однонитевых разрывов ДНК, которые приводят к остановке клеточного цикла в фазе G2. Специфическая протеинкиназа (у дрожжей называется Rad3), активируемая однонитевыми разрывами, запускает каскад, ведущий к инактивации фосфатазы, которая дефосфорилирует Туr15 в CDK. CD-киназа остается неактивной, и клетка останавливается в фазе G2. Клетка не делится до тех пор, пока ДНК не восстановится, и результаты действия каскада не окажутся повернуты вспять.
Контролируемая деградация циклина. Па протяжении клеточного цикла активность CDK регулирует высокоспецифический и рассчитанный во времени протеолитический распад митотических циклинов. Прохождение через митоз требует сначала активации, а потом деструкции циклинов А и В, которые активируют каталитическую субъединицу фазы М. Эти циклины содержат вблизи N-конца последовательность Arg-Thr-Ala-Leu-Gly-Ile-Gly-Asn — «блок деструкции», который делает циклины мишенью для деградации. (Термин «блок» (англ. box) заимствован из общей практики представления последовательности нуклеиновой кислоты или белка в виде диаграммы, на которой в блок выделяют короткую последовательность нуклеотидных или аминокислотных остатков, обладающих некоторой специфической функцией; при этом нс подразумевается никакой трехмерной структуры.) Белок DBRP (от англ. destruction box recognizing protein) узнает эту последовательность и инициирует процесс деградации циклина, соединяя вместе циклин и белок убиквитин. Циклин и активированный убиквитин связываются ковалентно с помощью фермента убиквитинлигазы (рис. 12-44, б). Затем присоединяются несколько дополнительных молекул убиквитина, давая сигнал протеолитическому ферментному комплексу, или протеасоме, деградировать циклин.
Рис. 12-46. Регуляция СDК путем фосфорилирования и протеолиза. а) Циклинзависимая протеннкнназа (СDК), активированная во время митоза (фаза М), содержит Т-петлю, которая укладывается в субстратсвязывающий сайт. Когда Тhr160 в Т-петле фосфорилируется, петля выдвигается из субстратсвязывающего центра, многократно активируя СDК (стадия (4)). б) Активный комплекс циклин-СDК запускает процесс самоинактивации путем фосфорилирования DВRР (белка, распознающего блок деструкции; стадия (6)). Затем DВRР и убиквитинлигаза присоединяют несколько молекул убиквитина (U) к циклину (стадия (7)), делая его мишенью деструкции протеасомами — протеолитическими ферментными комплексами (стадия (8)).
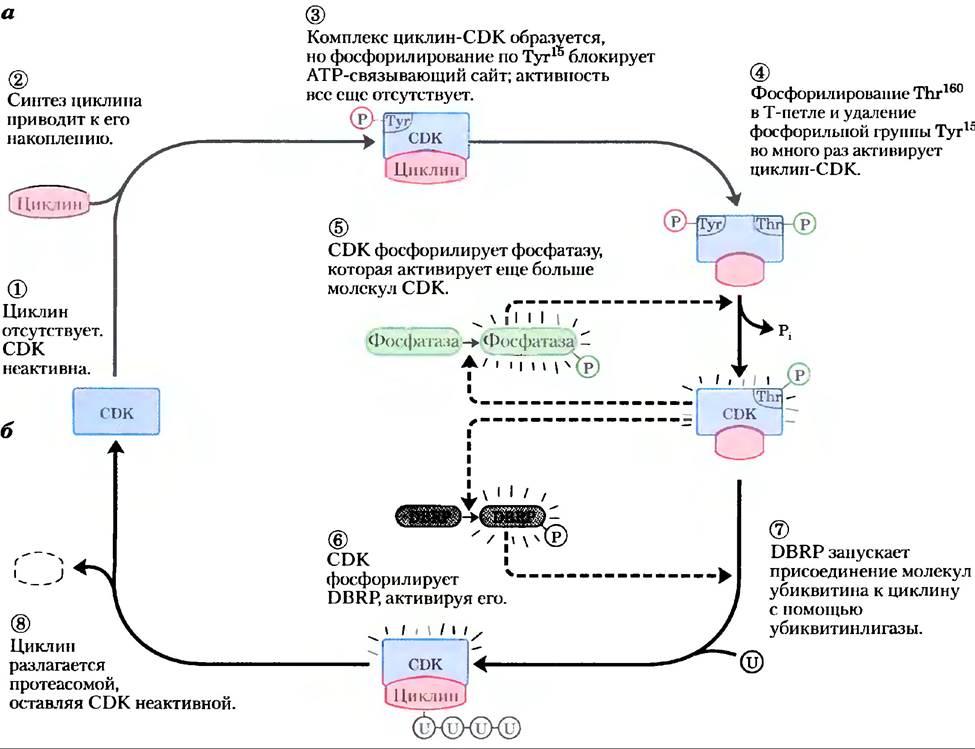
Как регулируется время разрушения циклина? Цепь обратной связи прослеживается для всего процесса, изображенного на рис. 12-46. Увеличение активности СDК активирует протеолиз циклина. Вновь синтезированный циклин связывается с СDК и активирует ее. СD-киназа фосфорилирует и активирует DВRР, активный DВRР вызывает протеолиз циклина. Пониженная концентрация циклина вызывает падение активности
СDК, а активность DВRР также уменьшается в результате медленного непрерывного дсфосфорилирования и инактивации посредством DВRР-фосфатазы. Наконец, уровень циклина восстанавливается путем синтеза новых молекул циклина.
Роль убиквитина и протеасом не ограничивается регуляцией уровня циклина; как мы увидим в гл. 27, они принимают участие в метаболизме и обновлении клеточных белков — процессах, фундаментальных для поддержания жизненно важных клеточных функций.
Регулируемый синтез CDK и циклинов. Третий механизм изменения активности CDK заключается в регуляции скорости синтеза циклина и (или) CDK.
Например, циклин D, циклил Е, CDK2 и CDK4 синтезируются, только когда для активации транскрипции соответствующих генов в ядре присутствует специфический фактор транскрипции E2F. Синтез E2F в свою очередь регулируется внеклеточными сигналами, такими как факторы роста и цитокины (индукторы клеточного деления) — веществами, которые необходимы для деления клеток млекопитающих в культуре. Эти ростовые факторы индуцируют синтез специфических ядерных факторов транскрипции, необходимых при продуцировании ферментов для синтеза ДНК. Факторы роста запускают фосфорилирование ядерных белков Jun и Fos — факторов транскрипции, которые способствуют синтезу продуктов большого числа генов, в том числе циклинов, CD-киназ и E2F. В свою очередь E2F регулирует производство нескольких ферментов, необходимых для синтеза дезоксинуклеотидов и ДНК, способствуя переходу клетки в фазу S (рис. 12-47).
Рис. 12-47. Регуляция клеточного деления факторами роста. Путь от ростовых факторов к клеточному делению проходит через ферментативный каскад, который активирует каскад МАРК, фосфорилирование ядерных факторов транскрипции Jun и Fos и активность фактора транскрипции Е2F, который способствует синтезу нескольких ферментов, необходимых для синтеза ДНК.
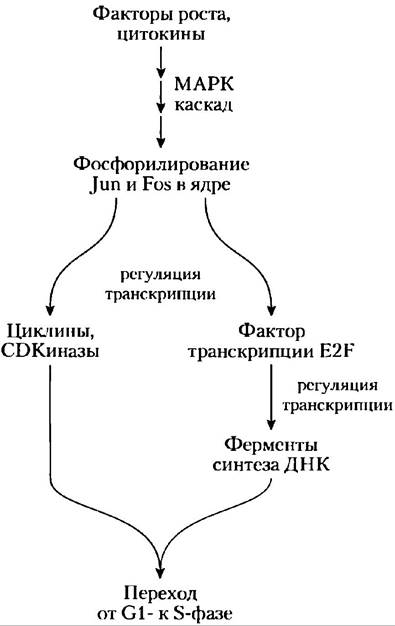
Ингибирование CDK. Наконец, специфические белковые ингибиторы связываются со специфическими CDK и инактивируют их. Одним из таких белков является р21, который мы опишем ниже.
Эти четыре регуляторных механизма модулируют активность специфических CDK, которые в свою очередь определяют, будет клетка делиться либо дифференцироваться, постоянно находиться в состоянии покоя или же после периода покоя начнет новый цикл. Детали регуляции клеточного цикла (число различных циклинов, киназ и их комбинаций) отличаются от вида к виду, но общий механизм в основном сложился и сохранился в процессе эволюции всех эукариотических клеток.
CDK регулируют клеточное деление путем фосфорилирования важных белков
Мы увидели, что клетки обеспечивают строгий контроль активности CDK. Но как активность CDK регулирует клеточный цикл? Список белков, известных как мишени действия CDK, продолжает расти, и еще многое предстоит узнать. Тем не менее мы можем представить себе общий механизм регуляции CDK, проследив действие CDK на строение ламинина и миозина и на активность белка ретинобластомы.
Структура ядерной оболочки частично поддерживается высокоорганизованными сетями промежуточных филаментов, состоящих из белка ламинина. Разрушение ядерной оболочки перед расхождением сестринских хроматид в митозе в какой-то мере обусловлено фосфорилированием ламинина посредством CDK, которое заставляет ламининовые филаменты деполимеризоваться.
Второй мишенью киназы является приводимая в действие с помощью АТР актомиозиновая сократительная система, которая пережимает делящуюся клетку, разделяя ее в процессе цитокинеза на две равные части. После деления клетки CD-киназа фосфорилирует небольшую регуляторную субъединицу миозина, вызывая отделение миозина от актиновых филаментов и инактивируя сократительный механизм. Последующее дефосфорилирование позволяет вновь осуществить сборку сократительного аппарата для следующего раунда цитокинеза.
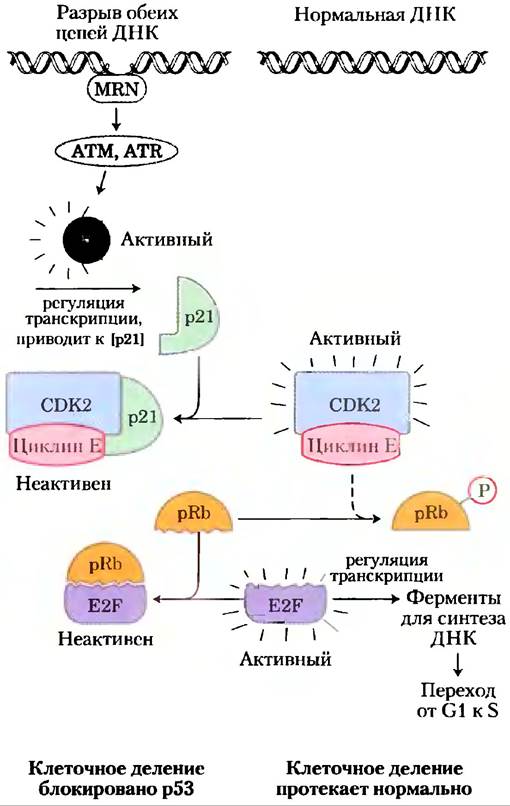
Третьим и очень важным субстратом CDK является белок ретинобластомы pRb; когда обнаруживается повреждение ДНК, этот белок участвует в механизме, который останавливает деление клетки в фазе G1 (рис. 12-48). Названный от клеточной линии из опухоли сетчатки, где он был открыт, pRb функционирует если не во всех, то в большинстве клеток, регулируя клеточное деление в ответ на множество стимулов. Нефосфорилированный pRb связывается с фактором транскрипции E2F и после связывания с pRb E2F не может стимулировать транскрипцию группы генов, необходимых для синтеза ДНК (гены для ДНК-полимеразы а, рибонуклеотидредуктазы и других белков; гл. 25). В этом состоянии клеточный цикл не может продвигаться от фазы G1 до фазы S, которая вводит клетку в митоз и деление. Механизм, блокирующий pRb-E2F, выключается, когда pRb фосфорилируется циклиновой E-CDK2, которая появляется в ответ на сигнал к клеточному делению.
Когда нротеинкиназы ATM и ATR обнаруживают повреждение ДНК, например, однонитевой разрыв, они активируют р53, который играет роль фактора транскрипции, стимулирующего синтез белка р21 (рис. 12-48). Этот белок ингибирует протеинкиназную активность циклиновой E-CDK2. В присутствии р21 белок pRb остается в нефосфорилированном состоянии и связан с E2F, активность фактора транскрипции блокируется, и клеточный цикл останавливается в фазе G1. Это дает клетке время для восстановления поврежденной ДНК перед вступлением в фазу S. Тем самым предотвращается губительный перенос поврежденного генома в одну или обе дочерние клетки. Если повреждение слишком серьезное, чтобы его можно было эффективно репарировать, тот же механизм запускает процесс апоптоза, описанный ниже, который приводит к гибели клетки, предотвращая возможное развитие рака.
Рис. 12-48. Регуляция перехода от фазы G1 к фазе S путем фосфорилирования pRb. Фактор транскрипции E2F стимулирует транскрипцию генов некоторых ферментов, необходимых для синтеза ДНК. Белок ретинобластомы pRb может связывать фактор E2F (внизу слева), инактивируя его и предотвращая транскрипцию таких генов. Фосфорилирование pRb под действием CDK2 предотвращает связывание и инактивацию E2F, так что гены продолжают транскрибироваться, а клетки делятся. Повреждение ДНК клетки (вверху слева) запускает серию событий, приводящих к инактивации CDK2, в результате чего деление клетки прекращается. Когда белок MRN обнаруживает повреждение ДНК, он активирует две протеинкиназы ATM и ATR, которые фосфорилируют и активируют транскрипционный фактор р53. Активный р53 стимулирует синтез белка р21 — ингибитора CDK2. Ингибирование CDK2 останавливает фосфорилирование pRb, который, следовательно, продолжает связывать и ингибировать E2F. При инактивации E2F необходимые для деления клетки гены не транскрибируются, и деление клетки останавливается. После репарации ДНК перечисленные события разворачиваются в обратном направлении, и клетка начинает делиться.
Краткое содержание раздела 12.11 Регуляция клеточного цикла протеинкиназами
■ Продвижение по клеточному циклу регулируется циклинзависимыми протеинкиназа- ми (СDК), которые действуют в специфических точках цикла, фосфорилируя ключевые белки и модулируя их активность. Каталитическая субъединица СОК неактивна, если не связана с регуляторной циклиновой субъединицей.
■ Активность комплекса циклин-СDК изменяется в процессе клеточного цикла посредством дифференциального синтеза СDК, специфической деградации циклина, фосфорилирования и дефосфорилирования критических остатков в СDК и связывания ингибиторных белков со специфическими комплексами циклин-СDК.