ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
14. ГЛИКОЛИЗ, ГЛЮКОНЕОГЕНЕЗ И ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
14.4. Глюконеогенез
Центральная роль глюкозы в метаболизме проявилась еще в начале эволюционного пути нашей биосферы, а для современных организмов — от микроба до человека — этот сахар остается практически универсальным источником энергии и строительным блоком. Некоторые ткани млекопитающих получают всю необходимую энергию только из глюкозы. Для головного мозга и нервной системы человека, а также эритроцитов, яичек, мозгового вещества почек и эмбриональных тканей глюкоза служит единственным или же главным источником энергии. Только для работы головного мозга ежедневно требуется 120 г глюкозы — это больше половины глюкозы, запасенной в форме гликогена в мышцах и печени. Однако этих запасов глюкозы не всегда хватает; гликоген расходуется между приемами пищи, при длительном голодании и после интенсивной физической нагрузки. В такие периоды организм должен синтезировать глюкозу из предшественников неуглеводной природы. Этот синтез осуществляется с помощью метаболического пути, называемого глюконеогенезом («новое» образование сахаров), в котором пируват и другие соединения, состоящие из трех или четырех атомов углерода, превращаются в глюкозу.
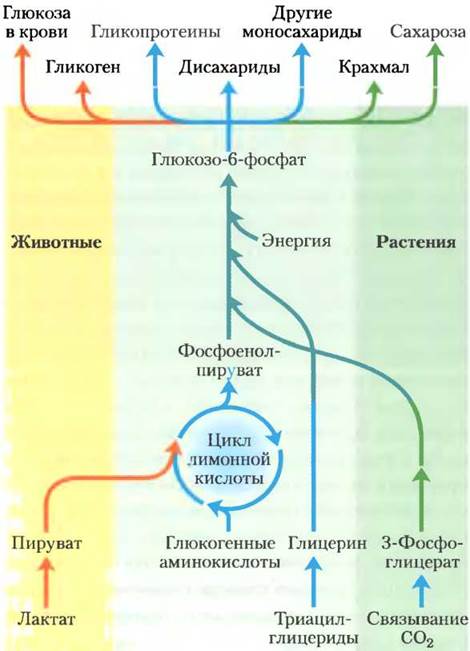
Глюконеогенез происходит в клетках животных, растений и микроорганизмов. Механизм этого процесса примерно одинаков во всех клетках и во всех организмах. У животных важными предшественниками глюкозы являются такие трехуглеродные соединения, как лактат, пируват и глицерин, а также некоторые аминокислоты (рис. 14-15). У млекопитающих глюконеогенез протекает преимущественно в печени и в меньшей степени в корковом веществе почек. Синтезированная глюкоза поступает в кровь для снабжения других тканей. Лактат, образующийся в мышцах в результате анаэробного гликолиза при тяжелой физической нагрузке, снова поступает в печень и превращается в глюкозу, которую кровь переносит обратно в мышцы, где из нее образуется гликоген; данный цикл называют циклом Кори (доп. 14-2; см. также рис. 23-20). В семенах растений запасные жиры и белки посредством нескольких метаболических путей, в том числе и глюконеогенеза, превращаются в дисахарид сахарозу, распределяющуюся по всему растению при его росте. Глюкоза и ее производные служат строительным материалом для создания клеточной стенки растений, нуклеотидов и коферментов, а также множества других важнейших метаболитов. У многих микроорганизмов глюконеогенез начинается с простых органических молекул, состоящих из двух или трех атомов углерода, таких как ацетат, лактат и пропионат, содержащихся в питательной среде.
Рис. 14-15. Синтез углеводов из простых предшественников. Путь превращения фосфоенолпирувата в глюкозоб-фосфат является общим при биосинтетических превращениях многих предшественников углеводов в клетках животных и растений. Однако только растения и фотосинтезирующие бактерии способны использовать СO2 для синтеза углеводов. В процессе превращения пирувата в фосфоенолпируват образуется оксалоацетат — промежуточное соединение цикла лимонной кислоты, который обсуждается в гл. 16. Таким образом, любое соединение, которое можно превратить в пируват или оксалоацетат, может служить исходным материалом для глюконеогенеза. К таким веществам относятся аланин и аспартат, превращаемые в пируват и оксалоацетат соответственно, а также другие аминокислоты, из которых образуются трех- или четырехчленные углеродные фрагменты (так называемые глюкогенные аминокислоты; см. табл. 14-4 и рис. 18-5). Растения и фотосинтезирующие бактерии обладают уникальной способностью преобразовывать СO2 в углеводы, используя глиоксилатный цикл (с. 212).
Хотя реакции глюконеогенеза одинаковы во всех организмах, метаболическое окружение и принципы регуляции этого процесса различаются в разных видах организмов и в разных тканях. В данном разделе мы обсудим, как протекает процесс глюконеогенеза в печени млекопитающих. В гл. 20 мы увидим, как фотосинтезирующие организмы используют этот метаболический путь для превращения первичных продуктов фотосинтеза в глюкозу для запасания ее в виде сахарозы или крахмала.
Метаболические пути гликолиз и глюконеогенез неидентичны, они протекают в противоположных направлениях, хотя на самом деле они имеют несколько общих стадий (рис. 14-16); семь из 10 ферментативных реакций глюконеогенеза — это обратные реакции гликолиза. Три реакции гликолиза in vivo необратимы и не могут использоваться в глюконеогенезе: превращение глюкозы в глюкозо-6-фосфат под действием гексокиназы, фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1,6-бисфосфата под действием фосфофруктокиназы-1 и превращение фосфоенолпирувата в пируват при участии пируватки- назы (рис. 14-16). В клетках эти реакции характеризуются большим отрицательным изменением стандартной свободной энергии, в то время как другие реакции гликолиза имеют ∆G, близкое к нулю (табл. 14-2). В глюконеогенезе три необратимые стадии осуществляются другим набором ферментов, которые катализируют экзергонические реакции с таким значением ∆G, что они протекают необратимо в сторону образования глюкозы. Таким образом, в клетках как гликолиз, так и глюконеогенез протекают необратимо. У животных оба пути осуществляются в основном в цитозоле, что требует их координированной регуляции. Независимая регуляция двух метаболических путей осуществляется через те ферментативные стадии, которые не являются для них общими.
Таблица 14-2. Изменение свободной энергии в реакциях гликолиза в эритроцитах
Реакция гликолиза |
∆G′°(кДж/моль) |
∆G (кДж/моль) |
(1) Глюкоза + АТР —> глюкозо-6-фосфат + ADP |
-16,7 |
33,4 |
(2) Глюкозо-6-фосфат ⇄ фруктозо-6-фосфат |
1,7 |
от 0 до 25 |
(3) Фруктозо-6-фосфат + АТР —> фруктозо-1,6-бисфосфат + ADP |
-14,2 |
-22,2 |
(4) Фруктозо-1,6-бисфосфат ⇄- дигидроксиацетонфосфат + глицеральдегид-3-фосфат |
23,8 |
от 0 до 6 |
(5) Дигидроксиацетонфосфат ⇄глицеральдегид-3-фосфат |
7,5 |
от 0 до 4 |
(6) Глицеральдегид-3-фосфат + Pi + NAD+ ⇄ 1,3-бисфосфоглицерат + NADH + Н+ |
6.3 |
от -2 до 2 |
(7) 1,3-Бисфосфоглицерат + ADP ⇄ 3-фосфоглицерат + АТР |
-18,8 |
от 0 до 2 |
(8) 3-Фосфоглицерат ⇄ 2-фосфоглицерат |
4,4 |
от 0 до 0,8 |
(9) 2-Фосфоглицерат ⇄ фосфоенолпируват + Н2O |
7,5 |
от 0 до 3,3 |
(10) Фосфоенолпируват + ADP —> пируват + АТР |
-31,4 |
-16.7 |
Примечание. Как определено в гл. 13 (с. 14-15), ∆G′° представляет собой изменение стандартной свободной энергии; ∆G — это изменение свободной энергии, рассчитанное на основании реальных концентраций интермедиатов гликолиза, находящихся в эритроцитах в физиологических условиях при pH 7,0. Оранжевым цветом выделены обходные реакции глюконеогенеза Приведенные выражения не уравнивались по числу атомов водорода и заряду (с. 28).
Мы начнем изучение глюконеогенеза с рассмотрения трех обходных реакций (вспомните, что под «обходными» реакциями подразумевают реакции, обходящие необратимые стадии гликолиза).
Превращение пирувата в фосфоенолпируват протекает в две экзергонические стадии
Первая обходная реакция глюконеогенеза — это превращение пирувата в фосфоенолпируват (ФЕП). Данный процесс не может осуществляться простым обращением пируваткиназной реакции гликолиза (с. 79), которая характеризуется большим отрицательным значением изменения стандартной свободной энергии и поэтому в интактной клетке необратима (табл. 14-2, реакция (10)). Вместо этого фосфорилирование пирувата реализуется по обходному пути, состоящему из последовательности реакций, которые в эукариотических клетках требуют участия как цитозольных, так и митохондриальных ферментов. Как мы увидим далее, изображенный на рис. 14-16 и описанный здесь во всех подробностях путь метаболизма представляет собой один из двух возможных путей превращения пирувата в ФЕП. Этот путь является основным, если предшественником для образования глюкозы служит пируват или аланин. Второй путь, описанный ниже, преобладает в том случае, когда предшественником глюкозы служит лактат.
Рис. 14-16. Противоположно направленные пути гликолиза и глюконеогенеза в печени крысы. Реакции гликолиза — слева, красным цветом; реакции глюконеогенеза — справа, синим цветом. Главные участки регуляции глюконеогенеза, изображенные на схеме, обсуждаются далее в данной главе и подробнее — в гл. 15. На рис. 14-19 представлен альтернативный путь превращений оксалоацетата, реализующийся в митохондриях.
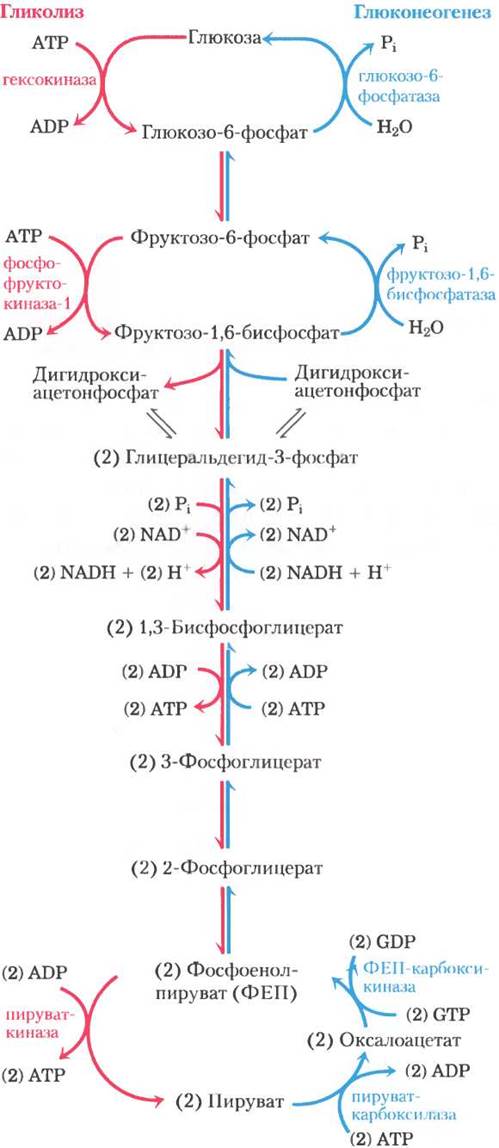
Рис. 14-17. Синтез фосфоенолпирувата из пирувата. а — в митохондриях пируват превращается в оксалоацетат в биотинзависимой реакции, катализируемой пируваткарбоксилазой. б — в цитозоле оксалоацетат под действием ФЕП-карбоксикиназы превращается в фосфоенолпируват, а включившийся в состав оксалоацетата СО2вновь выделяется. Декарбоксилирование приводит к перераспределению электронов, что облегчает атаку карбонильного кислорода на y-фосфатную группу GТР.
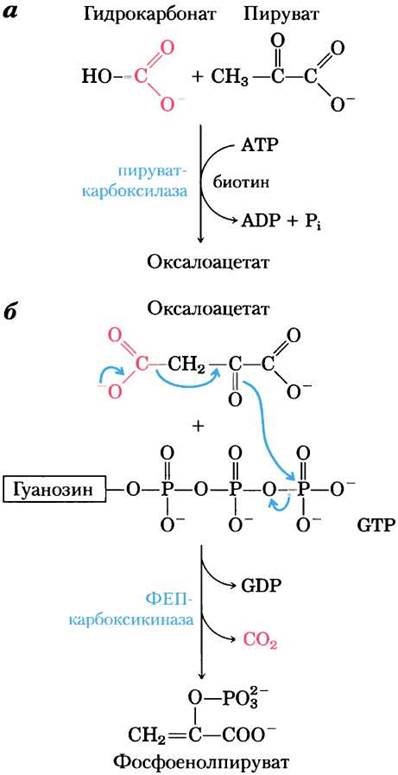
Прежде всего пируват транспортируется из цитозоля в митохондрии или образуется в митохондриях из аланина в процессе трансаминирования, при котором а-аминогруппа аланина удаляется (в результате чего образуется пируват) и переносится на α-кетокислоту (реакции транс- аминирования обсуждаются в гл. 18). Затем митохондриальный фермент пируваткарбоксилаза в присутствии кофермента биотина превращает пируват в оксалоацетат (рис. 14-17):
Пируват + НСO3- + АТР —> оксалоацетат + ADP + Pi (14-4)
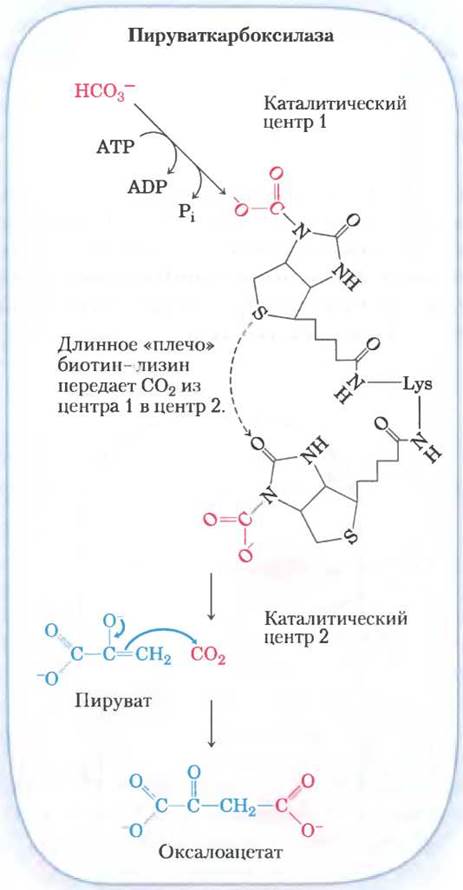
Биотин в реакции карбоксилирования играет роль переносчика активированного гидрокарбоната (рис. 14-18). Механизм реакции представлен на рис. 16-16. (Отметим, что НСO3 возникает при диссоциации угольной кислоты, образующейся из СO2 + Н2O.) В результате фосфорилирования НСO3 под действием АТР получается смешанный ангидрид (карбоксифосфат); затем биотин вытесняет фосфат, и образуется карбоксибиотин.
Рис. 14-18. Роль биотина в пируваткарбоксилазной реакции. Кофактор биотин ковалентно связан с ферментом амидной связью, соединяющей его с ε-аминогруппой остатка лизина, в результате чего образуется биотинилированный фермент. Пируваткарбоксилазная реакция протекает в две стадии, которые происходят в двух разных каталитических центрах на молекуле фермента. В каталитическом центре 1 гидрокарбонат превращается в СO2 с затратой одной молекулы АТР. Затем СO2 реагирует с биотином, образуя комплекс карбоксибиотина с ферментом. Длинное «плечо», состоящее из биотина и боковой цепи того лизина, к которому он присоединен, переносит СO2 от комплекса карбоксибиотин-фермент на каталитический центр 2 на поверхности фермента, где СO2 высвобождается и взаимодействует с пируватом, в результате чего образуется оксалоацетат и регенерируется биотинилированный фермент. Центральная роль подобных «гибких плеч» в переносе интермедиатов между активными центрами фермента проиллюстрирована на рис. 16-17, а детали механизма пируваткарбоксилазной реакции представлены на рис. 16-16. Подобный механизм реализуется и в других реакциях биотинзависимого карбоксилирования, катализируемых, например, пропионил-СоА-карбоксилазой (см. рис. 17-11) и ацетил- СоА-карбоксилазой (см. рис. 21-1).
Пируваткарбоксилаза — это первый регуляторный фермент глюконеогенеза, требующий присутствия ацетил-СоА в качестве активатора (ацетил-СоА образуется при окислении жирных кислот (гл. 17), и его накопление свидетельствует о возможности использования жирных кислот в качестве источника энергии). Как мы увидим в гл. 16 (см. рис. 16-15), катализируемая пируват- карбоксилазой реакция способна поставлять интермедиаты для другого важного метаболического пути — цикла лимонной кислоты.
Митохондриальная мембрана не содержит переносчиков оксалоацетата, поэтому до переноса в цитозоль образовавшийся из пирувата оксалоацетат переходит в восстановленную форму (малат — соль молочной кислоты) под действием митохондриального фермента малатдегидрогеназы, используя NАDН:
Оксалоацетат + NАDН + Н+⇄ L-малат + NАD+ (14-5)
В этой реакции изменение стандартной свободной энергии довольно значительное, но в физиологических условиях (в том числе при очень низкой концентрации оксалоацетата) ∆G ≈ 0, и реакция легко протекает в обратном направлении. Митохондриальная малатдегидрогеназа участвует и в глюконеогенезе, и в цикле лимонной кислоты, однако общие потоки метаболитов в этих двух процессах противоположные по направлению.
Малат покидает митохондрии с помощью специальной транспортной системы, находящейся во внутренней митохондриальной мембране (см. рис. 19-30). В цитозоле малат вновь окисляется до оксалоацетата с образованием NADH:
Малат + NAD+ —> оксалоацетат + NADH + Н+ (14-6)
Оксалоацетат затем превращается в ФЕП под действием фосфоенолпируваткарбоксикиназы (рис. 14-17). Эта Мg2+-зависимая реакция требует присутствия GTP в качестве донора фосфорильной группы:
Оксалоацетат + GTP ⇄ ФЕП + СO2 + GDP (14-7)
Во внутриклеточных условиях реакция обратима; образование одного богатого энергией фосфата (ФЕП) уравновешивается гидролизом другого фосфата (GTP).
Уравнение этого обходного метаболического пути получаем при суммировании уравнений от (14-4) до (14-7):
Пируват + ATP + GTP + НСO3- —> ФЕП + ADP + GDP + Pi + СO2 (14-8)
∆G'° = 0,9 кДж/моль
Итак, для превращения одной молекулы пирувата в ФЕП должны израсходоваться две высокоэнергетические фосфатные группы (одна от АТР и одна от GTP), каждая из них при внутриклеточных условиях обладает энергией -50 кДж/моль. Напротив, при превращении ФЕП в пируват в процессе гликолиза лишь одна молекула АТР синтезируется из ADP. Хотя изменение стандартной свободной энергии ∆G′° двустадийного превращения пирувата в ФЕП составляет 0,9 кДж/моль, истинное изменение свободной энергии с учетом внутриклеточных концентраций интермедиатов имеет довольно большое отрицательное значение (-25 кДж/моль). Это связано с тем, что образующийся ФЕП быстро расходуется в других реакциях, так что его концентрация постоянно находится на достаточно низком уровне. Таким образом, внутри клетки данная реакция практически необратима.
Обратите внимание, что в реакции, катализируемой ФЕП-карбоксикиназой, высвобождается та же самая молекула СO2, что присоединяется к пирувату на стадии, катализируемой пируваткарбоксилазой (рис. 14-17, б). Эта последовательность реакций карбоксилирования- декарбоксилирования служит для «активации» пирувата, поскольку декарбоксилирование оксалоацетата облегчает образование ФЕП. В гл. 21 мы обсудим, как подобная последовательность реакций карбоксилирования- декарбоксилирования используется для активации ацетил-СоА в биосинтезе жирных кислот (см. рис. 21-1).
Поясним, почему эти реакции происходят в митохондриях. Отношение [NADH]/ [NAD+] в цитозоле составляет 8 • 10-4, что примерно в 105 раз ниже, чем в митохондриях. Поскольку NADH из цитозоля расходуется в процессе глюконеогенеза для превращения 1,3- бисфосфоглицерата в глицеральдегид-3-фосфат (рис. 14-16), без достаточного количества NADH биосинтез глюкозы происходить не может. Транспортировка малата из митохондрий в цитозоль и его превращение в оксалоацетат способствует переносу восстановительных эквивалентов в цитозоль, где наблюдается их дефицит. Таким образом, превращение пирувата в ФЕП обеспечивает важный баланс в процессе глюконеогенеза между произведенным и израсходованным в цитозоле NADH.
Второй вариант обходной реакции от пирувата к ФЕП преобладает в тех случаях, когда исходным веществом для синтеза глюкозы служит лактат (рис. 14-19). Такой метаболический путь использует лактат, образовавшийся при гликолизе, например, в эритроцитах или в анаэробных условиях в мышцах, и он играет особенно важную роль у крупных позвоночных в период после интенсивной физической нагрузки (доп. 14-2). Превращение лактата в пируват в цитозоле гепатоцитов сопровождается образованием NАDН, поэтому в данном случае нет нужды в переносе восстановительных эквивалентов (в форме малата) из митохондрий.
Рис. 14-19. Альтернативные пути образования фосфоенол- пирувата (ФЕП) из пирувата. Вклад каждого из двух процессов определяется доступностью лактата или пирувата и потребностью в NАDН в цитозоле для глюконеогенеза. Справа — путь, преобладающий в том случае, когда исходным соединением является лактат, поскольку в результате лактат- дегидрогеназной реакции NАDH находится в цитозоле и его не нужно выкачивать из митохондрий (см. текст).
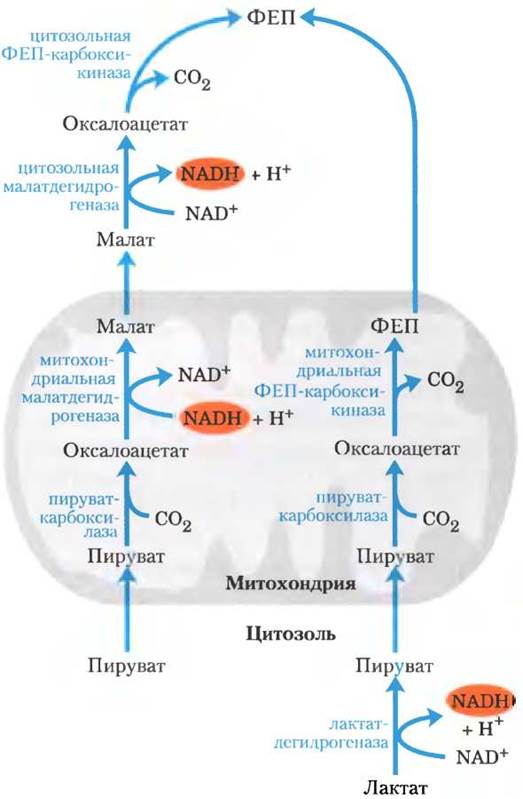
Пируват, образовавшийся в лактатдегидрогеназной реакции, переносится в митохондрии и превращается в оксалоацетат под действием пируваткарбоксилазы, как описано выше. Однако этот оксалоацетат под действием митохондриального изофермента ФЕП-карбоксикиназы превращается сразу в ФЕП, а ФЕП выносится из митохондрий для продолжения глюконеогенеза. Митохондриальный и цитозольный изоферменты ФЕП-карбоксикиназы кодируются разными хромосомными генами, что служит еще одним примером того, как два различных фермента, катализирующих одну и ту же реакцию, локализованы в разных частях клетки или имеют разные метаболические функции (вспомните изоферменты гексокиназы).
Второй обходной путь — превращение фруктозо-1,6-бисфосфата в фруктозо-6-фосфат
Еще одной реакцией гликолиза, которая не может использоваться для глюконеогенеза, является фосфорилирование фруктозо-6-фосфата под действием фосфофруктокиназы-1 (PFK-1; табл. 14-2, реакция (D). Эта реакция характеризуется большим отрицательным значением изменения стандартной свободной энергии и, следовательно, необратима в условиях клетки, поэтому образование фруктозо-6-фосфата из фруктозо-1,6- бисфосфата (рис. 14-16) осуществляется под действием другого фермента — Mg2+-зависимой фруктозо-1,6-бисфосфатазы (ФБФаза-1). При этом происходит практически необратимый гидролиз фосфатной группы у атома С-1 (а не перенос фосфорильной группы на ADP):
Фруктозо-1,6-бисфосфат + Н2O —> фруктозо-6-фосфат + Pi
∆G'° = -16,3 кДж/моль
Следует отличать ФБФазу-1 от сходного фермента ФБФазы-2, выполняющего регуляторную функцию (см. гл. 15).
Третий обходной путь — образование глюкозы из глюкозо-6-фосфата
Этот обходной путь реализуется на заключительной стадии глюконеогенеза и представляет собой дефосфорилирование глюкозо-6-фосфата с образованием глюкозы (рис. 14-16). Обращение гексокиназной реакции (с. 71) требовало бы переноса фосфатной группы от глюкозо-6-фосфата на ADP с образованием АТР, что энергетически невыгодно (табл. 14-2, реакция (1)). Реакция, катализируемая глюкозо-6-фосфатазой, не сопровождается синтезом АТР, это просто гидролиз эфира фосфорной кислоты:
Глюкозо-6-фосфат + Н2O —> глюкоза + Рi
∆G′° = -13,8 кДж/моль
Этот Mg2+-зaвисимый фермент обнаруживается на люменальной поверхности эндоплазматического ретикулума гепатоцитов, клеток почек и эпителиальных клеток тонкой кишки (см. рис. 15-28), но не других тканей, которые, следовательно, не могут поставлять глюкозу в кровь. Если бы другие ткани содержали глюкозо-6-фосфат, данная ферментативная активность позволяла бы гидролизовать глюкозо-6-фосфат, необходимый этим тканям для гликолиза. Глюкоза, образующаяся в результате глюконеогенеза в печени или почках, а также потребляемая с пищей, доставляется в мозг и в мышечные ткани кровотоком.
Глюконеогенез необходим, но сопряжен с большими энергетическими затратами
Реакции биосинтеза, ведущие от пирувата к глюкозе (табл. 14-3), можно выразить суммарным уравнением:
2 Пируват + 4 АТР + 2 GTP + 2 NADH + 2 Н+ + 4 Н2O —> глюкоза + 4 ADP + 2 GDP + 6 Pi +2 NAD+ (14-9)
Итак, для образования из пирувата одной молекулы глюкозы требуется израсходовать шесть высокоэнергетических фосфатных групп — четыре из АТР и две из GTP. Кроме того, для восстановления двух молекул 1,3-бисфосфоглицерата необходимы две молекулы NADH. Поэтому понятно, что с помощью уравнения 14-9 записана не просто обратная реакция превращения глюкозы в пируват в процессе гликолиза, таким образом показано, что затрачиваются только две молекулы АТР:
Глюкоза + 2 ADP + 2 Pi + 2 NAD+ —> 2 пируват + 2 АТР + 2 NADH + 2 Н+ + 2 Н2O
Таблица 14-3. Последовательность реакций глюконеогенеза с пируватом в начальной точке пути

Примечание. Обходные реакции выделены оранжевым цветом; все другие реакции — обратные стадии гликолиза. Цифры справа указывают на то, что данная реакция должна быть учтена дважды, поскольку для образования молекулы глюкозы требуется два трехуглеродных предшественника. Здесь не рассматривались реакции, необходимые для восполнения в цитозоле NАDН, затраченного в глицеральдегидфосфатдегидрогеназной реакции (превращение лактата в пируват в цитозоле или перенос восстановительных эквивалентов из митохондрий в цитозоль в форме малата). Приведенные реакционные схемы не уравнивались по числу атомов водорода и заряду (с. 28).
Синтез глюкозы из пирувата — это энергозатратный процесс. Большая часть энергетических затрат связана с необходимостью обеспечить необратимость процесса глюконеогенеза. Во внутриклеточных условиях общее изменение свободной энергии при гликолизе составляет примерно -63 кДж/моль, а изменение свободной энергии при глюконеогенезе -16 кДж/моль (в тех же условиях). Таким образом, в клетке гликолиз и глюконеогенез протекают необратимо.
Интермедиаты цикла лимонной кислоты и некоторые аминокислоты являются глюкогенными
Изложенный выше путь биосинтеза глюкозы реализуется при ее образовании не только из пирувата, но также из других четырех-, пяти- и шестиуглеродных соединений, возникающих в цикле лимонной кислоты (гл. 16). Цитрат, изоцитрат, α-кетоглутарат, сукцинил-СоА, сукцинат, фумарат и малат — интермедиаты цикла лимонной кислоты; они могут окисляться, превращаясь в оксалоацетат (см. рис. 16-7). Некоторые или даже все атомы углерода из большинства аминокислот, образующихся при катаболизме белков, в итоге включаются в состав пирувата или интермедиатов цикла лимонной кислоты. Иными словами, такие аминокислоты в конце концов превращаются в глюкозу, и поэтому их называют глюкогенными (табл. 14-4).
Таблица 14-4. Глюкогенные аминокислоты (сгруппированы по месту вхождения в цикл лимонной кислоты)

Примечание. Эти аминокислоты служат предшественниками глюкозы в крови или гликогена в печени, поскольку могут превращаться в пируват или интермедиаты цикла лимонной кислоты. Из 20 аминокислот лишь лейцин и лизин не способны поставлять углерод для синтеза глюкозы.
* Эти аминокислоты являются еще и кетогенными (см. рис. 18-21).
У млекопитающих наиболее важные глюкогенные аминокислоты — аланин и глутамин, переносящие аминогруппы в печень из других тканей (см. рис. 18-9). После удаления аминогрупп в митохондриях клеток печени углеродные скелеты этих аминокислот (пируват и α-кетоглутарат) легко включаются в глюконеогенез.
Млекопитающие не могут превращать жирные кислоты в глюкозу
Полное превращение жирных кислот в глюкозу в организме млекопитающих невозможно. Как мы увидим в гл. 17, катаболизм большинства жирных кислот приводит к образованию лишь ацетил-СоА. Млекопитающие не могут превращать ацетил-СоА в глюкозу, поскольку катализируемая пируватдегидрогеназой реакция необратима, а в клетках нет другого пути для превращения ацетил-СоА в пируват.
Растения, дрожжи и многие бактерии имеют возможность превращать ацетил-СоА в оксалоацетат (глиоксилатный цикл; см. рис. 16-20), поэтому эти организмы могут использовать жирные кислоты в качестве исходного материала для глюконеогенеза. Этот процесс имеет большое значение, например, при прорастании семян, пока листья не разовьются в достаточной степени, чтобы с помощью фотосинтеза производить необходимое количество энергии и углеводов; при прорастании семян запасные жиры используются для производства энергии и синтеза клеточной стенки.
Млекопитающие не могут превращать жирные кислоты в углеводы, но они могут использовать небольшое количество глицерина, образующегося при распаде жиров (триацилглицеринов), для глюконеогенеза. Фосфорилирование глицерина под действием глицераткиназы с последующим окислением центрального атома углерода приводит к образованию в печени дигидроацетонфосфата — промежуточного продукта глюконеогенеза.
Как мы увидим в гл. 21, глицерофосфат является важным промежуточным продуктом в синтезе триацилглицеринов в адипоцитах, однако эти клетки не имеют глицераткиназы и поэтому не могут фосфорилировать глицерин. Вместо этого адипоциты осуществляют укороченную версию глюконеогенеза, известную под названием глицеронеогенеза; этот процесс заключается в превращении пирувата в дигидроксиацетонфосфат в соответствии с начальными стадиями глюконеогенеза с последующим восстановлением дигидроксиацетон- фосфата до глицерофосфата (см. рис. 21-21).
Гликолиз и глюконеогенез взаимно регулируются
Если процессы гликолиза (превращение глюкозы в пируват) и глюконеогенеза (превращение пирувата в глюкозу) идут одновременно с высокими скоростями, результатом являются потребление АТР и выделение тепла. Например, фосфофруктокиназа-1 и фруктозобисфосфатаза-1 катализируют реакции, идущие в противоположных направлениях:
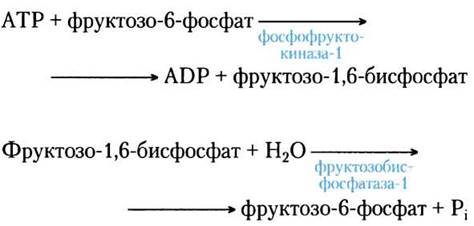
Суммарное уравнение этих двух реакций:
АТР + Н2О —> АDР + Pi + тепло
Эти две ферментативные реакции, как и ряд других реакций гликолиза и глюконеогенеза, регулируются аллостерически и путем ковалентной модификации (фосфорилирования).
В гл. 15 мы рассмотрим механизмы регуляции подробнее. Сейчас достаточно сказать, что регуляция происходит таким образом, что при интенсификации превращения глюкозы в пируват превращение пирувата в глюкозу ослабевает, и наоборот.
Дополнение 14-4. МЕДИЦИНА. Почему пифагорейцы не ели фалафель: дефицит глюкозо-6-фосфатдегидрогеназы
Бобы фава — основной компонент арабского блюда фалафель (с античных времен использовались в пищу жителями Средиземноморья и Ближнего Востока). Греческий философ и математик Пифагор запретил своим ученикам употреблять в пищу эти бобы из-за того, что они, возможно, были причиной фавизма — заболевания, приводящего в некоторых случаях к смерти, поскольку при фавизме в течение 24-48 ч после употребления в пищу бобов фава эритроциты начинают лизировать, высвобождая в кровь свободный гемоглобин, развивается анемия, желтуха, увеличивается печень и селезенка. Похожие симптомы наблюдаются при лечении противомалярийным препаратом примахином, сульфамидными антибиотиками, а также от некоторых гербицидов. Симптомы имеют генетическую природу, а именно дефицит фермента глюкозо-6-фосфатдегидрогеназы (Г6ФДГ), который встречается примерно у 400 млн человек по всему миру. В большинстве случаев дефицит фермента никак не проявляется, а клинические симптомы наблюдаются лишь при сочетании генетического дефекта с воздействием определенных факторов внешней среды.
Первую реакцию пентозофосфатного пути, в результате которого образуется NADPH, катализирует глюкозо-6-фосфатдегидрогеназа (см. рис. 14-21). Этот важный для многих процессов биосинтеза восстановитель, кроме того, защищает клетки от окислительного повреждения под действием пероксида водорода Н2O2 и свободных супероксидных радикалов — высокоактивных окислителей, возникающих в качестве побочных продуктов метаболизма, в результате действия некоторых лекарств (примахина), а также дивицина — токсичного компонента бобов фава. В норме Н2O2 превращается в воду под действием восстановленного глутатиона и глутатионпероксидазы, а окисленный глутатион обратно переходит в восстановленную форму под действием глутатионредуктазы и NADPH (рис. 1). Кроме того, Н2O2 расщепляется на кислород и воду под действием фермента каталазы, для активности которого также необходим NADPH. При недостаточности Г6ФДГ понижена продукция NADPH, поэтому разложение Н2O2ингибируется. В результате в клетке может происходить пероксидирование липидов, приводящее к разрушению мембран эритроцитов, окисление белков, а также возникать дефекты ДНК.
Рис. 1. Роль NADРН и глутатиона в защите клеток от активных форм кислорода. Восстановленный глутатион (GSН) защищает клетку, разрушая пероксид водорода и гидроксильный радикал. Для возвращения окисленной формы глутатиона (GSSG) в восстановленную форму требуется NАDРН, образующийся под действием глюкозо-6- фосфатдегидрогеназы.
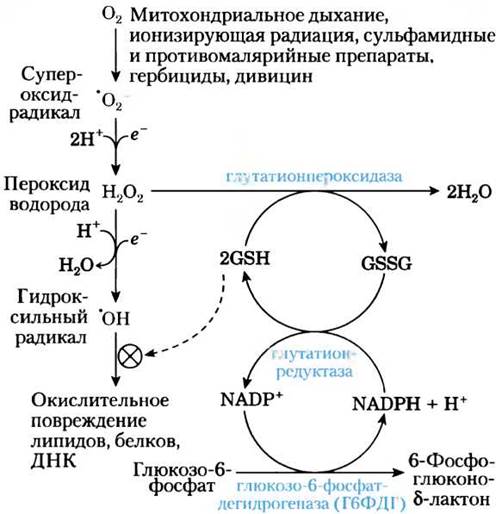
Обращает на себя внимание то, как распределяется дефект Г6ФДГ. Этот дефект встречается у 25% населения в тропической Африке, в некоторых районах Ближнего Востока и Юго-Восточной Азии, т. е. в областях с высоким уровнем распространения малярии. Кроме эпидемиологических наблюдений, результаты исследований in vitro показали, что в дефицитных по Г6ФДГ эритроцитах замедляется рост возбудителя малярии Plasmodium falciparum. Этот паразит очень чувствителен к окислительному повреждению и уничтожается при таком уровне окислительного стресса, который не оказывает пагубного влияния на организм хозяина. Баланс между устойчивостью против малярии и пониженным сопротивлением к окислительным повреждениям поддерживает существование Г6ФДГ- дефицитного генотипа в популяции людей, живущих в областях распространения малярии. Дефицит Г6ДФГ вызывает серьезные клинические последствия только при чрезмерном окислительном стрессе, вызванном лекарствами, гербицидами или дивицином.
Считается, что действие противомалярийного препарата примахина связано с созданием окислительного стресса для возбудителя. Определенная ирония заключается в том, что противомалярийный препарат по тому же самому биохимическому механизму может вызвать болезнь. Дивицин тоже действует в качестве противомалярийного препарата, а употребление бобов фава может уберечь от малярии. Отказываясь от фалафеля, пифагорейцы с нормальной активностью Г6ФДГ могли подвергать себя повышенному риску заболеть малярией!
Краткое содержание раздела 14.4 Глюконеогенез
■ Глюконеогенез происходит везде; это многостадийный процесс, в результате которого пируват или родственные трехуглеродные соединения (лактат, аланин) превращаются в глюкозу. Семь (обратимых) стадий глюконеогенеза катализируются теми же ферментами, что участвуют в гликолизе.
■ Три необратимые стадии глюконеогенеза осуществляются по обходным путям при участии специфических ферментов глюконеогенеза: 1) пируваткарбоксилаза и ФЕП- карбоксикиназа катализируют превращение пирувата в ФЕП через оксалоацетат; 2) фруктозобисфосфатаза-1 катализирует дефосфорилирование фруктозо-1,6-бисфосфата; 3) глюкозо-6-фосфатаза катализирует дефосфорилирование глюкозо-6-фосфата.
■ Образование глюкозы из пирувата — энергозатратный процесс: для образования одной молекулы глюкозы требуется 4 АТР, 2 GTP и 2 NADH.
■ У млекопитающих глюконеогенез протекает в печени и почках, снабжая глюкозой головной мозг, мышцы и эритроциты.
■ Пируваткарбоксилаза активируется в присутствии ацетил-СоА, что повышает скорость глюконеогенеза, если клетка уже имеет достаточное количество других субстратов (жирных кислот) для получения энергии.
■ Животные не могут превращать в глюкозу ацетил-СоА, образованный при катаболизме жирных кислот; растения и микроорганизмы обладают такой способностью.
■ Гликолиз и глюконеогенез взаимно регулируются, что позволяет избежать неэкономного ведения обоих процессов одновременно.